NF-кB参与七氟烷预处理所致延迟性抗大鼠心肌缺血再灌注损伤
2013-08-28吴雪梅乔世刚
吴雪梅,王 琛,谢 红,乔世刚,覃 琴,刘 霞
(苏州大学附属第二医院麻醉科,江苏苏州215004)
吸入麻醉药预处理(anesthetic preconditioning,APC)被证实在多种实验动物模型中可产生类似缺血预处理的延迟性心肌保护作用,又称第二保护窗(second window of protection,SWOP)[1-2]。SWOP起效缓慢而持久,时间窗宽,临床上有充分的时间在可能产生心肌缺血的外科手术前给予,可更方便有效地预防围术期心肌缺血的并发症。目前,就SWOP具体作用机制报道较少[3-4]。研究发现,核转录因子-кB(nuclear factor-kappaB,NF-κB)信号传导通路与心肌缺血再灌注(ischemia/reperfusion,I/R)损伤、缺血预处理及一些药物预处理的心肌保护密切相关[5-6]。因此,本研究拟通过使用NF-κB的特异性抑制剂 PTN干预,研究七氟烷 SWOP与NF-κB蛋白之间的关系,旨在证实七氟烷预处理对在体大鼠心肌的SWOP作用;并探讨七氟烷SWOP的可能保护机制。
1 材料与方法
1.1 七氟烷预处理与动物模型制备
清洁级雄性SD大鼠,体质量270~350 g[苏州大学医学院实验动物中心提供,许可证号:SYXK(苏)2007-0035]。将大鼠置入特制玻璃箱内进行七氟烷预处理,玻璃箱进口端由Sevotec 5七氟烷挥发罐(Dräger Vapor 2000,Dräger Medical公司)持续输入2.5%七氟烷(批号:8702,雅培制药有限公司上海分公司),气体流量为3 L/min,出口端连接ULT-Ⅰ型麻醉气体监测仪(Datex-Ohmeda公司)监测七氟烷、O2及CO2的浓度。吸入七氟烷1和2 h时分别进行血气分析,后将大鼠放回笼内正常饮食饲养。24 h后建立大鼠在体心肌I/R损伤模型[7]。
1.2 实验分组与处理
1.2.1 心肌梗死范围部分:48只大鼠,随机分为6组(n=8)。对照组(CON组)和单纯缺血组(I/R组)吸入空气2 h;PTN和DMSO组于吸入空气前15 min腹腔内注射PTN(500 μg/kg)和PTN的溶剂DMSO;七氟烷预处理组(SWOP组)吸入2.5%七氟烷2 h;PTN+SWOP组于七氟烷预处理前15 min腹腔内注射PTN,I/R和SWOP组于吸入气体前15 min腹腔内注射相等容量的0.9%氯化钠注射液作为对照。各组大鼠均于24 h后建立I/R损伤的在体模型(CON组建立模型后不采取任何手术和干预),实验中监测并记录血液动力学变化,实验结束用氯化三苯四氮唑染色法测定左心室心肌梗死范围。
1.2.2 蛋白部分:1)未缺血部分:48只大鼠随机分为6组(n=8),即CON、SWOP、七氟烷对照组(SEVO组)、DMSO、PTN和PTN+SWOP组,所有处理同1.2.1,于大鼠心肌缺血前或相应时间点取左心室心肌标本。SEVO组七氟烷预处理24 h后建立模型,不经历缺血再灌注3 h(30 min平衡期+30 min缺血期+2 h再灌注期)后取心肌标本。2)再灌注后部分:取48只雄性SD大鼠,随机分为6组(n=8),CON、I/R、SWOP、DMSO、PTN 和 PTN+SWOP组。所有处理同1.2.1,分别于大鼠心肌缺血再灌注后或相应时间点取心肌标本。
1.3 在体大鼠心肌梗死范围的测定
心肌缺血再灌注结束后即刻再次阻断左冠状动脉前降支(LAD),颈内静脉注射5%伊文思蓝使心脏正常区域蓝染,迅速取出心脏,分离左心室并用心脏切割器横断分割成5~6块2 mm厚的组织。分离蓝染的正常组织,将未染色的危险区组织置于0.5%TTC中,37℃水浴15 min,10%甲醛固定过夜。梗死区被染为灰白色,显微镜下分割并称重,心肌梗死范围以梗死区心肌重量占缺血区心肌重量的百分比表达。
1.4 Western blot法蛋白检测
采用 Western blot法测定 NF-кB(P65,P50)蛋白表达[8]。
1.5 统计学分析
采用SPSS 13.0统计软件进行统计处理。计量资料以均数±标准差)表示,组内比较采用重复测量数据的方差分析,组间比较采用单因素方差分析。
2 结果
2.1 血液动力学结果
平衡期,各组各指标间差异无统计学意义。与平衡期相比,除CON组外各组再灌注1和2 h时平均动脉压(MAP)和心率收缩压乘积(RPP)降低(P<0.05)(表1)。
2.2 梗死面积结果:
与I/R组(54% ±9%)相比,SWOP组(35% ±2%)的心肌梗死范围减少(P<0.05)(表2)。
表1 5组大鼠实验期间的血液动力学指标变化的比较Table 1 Haemodynamics comparison of five groups during experimental session,n=8)
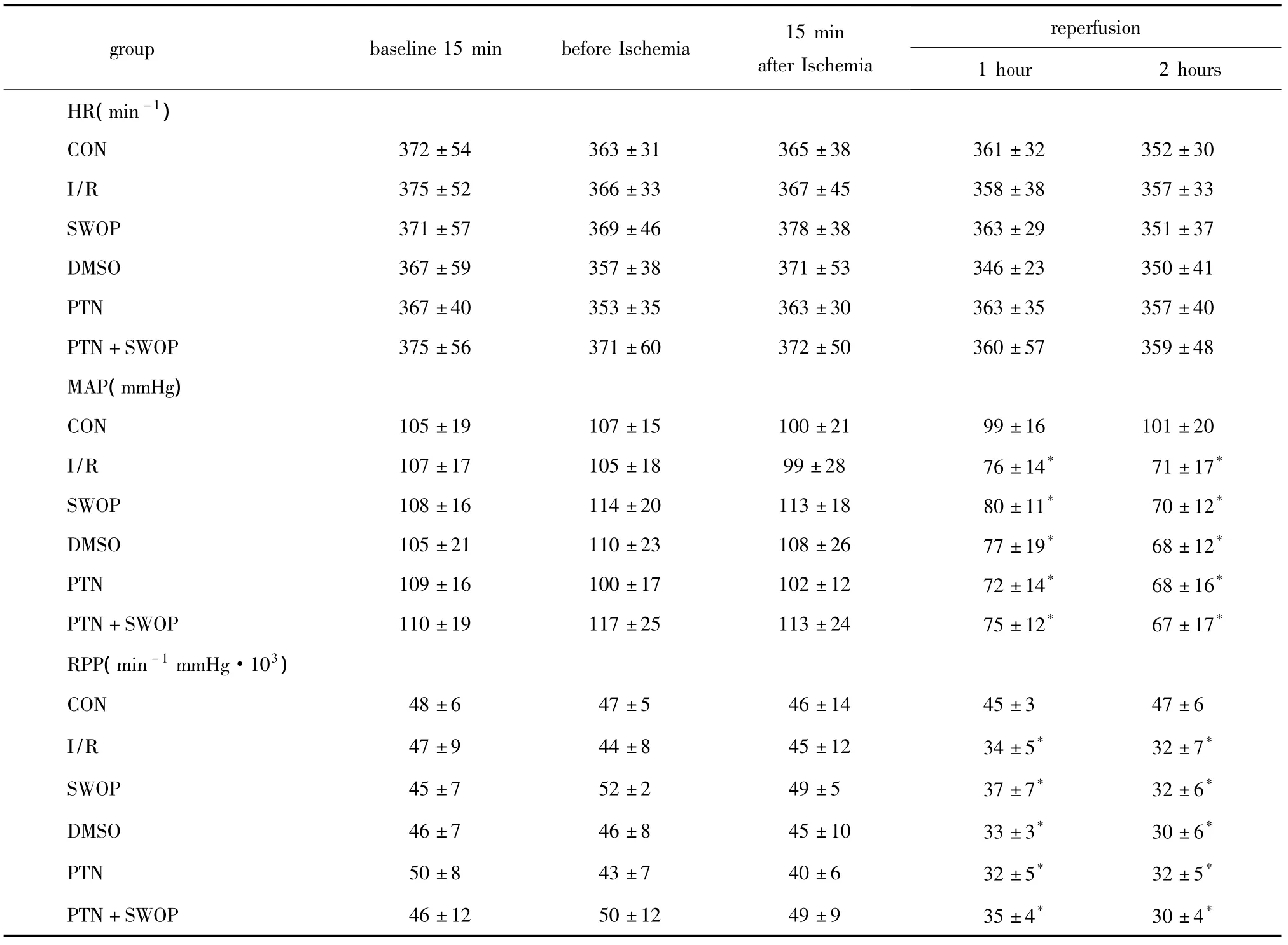
表1 5组大鼠实验期间的血液动力学指标变化的比较Table 1 Haemodynamics comparison of five groups during experimental session,n=8)
*P <0.05 compare with baseline group(1 mmHg=0.133 kPa).
reperfusion 1 hour 2 hours HR(min-1 group baseline 15 min before Ischemia 15 min after Ischemia)CON 372±54 363±31 365±38 361±32 352±30 I/R 375±52 366±33 367±45 358±38 357±33 SWOP 371±57 369±46 378±38 363±29 351±37 DMSO 367±59 357±38 371±53 346±23 350±41 PTN 367±40 353±35 363±30 363±35 357±40 PTN+SWOP 375±56 371±60 372±50 360±57 359±48 MAP(mmHg)CON 105±19 107±15 100±21 99±16 101±20 I/R 107±17 105±18 99±28 76±14* 71±17*SWOP 108±16 114±20 113±18 80±11* 70±12*DMSO 105±21 110±23 108±26 77±19* 68±12*PTN 109±16 100±17 102±12 72±14* 68±16*PTN+SWOP 110±19 117±25 113±24 75±12* 67±17*RPP(min-1mmHg·103)CON 48±6 47±5 46±14 45±3 47±6 I/R 47±9 44±8 45±12 34±5* 32±7*SWOP 45±7 52±2 49±5 37±7* 32±6*DMSO 46±7 46±8 45±10 33±3* 30±6*PTN 50±8 43±7 40±6 32±5* 32±5*PTN+SWOP 46±12 50±12 49±9 35±4* 30±4*
表2 6组心肌梗死范围的比较Table 2 Myocardial infarct size of five groups,n=8)

表2 6组心肌梗死范围的比较Table 2 Myocardial infarct size of five groups,n=8)
*P<0.05 compare with I/R group.
group left ventricular(mg)area at risk(mg)infarct area(mg)area at risk/left ventricular(%)infarct/left ventricular(%)infarct size(%of area at risk)508±52 190±52 100±29 38±9 20±6 53±5 CON 520±31 - - - - -I/R 507±17 180±33 97±20 35±6 19±3 54±9 SWOP 569±37 204±82 74±28* 36±14 13±5* 35±2*DMSO 527±35 200±34 98±22 40±6 19±4 49±5 PTN 514±37 181±35 96±22 35±7 19±5 53±10 PTN+SWOP
2.3 Western blot检测结果
2.3.1 未缺血部分:SWOP和 SEVO组 NF-кB(P65,P50)蛋白表达高于CON组(P<0.05);DMSO、PTN 和 PTN+SWOP 组 NF-кB(P65,P50)蛋白表达低于SWOP组(P<0.05)(图1、2)
2.3.2 再灌注后部分:各组NF-кB(P65,P50)蛋白表达较CON组均上调(P<0.05);SWOP组NF-кB(P65,P50)蛋白上调幅度低于I/R组(P<0.05);DMSO、PTN 和 PTN+SWOP 组 NF-кB(P65,P50)蛋白表达高于SWOP组(图1、2)

3 讨论
采用经典阻断冠状动脉血流方法,建立大鼠在体心肌I/R损伤模型,结合本课题组前期七氟烷SWOP在大鼠离体 Langendorff模型中的研究结果[2,9],并根据文献报道吸入异氟烷2 h可在大鼠在体心肌I/R损伤模型中产生SWOP作用[10],最终选择七氟烷SWOP的吸入时间为2 h。七氟烷预处理期间,采取尾动脉置管进行血气分析,监测大鼠PCO2和PaO2,观察是否有低氧血症或高二氧化碳血症的发生。结果显示:采用1MAC(2.5%)的七氟烷对大鼠进行预处理2 h,大鼠的循环和呼吸系统均处于稳定的正常生理状态,说明本研究的动物模型稳定,实验方法可靠。
实验将心肌危险区面积控制在35%左右,排除了由于缺血范围的差异而导致心肌梗死范围、蛋白变化的实验误差,以保证结果的可靠性。结果显示:SWOP组梗死范围较I/R组减小,证明七氟烷预处理对大鼠心肌I/R损伤具有SWOP作用。而在七氟烷预处理前给予PTN可阻断其保护作用,推测NF-кB至少部分参与了七氟烷SWOP的保护机制。
吸入异氟烷触发的氧化应激启动了早期应答基因的合成(如:NF-κB),随后指导参与KATP通道激活介导的心肌 SWOP作用的蛋白表达[11]。应用NF-κB的抑制剂DDTC能消除有NO信号传导通路介导的APC的SWOP作用[12]。本研究Western blot结果亦显示:I/R后,I/R和 SWOP组较 CON组NF-кB蛋白表达均上调;SWOP组蛋白上调幅度低于I/R组;PTN+SWOP组蛋白表达较I/R组无差异。即在七氟烷预处理期前给予NF-кB特异性抑制剂PTN,使再灌注后NF-кB蛋白大量表达,造成心肌I/R损伤,阻断了七氟烷预处理SWOP作用。从蛋白水平进一步证实,NF-кB参与了七氟烷预处理的SWOP作用机制。
本研究新见解在于,七氟烷预处理可下调24 h后大鼠心肌 I/R后期 NF-κB,减轻I/R损伤,产生SWOP作用。相信随着对NF-κB信号通路的深入研究,可望阐明APC等相关心肌延迟性保护作用机制,进一步理解和掌握I/R损伤的发病过程,为临床抗心肌缺血药物预处理找一个新靶点。
[1]Xiao YY,Chang YT,Ran K,et al.Delayed preconditioning by sevoflurane elicits changes in the mitochondrial proteome in ischemia-reperfused rat hearts [J].Anesth Analg,2011,113:224-232.
[2]Lutz M,Liu H.Inhaled sevoflurane produces better delayed myocardial protection at 48 versus 24 h after exposure[J].Anesth Analg 2006,102:984-990.
[3]刘流,冉珂,常业怡.异氟烷延迟预处理对兔心肌缺血再灌注时Bcl-2和caspase-3蛋白表达的影[J].中南大学学报(医学版),2010,35:346-350.
[4]Tsutsumi YM,Kawaraguchi Y,Horikawa YT,et al.Role of caveolin-3 and glucose transporter-4 in isoflurane-induced delayed cardiac protection [J].Anesthesiology,2010,112:1136-1145.
[5]Chen CH,Chuang JH,Liu K,et al.Nitric oxide triggers delayed anesthetic preconditioning-induced cardiac protection via activation of nuclear facter-kappaB and upregulation of inducible nitric oxide synthase[J].Shock,2008,30:241-249.
[6]Wang C,Xie H,Liu X,et al.Role of nuclear factor-kappaB in volatile anaesthetic preconditioning with sevoflurane during myocardial ischaemia/reperfusion[J].Eur J Anaesthesiol,2010,27:747-56.
[7]刘霞,谢红,吴雪梅,等.七氟烷预处理对心肌缺血再灌注大鼠心肌细胞凋亡的影响[J].中华麻醉学杂志,2010,30:598-600.
[8]覃琴,谢红,王琛,等.NF-kB参与七氟烷预处理减轻大鼠心肌缺血再灌注损伤[J].基础医学与临床,2011,31:247-251.
[9]Konia MR,Schaefer S,Liu H.Nuclear factor-kappa B inhibition provides additional protection against ischemia/reperfusion injury in delayed sevoflurane preconditiong[J].Eur J Anaesthesiol,2009,26:496-503.
[10]Tanaka K,Ludwing LW,Krolikowski JG,et al.Tsoflurane produces delayed preconditiong against myocardial ischemia and reperfusion injury:role of cycclooxgenase-2[J].Anesthesiology,2004,100:525-531.
[11]Serfeev P,da Silva R,Lucchinetti E,et al.Trigger-dependent gene expression profiles in cardiac preconditioning:evidence for distinct genetic programs in ischemic and anesthesic preconditioning [J].Anesthesiology,2004,100:474-488.
[12]Chen CH,Chuang JH,Liu K,et al.Nitric oxide triggers delayed anesthetic preconditioning-induced cardiac protection via activation of nuclear facter-kappaB and upregulation of inducible nitric oxide synthase[J].Shock,2008,30:241-249.
