人骨髓间充质细胞脑内移植治疗食蟹猴脑缺血
2013-08-28安沂华赵春华王任直
朱 华,冯 铭,卢 珊,李 秦,刘 颖,安沂华,赵春华,王任直,秦 川*
(中国医学科学院北京协和医学院1.比较医学中心卫生部比较医学重点实验室;2.实验动物研究所Motac合作实验室,北京100021;3.北京协和医院,北京100730;4.基础医学研究所,北京100005;5.北京神经外科研究所,北京100039)
缺血性脑卒中在脑血管病的发病率居首位[1],是由各种原因诱发脑血管栓塞引起的脑组织缺血、缺氧,进一步诱发脑神经细胞变性、坏死,最终导致神经功能障碍和功能丧失的一类疾病。目前针对缺血性脑血管病的治疗主要是手术和溶栓,效果比较明显。但由缺血诱发的神经细胞变性坏死而导致的神经功能障碍却没有很好的治疗方法。传统认为神经细胞难以再生,干细胞的出现改变了人们的观点。骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSCs)具有多分化潜能,特性稳定,获取方便,易于分离、培养及鉴定,在体外培养多代后仍能保持多向分化潜能。已有大量研究证实BMSCs可明显改善啮齿类脑缺血动物模型的临床症状[2-4],但未见以人骨髓间充质干细胞(human bone marrow-derived mesenchymal stem cells,hBMSCs)治疗非人灵长类脑缺血模型的报道。本研究在建立稳定食蟹猴脑缺血模型的基础上,对脑内移植hBMSCs的效果进行系统观察和评价,为临床应用提供参考。
1 材料与方法
1.1 实验动物
成年雄性食蟹猴18只,军事医学科学院实验动物中心,动物合格证号【SCXK-(军)2007-005】,年龄4~6岁,体质量4.2~4.5 kg。
1.2 脑缺血模型的制作
使用光化学法建立脑缺血模型,具体方法见参考文献[5]。
1.3 干细胞治疗
hBMSCs由中国医学科学院基础医学研究所赵春华教授提供。
1.3.1 动物分组:18只动物分为模型组(CG),干细胞移植高剂量组(5×106,HDG)和低剂量组(1×106,LDG),每组6只。移植的时间窗为造模后4周。
1.3.2 细胞注射:细胞为250 μL无色悬液,5个移植途径,每点移植量为50 μL,移植速度10 μL/min。对照组等体积0.9%氯化钠注射液。
1.4 移植效果的评价
1.4.1 行为学:神经功能评分:使用文献[6]中的方法在造模后1及3 d和1、2、3及4周及干细胞注射后1 及3 d和1、2、3、4、5、6 及 8 周对动物的神经功能进行评分。精准上肢运动测试:按照参考文献[7]中的方法在造模后1及3 d和1、2、3及4周及干细胞注射后1 及3 d和1、2、3、4、5、6 及8 周采集实验数据。
1.4.2 影像学:1)头颅MRI扫描:造模后24 h,以后每2周1次进行MRI检查,观察干细胞植入后动物脑部缺血灶形态和大小变化;仪器型号:Philips Intera Achiva 3.0T磁共振仪。2)18F-FDG-PET头颅扫描:造模后24 h,以后每2周1次进行PET扫描。观察梗死周围能量代谢情况。选择梗死最明显的层面为感兴趣区,测定缺损区域的最低标准摄取值(Standardized Uptake Value,SUV),计算 SUV%(SUV%= 同侧SUVX100%/对侧相应区域 SUV)。仪器:Siemens ECAT EXACT HR+型高分辨PET仪。所用18FFDG为北京协和医院PET中心自行生产。
1.4.3 组织病理学检查:1)组织处理:干细胞移植后2和12周每组分别处死动物3只动物,参照文献[10]的方法取材。标本经10%中性甲醛固定、石蜡包埋切片、苏木素-伊红(H.E)染色。2)梗死面积的测定:用AperioGL全自动数字病理切片扫描系统并计算各个梗死灶面的长度和宽度,确定梗死灶的最大面积。
1.5 统计学分析
统计分析使用SPSS13.0软件,行为学评价采用单因素方差分析(one-way ANOVA)LSD两两比较,梗死面积的统计用配对t检验。
2 结果
2.1 行为学
各组动物在造模后及干细胞移植后均无死亡。
2.1.1 神经功能评分:神经功能评分在干细胞植入2周后显著降低(P<0.05),这种差异一直持续到动物全部被安乐(图1)。
2.1.2 精准上肢运动测试:干细胞治疗后1 d,动物的行为学表现已出现好转,但与对照组比较无显著性差异。从治疗后3 d开始到治疗后第8周,剂量组动物抓取水果块的时间显著减少 (P<0.05)(图2)。
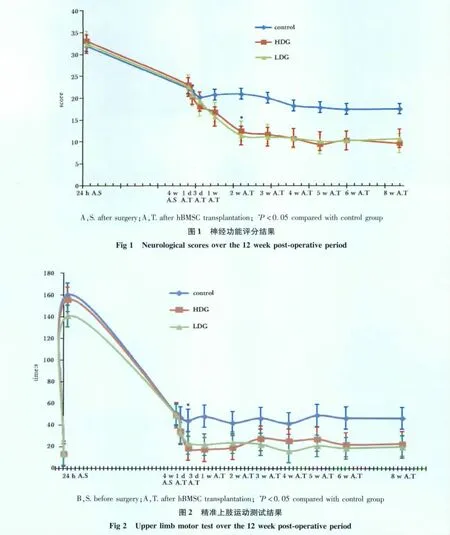

图2 干细胞移植前后PET,MRI检查结果Fig 2 The PET and MRI result before and after hBMSC transplantation of the high-dose group,the low-dose group,and the control group
2.2 MRI扫描
术后24 h手术区域可见DW1高信号,主要累及壳核外侧和右侧大脑半球颞顶叶皮质,中线向左侧移位,左侧侧脑室明显受压变形。移植后2周,高剂量组缺血损伤部位的修复速度高于低剂量组和对照组,移植后4、6、8和10周高、低剂量组缺血灶的修复速度基本相等,均高于对照组(图2A-E)。
2.3 PET扫描
造模后缺血灶周围的细胞代谢显著降低。干细胞移植后2周缺血灶周围皮质的SUV逐渐升高(图2F-U)。移植后4、6周高、低剂量组和对照组皮质及壳核外侧的SUV%显著升高(P<0.05)。8周时高剂量组皮质的SUV%显著高于对照组(P<0.05)。其余时间点各组ROI的SUV%无统计学差异(表1)。
2.4 组织病理学
2.4.1 梗死面积:干细胞移植后2、12周,低剂量组的梗死面积明显小于对照组间(P<0.05)(表2)。2.4.2 镜下观察结果:1)注射后2周模型组与高低剂量镜下均可见脑膜增厚,脑膜血管扩张充血,脑皮质灶性坏死,泡沫细胞增生,胞浆内含铁血黄素沉积,灶性炎细胞浸润。坏死区周围血管旁炎细胞袖套状浸润。高、低剂量组脑组织空泡变性程度较模型组轻,可见较多新生血管。2)注射后12周模型组、高、低剂量组均可见脑皮质局部缺损及瘢痕形成,泡沫细胞增生,周围脑组织空泡变性(图3)。
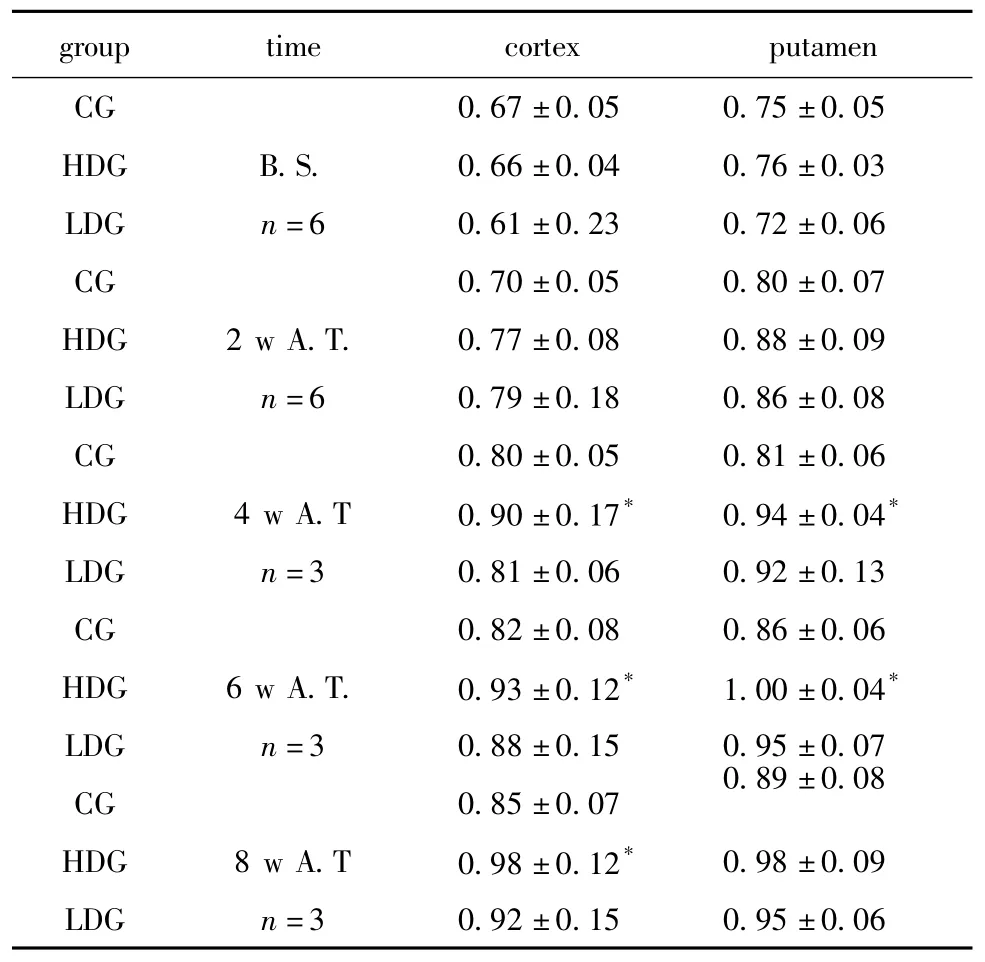
表1 移植前后感兴趣区域SUV%值Table 1 SUV%in selected ROIs

表1 (续)
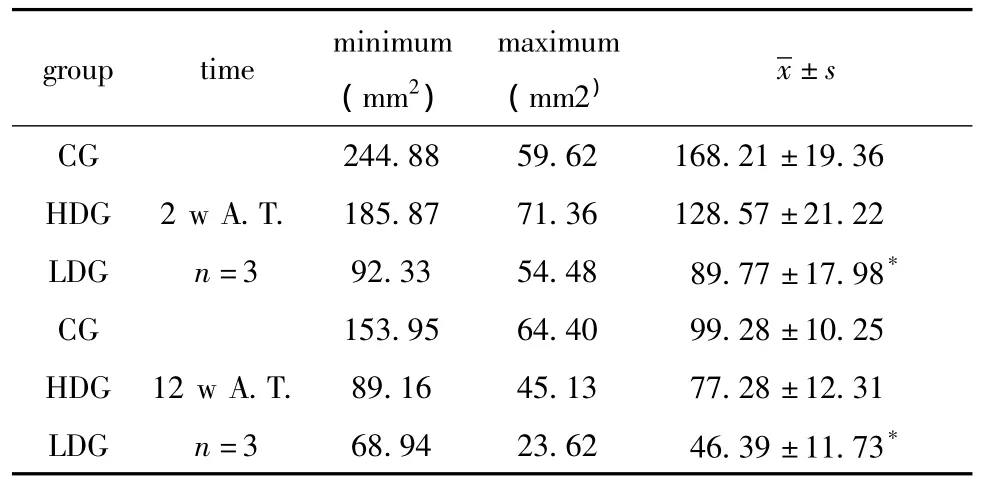
表2 脑梗死面积Table 2 Iesion volume of brain
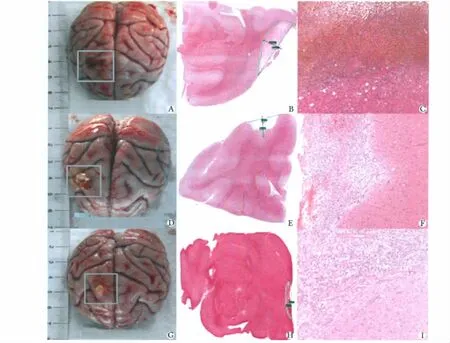
图3 干细胞移植前后病理学检查结果Fig 3 The pathological result before and after hBMSC transplantation of the high-dose group,the low-dose group,and the control group
3 讨论
尽管很多学者已经在小鼠、大鼠等动物身上证明非人类BMSCs直接脑内注射安全有效,并能在脑内广泛迁移和向神经细胞方向分化[8-9]。但有关hBMSCs直接注入非人灵长类脑内效果的报导还很少。由于缺血性脑卒中发生的类型、病变的部位以及范围各不相同,使干细胞移植选择病例变得困难。有实验选择局部缺血损害病例,相对于弥漫性脑缺血损害,可能更容易获得良性分析结果[10]。并且目前尚无研究资料证实,干细胞移植治疗对于脑白质损害和皮质损害疗效有何不同。另外,关于BMSCs参与脑损伤修复的报道多集中于急性期[11-12],分析其可能的原因是急性期的微环境有利于BMSCs向神经细胞的分化。因此,本实验选择使用光化学法建立稳定的局灶性脑缺血模型,并在此基础上用脑立体定位法在损伤局部周围直接注入骨髓间充质干细胞,并观察到治疗12周,通过行为学、影响学和组织病理学对移植效果进行了评价。组织病理学观察到了梗死灶的明显减小,移植组较对照组梗死灶周围新生血管增生明显。移植后2周MRI检查可见模型组梗死灶修复速度慢于高剂量组。PET结果显示第4、6和8周高剂量组的代谢增高速度明显大于对照组。行为学观察发现对照组动物术后肌肉麻痹,不能站立,上肢的精准运动能力丧失,hBMSCs移植的动物到12周时感觉和运动神经功能的缺失基本恢复。
本研究从影像学、行为学、组织病理学等方面证实hBMSCs移植到成年食蟹猴脑内后动物的神经功能出现了改善。为进一步研究干细胞这一治疗神经系统疾病新手段的临床应用提供了参考,移植模式和评价方法对临床有一定的指导义。
[1]Broderick JP,Brott T,Tomsick T,et al.The risk of subarachnoid and intracerebral hemorrhages in blacks as compared with whites[J].N Eng JMed,1992,326:733 -736.
[2]Zhang H,Huang Z,Xu H et al.Differentiation and neurological benefit of the mesenchymal stem cells transplanted into the rat brain following intracerebral hemorrhage[J].Neurol Res,2006,28:104 -112.
[3]Nan Z,Grande A,Sanberg CD,et al.Infusion of human umbilical cord blood ameliorates neurologic deficits in rats with hemorrhagic brain injury[J].Ann N Y Acad Sci,2005,1049:84 -96.
[4]Chen J,Li Y,Zhang R,et al.Combination therapy of stroke in rats with a nitric oxide donor and human bone marrow stromal cell enhances angiodenesis and neurogenesis[J].Brain Res,2004,1005:21 -28.
[5]朱华,李秦,冯铭,等.光化学法制作食蟹猴局部脑缺血模型[J].中国比较医学杂志,2008,18:32 -34.
[6]朱华,李秦,刘颖,等.一种改进的非人灵长类神经功能缺损评价方法[J].中国比较医学杂志,2011,21:59-62.
[7]朱华,李秦,刘颖,等.上肢精准测试系统在食蟹猴脑缺血研究中的应用[J].中国比较医学杂志,2011,21:53-56.
[8]Iryna AI,Kate B,Jason D,et al.Preclinical evaluation of adult stem cell engraftment and toxicity in the CNS of rhesus macaques[J].Mol therapy,2006,13:1173 - 1184.
[9] Oswald J,Boxberger S,Jorgensen B,et al.Mesenchymal stem cells can be differentiated into endothelial cells in vitro[J].Stem Cells,2004,22:377 -384.
[10]Bruder SP,Jaiswal N,Haynesworth SE.Growth kinetics,self-renewal,and theosteogenic potenitial of purified humanmesenchymal stem cells during extensive subcultivation and following cryopreservation[J] J cell Biochem,1997,64:278 -294.
[11]Aronowski J,Hall CE.New horizons for primary intracerebral hemorrhage treatment:Experience from preclinical studies[J].Neurol Res,2005,27:268 -279.
[12]Young RG,Butler DL,Weber W,et al.Use of mesenchymal stem cellsin a collagen matrix for Achilles tendon repair[J].J Orthop Res,1998,16:406 -413.
