DDAH2抑制低氧诱导大鼠心肌细胞H9c2(2-1)凋亡
2013-08-28李旭光罗通行黄亨建王兰兰
吴 斌,李旭光,张 玫,罗通行,黄亨建,王兰兰*
(1.四川大学华西医院实验医学科,四川成都610041;2.上海交通大学附属第一人民医院心血管内科,上海200080)
急性冠脉综合征(acute coronary syndrome,ACS)患者胸痛发作通常导致心脏血供受阻从而导致心肌缺血再灌注的发生。心肌缺血/再灌注与心肌细胞凋亡有密切关系[1-2];研究亦表明,心肌细胞凋亡是缺血/再灌注损伤发病机制的重要环节之一,然而其具体分子机制目前并不明了[3]。一氧化氮(NO)作为一种重要的胞内信使在心肌细胞凋亡中扮演重要的角色[4]。非对称性二甲基精氨酸(asymmetric dimethylarginine,ADMA)作为体内L-精氨酸内源性代谢产物能竞争性抑制一氧化氮合酶(NOS)活性,从而减少NO合成[5];心脏ADMA主要经二甲基精氨酸二甲胺水解酶-Ⅱ(Dimethylarginine dimethylamine hydrolase-2,DDAH2)代谢而消除[6]。前期我们已经报道DDAH基因与冠心病、脑卒中等发生存在紧密关联,然而仍然不明确其确切的生物学机制[7]。目前尚未报道,DDAH2过表达对于心肌细胞的保护作用。本实验旨在研究过表达DDAH2对于低氧条件下诱导心肌细胞H9c2(2-1)凋亡的影响和是否激活保护性蛋白内皮型一氧化氮合酶(eNOS)。
1 材料与方法
1.1 主要试剂
DMEM高糖培养基、胎牛血清和胰蛋白酶(Gibco公司);大鼠H9c2(2-1)心肌细胞系(中国科学院上海细胞库);WST-1细胞毒试剂、转染试剂FuGene HD和PVDF膜(罗氏公司);DDAH2真核细胞表达质粒(北京奥润东源公司);Qiagen Plasmid Endo-free Midi kit(Qiagen公司);AnnexinV-FITC-PI细胞凋亡检测试剂盒(南京凯基公司);eNOS抑制剂L-NAME(上海碧云天公司);NOS3(eNOS)抗体、p-NOS3-ser1177抗体和 GAPDH抗体(Santa-cruz公司);DDAH2抗体(Abcam公司)。T75细胞培养瓶和6、12和96孔细胞培养板(NUNC公司)。实验中所用其他试剂均为进口或国产分析纯试剂。
1.2 DDAH2真核细胞表达质粒提取与转染
DDAH2真核细胞表达质粒为商品化质粒,直接前述之方法转染感受态细胞,行中量提取;按照商品化(转染级)质粒中量提取试剂盒之所述方法提取质粒。转染方法为说明书之方法步骤。
1.3 细胞存活率实验分组与分析(细胞毒实验)
H9c2(2-1)细胞种植于96孔细胞培养板,待生长至70%汇合度后,即可将培养基更换为含2%胎牛血清的DMEM高糖培养基,饥饿培养6 h;随机分为正常对照(37 ℃,21%O2,5%CO2,74%N2)(ct)组,低氧(37 ℃,5%O2,5%CO2,90%N2)(hy)组,低氧+转染试剂(hy+tr)组,低氧+过表达DDAH2(hy+D)组,每组均设5个复孔。正常和低氧细胞培养条件下分别干预12、24与36 h,以确定最终干预时间点。完成后,每孔 WST-1溶液加入量为10 μL,置于细胞培养箱30 min,然后在450 nm测定吸光度,该数值水平反映存活细胞数量高低。
1.4 Western blot检测
收集培养时间为36 h的正常对照(ct)组、低氧(hy)组、低氧+转染试剂(hy+tr)组和低氧+过表达DDAH2(hy+D)组等各组心肌细胞,提取总蛋白,Broadford法进行蛋白定量,以每泳道20~25 μg蛋白量上样,经SDS-PAGE电泳分离蛋白,转膜装置置于4℃冰箱、电压25 V、转膜12 h蛋白转移至PVDF膜上室温下脱脂奶粉封闭2.5 h,用一抗DDAH2(1∶1 000~3 000)、p-NOS3 ser1177(1∶2 000)、NOS3(1∶2 000)和GAPDH(1∶2 000)孵育过夜,漂洗3~6次,再用辣根过氧化物酶标记的羊、兔和鼠二抗(1∶5 000)室温分别孵育2~3 h,曝光显影成像通过凝胶分析系统,将目的蛋白条带与相应内参蛋白条带吸光度比值的均数±标准差)表示。
1.5 细胞凋亡分组和检测
H9c2(2-1)细胞种植于12孔细胞培养板,其他同前;随机分为正常对照(ct)组,低氧(hy)组,低氧+转染试剂(hy+tr)组,低氧+过表达DDAH2(hy+D)组,低氧+过表达DDAH2+L-NAME(hy+D+L)组,每组均设3个复孔,干预时间为36 h。干预完成后,把细胞培养液吸出至新的1.5 mL离心管内,1×PBS洗涤贴壁细胞1次,加入适量胰蛋白酶工作液(含有EDTA)消化细胞。镜下观察,若细胞变圆,即可停止消化,加入含有胎牛血清的DMEM高糖培养基中和胰蛋白酶的作用,然后轻轻吹打5~10次,切勿次数太多。1 000 r/min 5 min,弃掉上清;加入前述中收集的细胞培养液,稍混匀,转移到离心管内,约 (5~10)×106/L细胞数,随 后再次1 000 r/min 5 min,弃上清,收集细胞,用1×PBS轻轻吹打混匀细胞;标准为肉眼可见细胞悬液较为透明;1 000 r/min 5 min,弃上清,加入195 μL Annexin V-FITC结合液轻轻吹打细胞。室温下放置5 min;再加入5 μL Annexin V-FITC溶液,轻轻吹打混匀;室温避光孵育10 min;1 000 r/min 5 min,弃上清,加入190 μL Annexin V-FITC结合液轻轻重悬细胞;加入10 μL PI染色液,轻轻吹打混匀,避光;30 min内信号流式细胞仪检测为宜,Annexin V-FITC为绿色荧光,PI为红色荧光。
1.6 统计学分析
2 结果
2.1 低氧培养大鼠心肌细胞存活水平分析
低氧条件下培养心肌细胞转染DDAH2基因12、24和36 h后(同时维持低氧状态),检测其细胞存活水平。预实验结果显示,低氧培养36 h各个分组细胞存活水平差异较大,最终选择低氧培养心肌细胞为36 h。低氧作用36 h细胞存活率显著性低于对照组(P<0.05);而过表达DDAH2与低氧培养共同作用下心肌细胞存活率显著性高于低氧组与低氧+转染试剂组(P<0.05)(图1)。
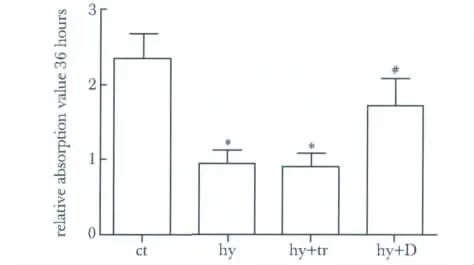
图1 WST-1法细胞毒性检测低氧培养心肌细胞相对存活水平Fig 1 Relative survival levels of cultured myocardial cells in hypoxia by WST-1 assay
2.2 低氧培养大鼠心肌细胞DDAH2基因过表达
低氧培养心肌细胞36 h显著性抑制DDAH2蛋白表达(P<0.05),转染DDAH2真核表达质粒能够显著性提高心肌细胞的DDAH2表达水平(P<0.05),而仅仅加入转染试剂并不能改变低氧下心肌细胞的DDAH2的低表达(图2)。
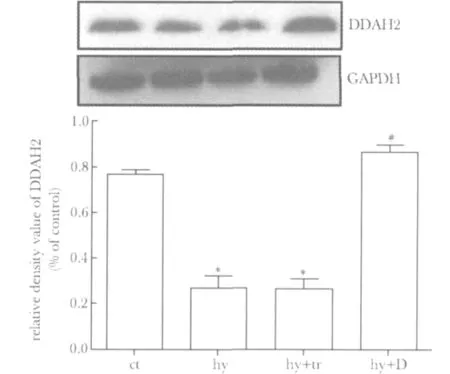
图2 低氧培养心肌细胞DDAH2基因过表达Fig 2 DDAH2 overexpression in hypoxia cultured cardiomyocytes
2.3 低氧培养大鼠心肌细胞eNOS磷酸化水平分析
低氧下心肌细胞eNOS磷酸化水平明显下调(P<0.05),过表达DDAH2可以显著性上调低氧下心肌细胞的eNOS磷酸化水平(P<0.05)(图3)。
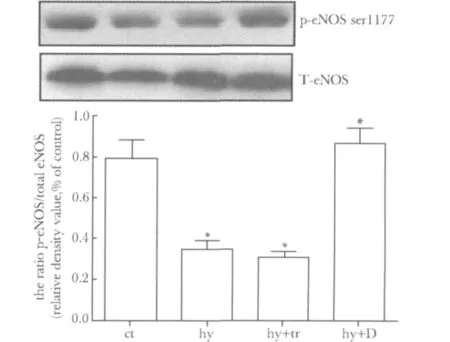
图3 过表达DDAH2上调低氧下心肌细胞eNOS磷酸化Fig 3 Up-regulation of phosphorylation of eNOS by overexpression-DDAH2 in hypoxia
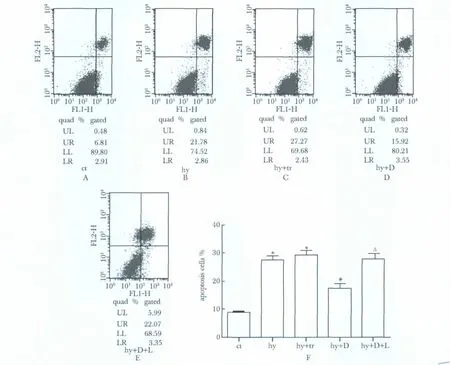
图4 L-NAME抑制DDAH2对低氧下心肌细胞的拮抗凋亡作用Fig 4 L-NAME inhibits anti-apoptotic effect of DDAH2 in hypoxia cultured H9c2(2-1)cells
2.4 过表达DDAH2对低氧诱导的大鼠心肌细胞凋亡的影响与eNOS的关系
低氧作用36 h心肌细胞凋亡率为27.34% ±1.33%,显著高于对照组(8.76% ±0.77%)(P<0.05);DDAH2过表达组心肌细胞凋亡率为17.38% ±1.52%,显著性低于低氧组(P<0.05),而L-NAME能够明显地阻断过表达DDAH2的保护作用(图4)。
3 讨论
现已明确机体NO水平和NOS活性的高低是由 DDAH-ADMA-NOS 通路来共同调节[8-9]。DDAH存在两个亚型:DDAH1和DDAH2。DDAH1主要分布于表达神经型 NOS的组织(大脑、肾脏),而DDAH2主要分布于表达内皮型NOS的组织(血管、心脏)[10]。
前面已经提到急性冠脉综合征、急性心肌梗死等转归都与缺血/再灌注所致损害紧密相关。研究显示NO是缺血/再灌注所导致微循环紊乱并改善的关键分子;通过上调DDAH1基因的表达能够显著改善缺血/再灌注对于肝脏带来的氧化应激损害[11]。ADMA作为内源性的一氧化氮合酶抑制性分子早已为人所知[12]。ADMA在人体内主要有蛋白质精氨酸甲基转移酶催化产生,但是却由DDAH1和DDAH2代谢排出体外[13],据此可以认为体内ADMA代谢水平高低和NO水平受到DDAH的调节。研究表明DDAH转基因小鼠表现为DDAH的组织活性和表达水平增加,血浆ADMA的水平下降,血浆和尿液中NO的水平上升[14]。以上研究均提示,NOS-NO通路的活化受到上游DDAH-ADMA通路来调节。一般情况下,健康的Wistar大鼠心脏,DDAH表达水平较低,DDAH2与内皮细胞和内膜eNOS的分布一致。主动脉结扎所致缺血/再灌注的Wistar大鼠(发生心肌梗死)左心室心肌组织DDAH活性明显升高;梗死周边心肌细胞可以被检测出DDAH1和DDAH2蛋白,此外,梗死区域浸润的炎症细胞和微血管周围DDAH2活性亦增加[15]。
本研究采用体外低氧条件培养诱导心肌细胞凋亡,观察转染DDAH2真核细胞表达质粒的心肌细胞凋亡水平的变化以及eNOS蛋白磷酸化,结果是转染DDAH2基因后低氧所诱导的心肌细胞凋亡明显降低;eNOS蛋白磷酸化水平上调,而抑制eNOS显著性降低DDAH2的保护作用,提示可能抑制DDAH2可能是在低氧下通过诱导eNOS活化来保护心肌细胞。但是DDAH2基因过表达保护心肌细胞的深入的分子信号机制并不明确,在下一步将进行更具体的研究和探索。
[1]Chiong M,Wang Z V,Pedrozo Z,et al.Cardiomyocyte death:mechanisms and translational implications[J].Cell Death Dis,2011,2:e244.doi:10.1038/cddis.2011.130
[2]Tucka J,Bennett M,Littlewood T.Cell death and survival signalling in the cardiovascular system[J].Front Biosci,2012,17:248-261.
[3]Whelan RS,Kaplinskiy V,Kitsis RN.Cell death in the pathogenesis of heart disease:mechanisms and significance[J].Annu Rev Physiol,2010,72:19 -44.
[4]Davidson SM,Duchen MR.Effects of NO on mitochondrial function in cardiomyocytes:Pathophysiological relevance[J].Cardiovasc Res,2006,71:10 -21.
[5]Boger RH.Association of asymmetric dimethylarginine and endothelial dysfunction[J].Clin Chem Lab Med,2003,41:1467-1472.
[6]Leiper JM,Santa MJ,Chubb A,et al.Identification of two human dimethylarginine dimethylaminohydrolases with distinct tissue distributions and homology with microbial arginine deiminases[J].Biochem J,1999,343:209 -214.
[7]Ding H,Wu B,Wang H,et al.A novel loss-of-function DDAH1 promoter polymorphism is associated with increased susceptibility to thrombosis stroke and coronary heart disease[J].Circ Res,2010,106:1145 -1152.
[8] Leiper JM.The DDAH-ADMA-NOS pathway[J].Ther Drug Monit,2005,27:744 -746.
[9]Tran CT,Leiper JM,Vallance P.The DDAH/ADMA/NOS pathway[J].Atheroscler Suppl,2003,4:33 -40.
[10]Tran CT,Fox MF,Vallance P,et al.Chromosomal localization,gene structure,and expression pattern of DDAH1:comparison with DDAH2 and implications for evolutionary origins[J].Genomics,2000,68:101 -105.
[11]Lanteri R,Acquaviva R,Di Giacomo C,et al.Rutin in rat liver ischemia/reperfusion injury:effect on DDAH/NOS pathway[J].Microsurgery,2007,27:245 -251.
[12]Teerlink T,Luo Z,Palm F,et al.Cellular ADMA:regulation and action[J].Pharmacol Res,2009,60:448 -460.
[13]Teerlink T.ADMA metabolism and clearance[J].Vasc Med,2005,10 Suppl 1:S73-S81.
[14]Leiper J,Nandi M,Torondel B,et al.Disruption of methylarginine metabolism impairs vascular homeostasis[J].Nat Med,2007,13:198-203.
[15]Gray GA,Patrizio M,Sherry L,et al.Immunolocalisation and activity of DDAH I andⅡin the heart and modification post-myocardial infarction[J].Acta Histochem,2010,112:413-423.
