骨性关节炎患者血清和关节滑液中BMP-7的检测及临床意义
2013-08-27廖伟雄李众利王鸿丽傅仰木白晓伟
廖伟雄,李众利,王 杰,王鸿丽,傅仰木,白晓伟
1解放军总医院 骨科,北京 100853;2国家生物医学分析中心,北京 100850
骨性关节炎(osteoarthritis,OA)是成年人中最常见的关节疾病。其主要特征为慢性持续性和进行性的关节软骨损坏,常导致关节疼痛、僵硬、肿胀、活动受限和功能障碍[1]。在老年肥胖人群中,OA是引起膝关节进行性疼痛的最主要原因。目前OA的诊断主要依靠临床症状结合影像学资料,但病程早期患者通常无明确症状及异常影像学表现,使得OA的早期诊断受到限制。监测体内的生物标志物能够定量和动态地反映关节内的变化,有助于OA的早期亚临床诊断、疾病分期、疗效检测及预后评估[2-3]。
骨形态发生蛋白(bone morphogenetic proteins,BMPs)是唯一能够单独诱导骨组织形成的局部生长因子。BMP-7是BMPs家族中一员,它不仅具有强烈的诱骨活性[4],还可促进软骨细胞蛋白多糖表达并抑制软骨基质降解,修复关节软骨损伤,维持软骨的完整性[5-6]。本研究拟采用酶联免疫吸附试验(ELISA)测定OA及非OA患者血清和关节滑液中的BMP-7水平,以此研究血清和滑液中BMP-7与OA影像学严重程度分级的相关性。
资料和方法
1 研究对象 收集2012年1-6月在解放军总医院行关节镜诊治或关节置换的膝关节疾病患者90例。其中OA组67例,男21例,女46例;年龄43~81岁,平均62.7岁。所有OA患者均符合1995年美国风湿病学会关于OA的诊断标准。OA严重程度分级采用Kellgren-Lawrence放射学分级标准(图1)。1级:可疑关节内骨赘及关节间隙狭窄16例;2级:肯定关节内骨赘,可疑关节间隙狭窄19例;3级:少量关节内骨赘、硬化,肯定关节间隙狭窄,可疑骨关节畸形20例;4级:大量关节内骨赘,严重骨质硬化,关节间隙明显狭窄,肯定骨关节畸形12例。非OA组23例,男16例,女7例;年龄13~40岁,平均25.1岁。均为非OA的其他膝关节疾病患者,其中半月板损伤11例,前交叉韧带损伤9例,盘状半月板2例,髌骨半脱位1例,且均无明显关节软骨损伤。
2 标本收集和BMP-7检测 两组均在行关节镜诊治或关节置换时抽取膝关节滑液原液2~3 ml,同时取静脉全血2 ml。离心后取上清液保存在-80 ℃冰箱内待测。采用酶联免疫吸附试验(ELISA)检测血清和关节滑液中BMP-7的水平。操作按试剂盒(美国R&D公司提供)说明进行。在450 nm波长下测量各孔的吸光度值(OD值)。
3 统计学分析 采用SPSS13.0统计学分析软件,计量资料结果以-x±s表示,OA组与非OA组间数据比较应用Student's t检验,多组数据间比较应用one-way ANOVA检验,BMP-7浓度与OA严重程度(Kellgren-Lawrence放射学分级标准)之间的相关性采用Pearson相关性分析,P<0.05为差异有统计学意义。
结 果
1 两组BMP-7水平比较 OA组血清BMP-7水平高于非OA组[(11.44±8.38) pg/ml vs (3.81±2.24) pg/ml,P<0.001],OA组关节滑液BMP-7水平亦高于非OA组[(9.04±7.32) pg/ml vs (2.97±1.83) pg/ml,P=0.001]。两组血清BMP-7水平均高于滑液[(9.49±8.03) pg/ml vs (7.49±6.90) pg/ml,P< 0.001]。见图 2。
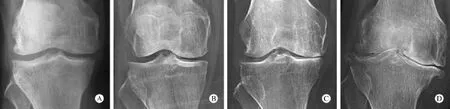
图1 Kellgren-Lawrence放射学分级 A:1级; B:2级; C:3级; D:4级Fig.1 Kellgren-Lawrence radiographic grading criteria A: Grade 1; B: Grade 2; C: Grade 3; D: Grade 4
2 非OA组与不同严重程度OA亚组BMP-7水平比较 4级OA组血清BMP-7明显高于其他各组(P<0.001);3级OA组血清BMP-7明显高于2级、1级和非OA组(P<0.001);2级OA组血清BMP-7高于1级(P=0.049)和非OA组(P=0.002);1级OA组血清BMP-7虽然高于非OA组,但差异无统计学意义(P=0.355)。4级OA组滑液BMP-7明显高于其他各组(P<0.001);3级OA组滑液BMP-7明显高于2级、1级和非OA组(P<0.001);2级OA组滑液BMP-7高于非OA组(P=0.018),2级OA组滑液BMP-7虽然高于1级OA组,但差异无统计学意义(P=0.058);1级OA组与非OA组之间滑液BMP-7水平差异亦无统计学意义(P=0.772)。见表1、图3。
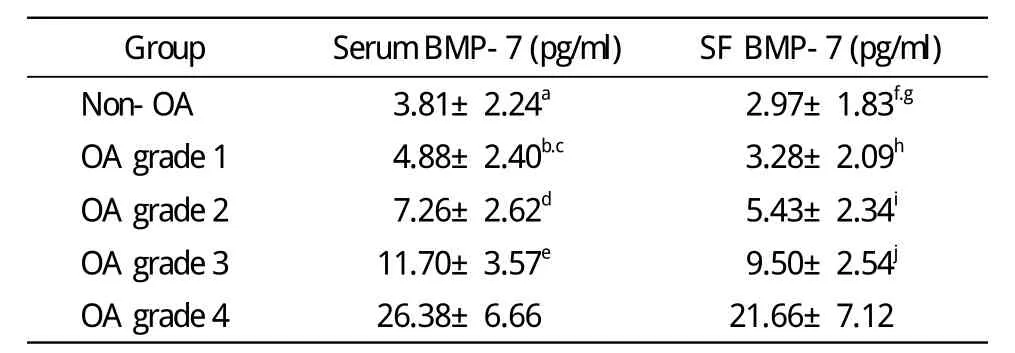
表1 非OA组与不同严重程度OA亚组之间血清和滑液BMP-7水平的比较Tab.1 BMP-7 levels in serum and SF from non-OA group and OA subgroup with different severity of OA
3 血清和滑液中BMP-7水平与OA严重程度相关性分析 血清中BMP-7水平与OA严重程度相关(r=0.788,P<0.001),滑液中BMP-7水平亦与OA严重程度相关(r=0.766,P<0.001)(图4)。此外,血清中BMP-7与滑液中BMP-7水平呈正相关(r=0.817,P< 0.001)(图 5)。
讨 论
本研究表明,OA组血清及滑液BMP-7水平均明显高于非OA组,提示OA患者系统及关节局部BMP-7合成量增加,这可能与下列因素有关:1)软骨基质中残留BMP-7及凋亡软骨细胞内源性BMP-7的释放,导致滑液中BMP-7升高;2)滑膜细胞及软骨细胞产生的BMP-7通过自分泌或旁分泌的方式促进内源性BMP-7的合成与分泌;3)关节内的其他结缔组织如半月板、韧带和肌腱亦能生成一部分BMP-7。虽然骨与软骨是产生BMP-7的主要来源,但OA组血清中BMP-7升高的程度较滑液更为显著,提示其他非骨骼组织亦能产生BMP-7[7]。有研究表明,成人肾脏可能是BMP-7合成的重要场所,可以持续分泌BMP-7并释放入血,但OA患者血循环中BMP-7的升高机制仍有待研究。
与正常软骨相比,OA患者关节软骨BMP-7mRNA的表达量上调2倍[8]。大量有活性的BMP-7参与OA早期软骨损伤的修复反应[9]。因此可推断本研究中BMP-7的升高可能与OA关节软骨的保护和修复过程有关,是OA软骨损伤后出现的代偿性反应。血清和滑液中BMP-7水平与OA严重程度相关,检测血清或滑液中BMP-7水平能一定程度上反映OA病情的严重程度,可作为OA早期诊断与预后评估的候选生物学标志。
需要指出的是,本研究由于伦理学限制,只能选择非OA的其他膝关节疾病患者作为对照,因此无法获取正常人血清及滑液BMP-7的数据资料。另外,由于OA发病机制的多样性,在研究对象的选取方面并不能完全排除年龄、性别、并发症等混杂因素的干扰。此外,本实验局限于BMP-7的定量分析和比较蛋白质组学研究,未能反映BMP-7在其信号转导通路中的功能和作用,因此需进一步研究以阐述BMP-7表达变化在OA病程中的作用机制及临床意义。

图2 两组血清和滑液BMP-7水平比较(左)Fig.2 Comparison of BMP-7 levels in serum and SF between two groups(left)

图3 非OA组与不同严重程度OA亚组之间血清和滑液BMP-7水平的比较(右)Fig.3 Comparison of BMP-7 levels in serum and SF between non-OA group and OA subgroup of different disease severity(right)
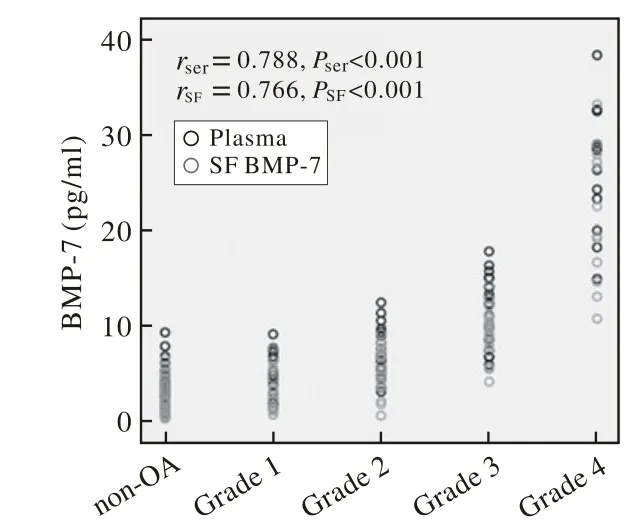
图4 血清和滑液中BMP-7水平与OA严重程度相关(左)Fig.4 Levels of BMP-7 in plasma and SF are significantly correlated with OA severity(left)

图5 血清中BMP-7与滑液中BMP-7水平呈正相关(右)Fig.5 Levels of BMP-7 in plasma and SF are positively correlated(right)
1 Michael JW, Schlüter-Brust KU, Eysel P. The epidemiology, etiology, diagnosis, and treatment of osteoarthritis of the knee[J]. Dtsch Arztebl Int, 2010,107(9):152-162.
2 Maiotti M, Monteleone G, Tarantino U, et al. Correlation between osteoarthritic cartilage damage and levels of proteinases and proteinase inhibitors in synovial fluid from the knee joint[J]. Arthroscopy, 2000, 16(5):522-526.
3 Yamagiwa H, Sarkar G, Charlesworth MC, et al. Two-dimensional gel electrophoresis of synovial fluid: method for detecting candidate protein markers for osteoarthritis[J]. J Orthop Sci, 2003,8(4):482-490.
4 Urist MR. Bone: formation by autoinduction. 1965[J]. Clin Orthop Relat Res, 2002, (395):4-10.
5 Söder S, Hakimiyan A, Rueger DC, et al. Antisense inhibition of osteogenic protein 1 disturbs human articular cartilage integrity[J].Arthritis Rheum, 2005, 52(2): 468-478.
6 Chubinskaya S, Hurtig M, Rueger DC. OP-1/BMP-7 in cartilage repair[J]. Int Orthop, 2007, 31(6): 773-781.
7 Honsawek S, Chayanupatkul M, Tanavalee A, et al. Relationship of plasma and synovial fluid BMP-7 with disease severity in knee osteoarthritis patients: a pilot study[J]. International orthopaedics, 2009,33(4):1171-1175.
8 Chubinskaya S, Merrihew C, Cs-Szabo G, et al. Human articular chondrocytes Express osteogenic protein-1[J]. J Histochem Cytochem, 2000, 48(2): 239-250.
9 Chubinskaya S, Kuettner KE. Regulation of osteogenic proteins by chondrocytes[J]. Int J Biochem Cell Biol, 2003, 35(9):1323-1340.
