中国南海多棘海星水提物抗皮肤真菌的活性分析
2013-08-27唐晓磊陈章权于静蕊
华 影,唐晓磊,陈章权,于静蕊
1辽宁医学院,辽宁锦州 121001;2武汉大学基础医学院,湖北武汉 430071;3广东医学院广东省医学分子诊断重点实验室,广东东莞 523808;4辽宁锦州市中心医院,辽宁锦州 121001;5阜阳职业技术学院,安徽阜阳 236031
海星(sea star)是常见的海洋生物之一。近年来已发现多种海星活性物质,如皂苷、甾醇、蒽醌、多糖、多肽、糖脂等,具有抗肿瘤、抗感染、抗心管病等作用[1-5]。课题组此前曾报道过南海多棘海星的提取物在NKT细胞激活以及抗肿瘤方面的研究工作[6-7]。国内对海星抗真菌的研究仅见胶州湾罗氏海星皂苷类物质抗酵母真菌的报道[8],而海星抗皮肤真菌却鲜有报道。因此本实验做了对我国南海多棘海星提取物抗皮肤真菌的研究,报告如下。
材料和方法
1 材料 多棘海星(asteruzs rollestoni)采自中国湛江海域,由海南大学海洋学院方再光博士鉴定。红色毛癣菌(tricophyton rubrum)5株,断发毛癣菌(trichophyton tonsurans)和石膏样小孢子菌(microsprum gypseum)各3株,由辽宁锦州市中心医院皮肤科实验室惠赠;马铃薯葡萄糖培养基(potato dextrose agar,PDA)购于青岛海博生物技术有限公司;冷冻干燥机77520-01 Freezone b购自美国(Labconco公司);Milli-Q超纯水机;贝克曼-库尔特波长扫描仪;96孔细胞培养板(Costar);Bio-Rad TC-10细胞计数仪;Eppendorf培养箱;Agilent 1260型高效液相柱层析(HPLC)仪,Agilent ZORBAX GF-250型葡聚糖凝胶色谱柱(9.4 mm×250 mm,4 μm)和ZORBAX 300 Extend C18硅胶色谱柱(4.6 mm×250 mm,5 μm)均为美国Agilent公司产品,HPLC层析柱洗脱流动相所用甲醇、乙腈为色谱纯,氟康唑(fluconazole)常州市第二制药厂,批号930805。其余试剂均为国药集团分析纯。
2 海星水溶性成分的制备 取新鲜南海多棘海星,经粉碎、冷冻干燥、除脂等处理[6-7],加入2倍体积的去离子水,于4 ℃环境中连续搅拌24 h,400目纱布过滤后收集海星水提液,10 000 g离心10 min,将水相提取液pH调整为7.4,并于-80 ℃储存备用。
3 海星水提物特征吸收波长的确定 将提取的储存液配制成3个浓度梯度,并以贝克曼波长扫描仪从190~900 nm进行连续扫描,对海星水提物中在某特定波长处有吸收峰的波长作为后续分离的检测波长。
4 高效液相色谱法(HPLC)对水提物的分离 将水提物经过高效液相色谱仪(HPLC)连以葡聚糖凝胶柱ZORBAX GF-250分离手段进行初步分离,以pH 7.4的磷酸盐缓冲液为流动相,调节柱温箱为23 ℃,流速为1 ml/min,在213 nm波长处检测。随后利用高效液相色谱仪(HPLC)连以C18硅胶柱对首次分离的有效组分进一步分离。在ZORBAX 300 Extend C18硅胶色谱柱中以V水∶V乙腈∶V甲醇=60∶20∶20为流动相,调节柱温箱为23 ℃,流速为1 ml/min,在213 nm处进行检测。
5 抗真菌的活性检测 配制新鲜产孢子液体培养基:含L-谷酰胺而不含重碳酸盐的RPMI1640培养基,使用0.165 mol/L 3-(N-吗啡啉)丙磺酸调至pH 7.0,0.22 μm微孔滤膜过滤除菌备用。初次分离的冷冻干燥后,称取并用新鲜的液体培养基调至0.1 mg/ml备用。将26 ℃培养10 d后的PDA培养基中注入含0.05%吐温-80 ℃的0.9%氯化钠无菌溶液,适度震荡并用无菌玻棒摩擦菌落表面,用200目滤网除去菌丝,用Bio-Rad细胞计数器计数,最终以配制的含有不同分离组分的液体培养基调孢子浓度至105/ml备用。设置空白对照(仅含有培养基)、氟康唑阳性对照组(氟康唑用少许二甲基亚砜助溶终浓度为10 μg/ml)、阴性对照和各提取组分实验组,每组同时设置3个复孔。将培养板置于30 ℃,湿度80%~90% RH的培养箱中静置培养96 h后,重新计数各培养孔中的孢子浓度。并计算孢子生长率:(提取物实验组待测孔读数-空白孔孢子读数/阴性孔读数-空白孔读数)×100%。在随后对初次分离第3组分(FSF-3)抑制红色毛癣菌的检测中,用新鲜液体培养基将初次分离第3组分配制成终浓度分别为100 μg/ml、50 μg/ml、25 μg/ml、12.5 μg/ml、6.25 μg/ml、3.12 μg/ml、1.56 μg/ml、0.78 μg/ml、0.39 μg/ml, 其 余 组 别设置及操作同上。FSF-3经高效液相色谱连以C18硅胶柱分离各组分冷冻干燥后,称量各组分并以新鲜液体培养基(上述)调至10 μg/ml、5 μg/ml、1 μg/ml进行抗菌检测。其余组别设置及操作同上。
结 果
1 海星水提取物的波长扫描图谱 将水提物配制成1 mg/ml、0.5 mg/ml、0.1 mg/ml 3个浓度,在190~900 nm每间隔1nm进行连续扫描,测得各波长的吸光度值,发现在213 nm处有峰值,见图1。
2 海星水提取物经葡聚糖凝胶柱分离图谱 在葡聚糖凝胶柱中以pH 7.4的磷酸盐为流动相,调节柱温箱为23 ℃,调节流速至1 ml/min,在213 nm处检测,对海星水提取物各分离组分的响应度所绘制的峰图,根据分离程度结合实验需要分为5组主要成分,分别标记为FSF-1、FSF-2、FSF-3、FSF-4、FSF-5,见图 2。
3 葡聚糖凝胶柱分离所得各组分抗真菌活性鉴定使用微孔稀释法通过对96 h培养后各孔孢子浓度的测定,在同一菌种的药物敏感性检测中以(待测孔读数-空白孔孢子读数/阴性孔读数-空白孔读数)×100%表示其孢子生长率(表1),以及FSF-3组分抑制红色毛癣菌的剂量依赖性的检测,结果显示随着FSF-3浓度的降低抑菌效果逐渐减弱,当浓度低于0.78 μg/ml则无明显抑菌效果,见图3。
4 FSF-3组分分离图谱 以V水∶V乙腈∶V甲醇=60∶20∶20为流动相,并以流动相溶解FSF-3至浓度为1 mg/ml,调节柱温箱为23℃,调节流速至1 ml/min,通过C18硅胶柱按照极性差异,在213 nm处进行分离。根据分离情况分为3个主要组分,分别标记为SSF-1、SSF-2、SSF-3,见图4。
5 FSF-3再次分离所得各组分抗真菌活性鉴定微量稀释法检测不同浓度SSF-1、SSF-2、SSF-3组分对红色毛癣菌的抑制作用,见表2。
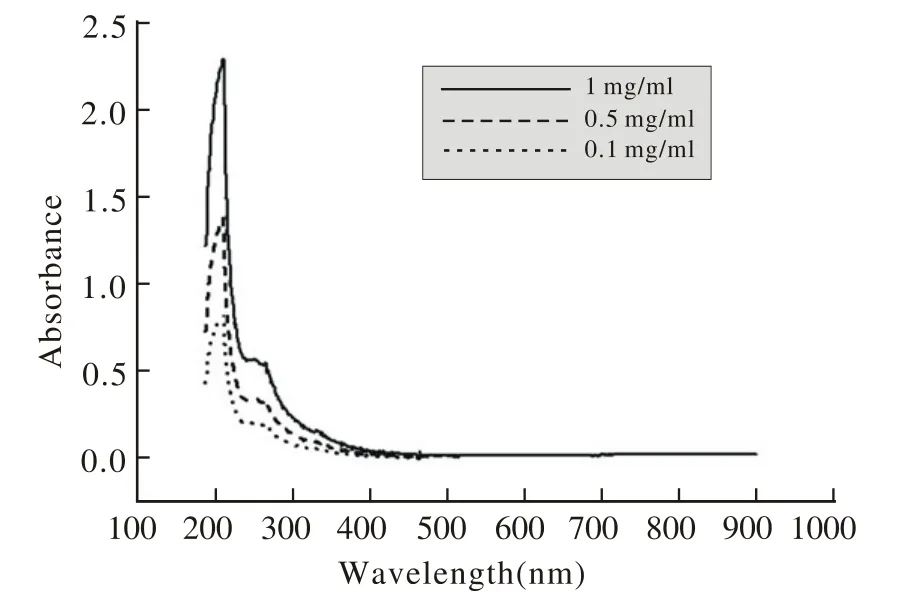
图1 三种浓度海星水提取物的波长扫描Fig.1 Wavelength scan of water-soluble extracts from Asteruzs rollestoni at 3 different concentrations
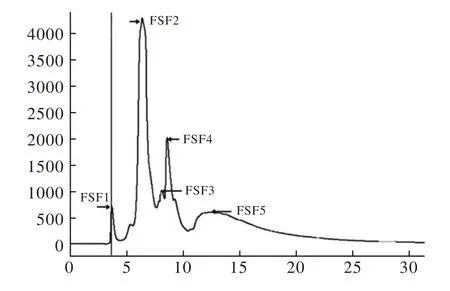
图2 海星水提取物在葡聚糖凝胶分离柱中的色谱图FSF1-FSF5: 第一分离组分至第五分离组分Fig.2 Chromatogram of water-soluble extract from Asteruzs rollestoni by sephadex column FSF1-FSF5: The first separated fractions 1-5
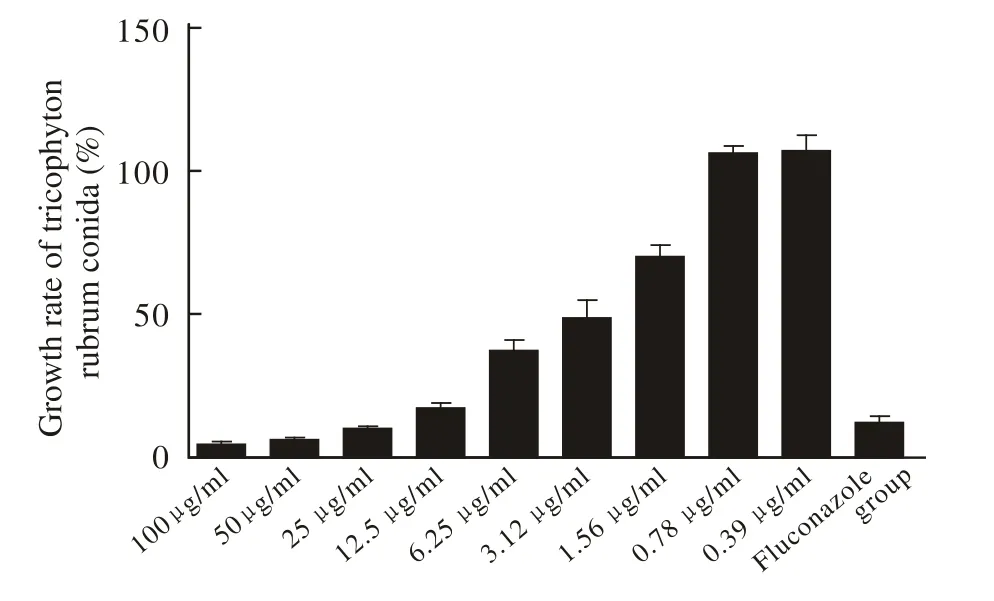
图3 不同浓度海星水提物组分FSF-3对红色毛癣菌孢子生长率的影响Fig.3 Effect of FSF-3 at different concentrations separated from Asteruzs rollestoni on growth rate of Tricophyton rubrum spore
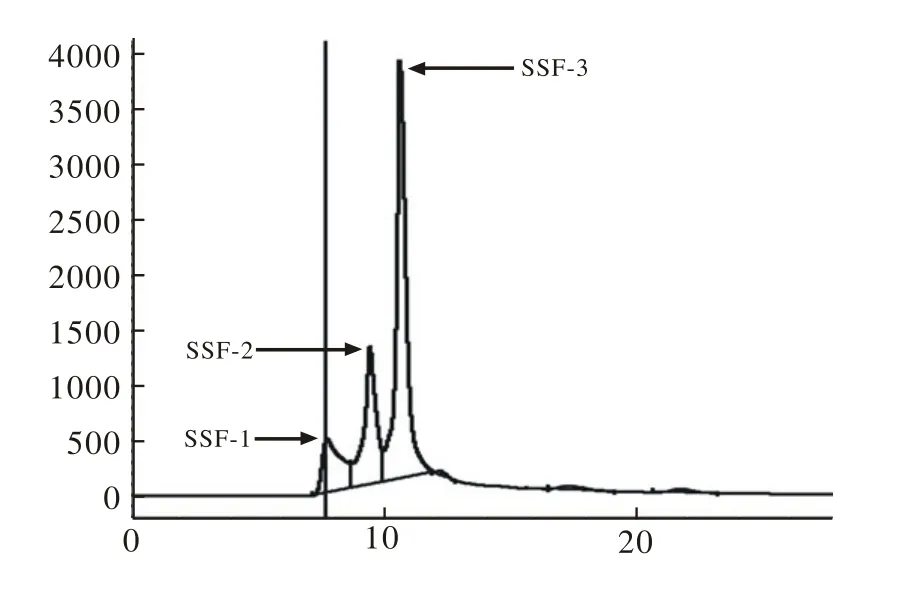
图4 海星水提物FSF-3组分经C18硅胶分离柱分离组分的色谱图Fig.4 Chromatogram of FSF-3 separated by combined HPLC and C18 silicagel column SSF-1-3: secondary separated fractions 1-3
表1 葡聚糖凝胶柱分离各组分对三种真菌孢子生长率的影响Tab.1 Effect of every components from the separation of sephadex column on the growth rate of three kinds of fungal spore (n=3,%)
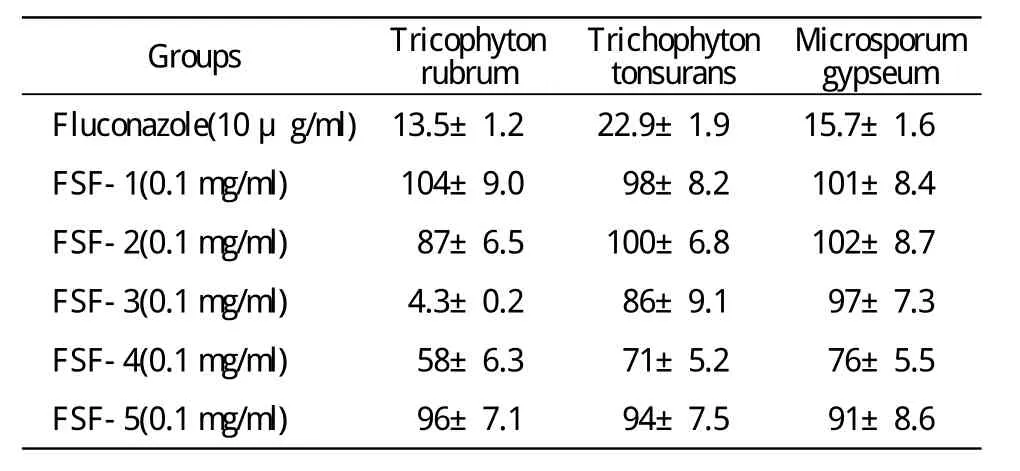
表1 葡聚糖凝胶柱分离各组分对三种真菌孢子生长率的影响Tab.1 Effect of every components from the separation of sephadex column on the growth rate of three kinds of fungal spore (n=3,%)
?
表2 FSF-3经C18硅胶分离柱分离所得三个组分对红色毛癣菌孢子生长率的影响Tab.2 Effect of 3 components separaed by C18 silicagel column on growth rate of Tricophyton rubrum spore (n=3, %)
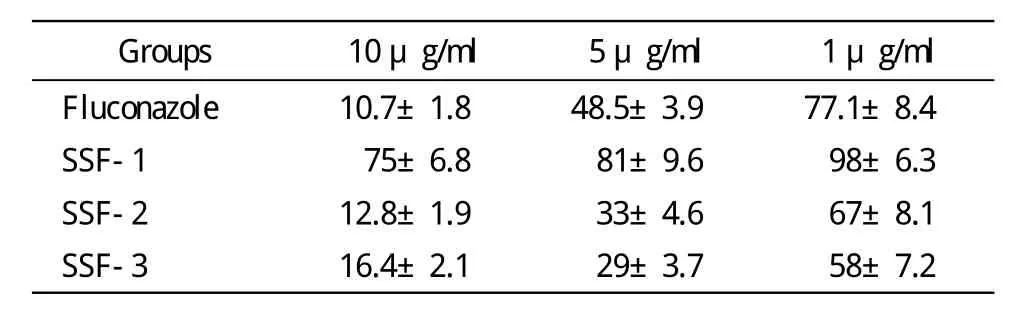
表2 FSF-3经C18硅胶分离柱分离所得三个组分对红色毛癣菌孢子生长率的影响Tab.2 Effect of 3 components separaed by C18 silicagel column on growth rate of Tricophyton rubrum spore (n=3, %)
?
讨 论
皮肤癣菌引起的浅部真菌感染一直是皮肤科临床最常见的皮肤病[9]。目前临床上使用的各种合成抗真菌药物在一定程度上可以控制真菌的感染,然而其对人体均有一定的不良反应。本实验首次对中国南海海域的多棘海星其体内水溶性物质的抗真菌活性展开研究,对海星水溶性物质进行分离并与常见的3种皮肤癣菌共培养进行抑菌活性检测,旨在从中筛选出具有抗菌活性的成分。
本研究在对提取物各组分的抑菌活性检测中使用了微量稀释法,该方法优点是用药量少,操作易标准化及可借助仪器判读结果等。该技术已被推荐用于酵母菌的MIC测定,室间质控结果证明效果满意[10]。中国医科院皮肤病研究所于1997年首次报道了微量稀释法在测定皮肤癣菌最低抑菌浓度的实验研究[11]。实验中发现,此液体培养基的应用可有效的产生丰富的真菌孢子而只有极少量的菌丝以满足后续实验要求。
本文先将海星水溶性成分通过葡聚糖凝胶柱,根据分子量大小进行初次分离。将初次分离的组分与3种真菌共培养的结果显示,在初次分离的FSF-3组分中含有对红色毛癣菌有较强抑菌作用的物质。红色毛癣菌是临床常见的皮肤癣菌,皮肤浅部真菌病60%以上是由红色毛癣菌感染所致[9,12]。遂将FSF-3组分作为重点研究对象,追踪具有抑菌活性的成分。对FSF-3的分离中使用了HPLC连接C18硅胶柱根据极性差异进行再次分离,经过物质分子量和极性的两次分离,这样保证了物质成分较为单纯。对各分离组分的抑菌活性检测中发现,FSF-3组分的MIC(middle inhibitor concentration)可达3.15 μg/ml,与同类提取物对红色毛癣菌的抑菌浓度报道相比,其浓度显著低于报道值[13-14]。而对FSF-3的进一步分离检测发现,SSF-1组分对红色毛癣菌的抑菌活性不明显,而SSF-2及SSF-3对红色毛癣菌均有一定的抑菌效果。推测SSF-2和SSF-3中可能存在着分子量大小接近而极性却差异较为明显的物质。然而对该活性组分的物质结构、性质等信息仍需进一步的鉴定,并拟在动物水平上验证其抗菌活性。上述研究为研制新型的海洋抗真菌药物提供了方向和切入点。
1 李婷菲,叶斌.药用海洋活性物质的研究进展[J].海峡药学,2009,21(11):12-14.
2 卞俊.国内外海洋药物研究进展和展望[J].海军医学杂志,2007,28(1):84-87.
3 汤海峰, 易杨华, 张淑瑜, 等. 海星皂苷的研究进展[J].中国海洋药物,2004,23(6):48-57.
4 刘铁铮,郭爱洁,王桂春,等.海星化学成分的生物活性及应用研究进展[J].广东农业科学,2011,38(13):122-125.
5 Peng Y, Zheng J, Huang R, et al. Polyhydroxy steroids and saponins from China Sea starfish Asterina pectinifera and their biological activities[J]. Chem Pharm Bull (Tokyo), 2010, 58(6):856-858.
6 何素辉, 唐晓磊, 邓亦峰,等.多棘海星乙醇提取物对小鼠血清IL-4和IFN-γ水平的影响[J].细胞与分子免疫学杂志,2011,27(11):1198-1200.
7 何素辉,唐晓磊,侯玉涛,等.南中国多棘海星乙醇提取物体外抗肿瘤活性作用的初步研究[J].分子诊断与治疗杂志,2011,3(6):402-405.
8 樊廷俊,张铮,袁文鹏,等.水溶性海星皂苷的分离纯化及其抗真菌活性研究[J].山东大学学报:理学版,2008,43(9):1-5.
9 张道军,黄云丽,张卫卫,等.浅部真菌病2600例病原菌分析[J].中国皮肤性病学杂志,2012,26(6):501-503.
10 Shawar R, Paetznick V, Witte Z, et al. Collaborative investigation of broth microdilution and semisolid agar dilution for in vitro susceptibility testing of Candida albicans[J]. J Clin Microbiol,1992, 30(8):1976-1981.
11 刘维达,王金燕,吴建明.微量稀释法测定皮肤癣菌最低抑菌浓度(MIC)的实验研究[J].临床皮肤科杂志,1997(4):17-19.
12 Mukherjee PK, Leidich SD, Isham N, et al. Clinical Trichophyton rubrum strain exhibiting primary resistance to terbinafine[J].Antimicrob Agents Chemother, 2003, 47(1):82-86.
13 安惠霞,李治建,古力娜·达吾提,等.地锦草提取物对红色毛癣菌酶活性的影响[J].时珍国医国药,2010,21(4):787-788.
14 李永军,张瑞,王鑫,等.白藜芦醇对皮肤癣菌抗菌活性的实验研究[J].中国全科医学,2011,14(8):892-893.
