四氢生物蝶呤代谢紊乱导致血管内皮功能障碍分子机制的研究进展
2013-08-25李晓强曹凤宏李治国
吴 磊 李晓强 曹凤宏 李治国
(河北联合大学附属医院泌尿外科,①医学实验研究中心 河北唐山 063000)
研究发现,许多疾病(高血压、糖尿病、肾脏疾病等)中均存在血管内皮功能障碍,而血管内皮功能的异常在这些疾病的发生发展中起到重要作用[1]。四氢生物蝶呤(tetrahydrobiopterin,BH4)是内皮细胞一氧化氮合酶(endothelial nitric oxide synthase,eNOS)的必需辅因子。内皮细胞中BH4含量与一氧化氮(nitric oxide,NO)含量不匹配时,会导致eNOS解偶联造成NO的合成障碍[2],而产生大量活性氧,成为血管内皮功能障碍的发病机制。另外,BH4也是苯丙氨酸等芳香族氨基酸羟化酶的辅酶,而芳香族氨基酸羟化酶是几种神经递质(5-羟色胺、多巴胺)合成的关键酶,这些神经递质均能影响血管内皮功能。值得注意的是BH4自身也有较强的还原性,使得其可以减弱内皮细胞中的氧化应激,缓解内皮功能障碍。通过补充外源性BH4或扭转内生性BH4含量的治疗方法可减少或者扭转血管内皮功能障碍[3]。
1 BH4的合成与代谢
四氢生物蝶呤在体内的水平由合成代谢、氧化代谢及循环再生的速度共同决定。在体内合成途径分为从头合成和补救合成两种,前者是人体在正常生理状态下以三磷酸鸟苷(guanosine triphosphate,GTP)为原料经过四步酶促反应而完成,在这个途径中鸟苷三磷酸环化水解酶I(GTP cyclohydrolase I,GTPCH I)是BH4生物合成的限速酶。补救合成途径是人体在病理情况下以墨蝶呤为底物,由墨蝶呤还原酶(sepiapterin reductase,SR)催化合成[4]。合成的BH4可以作为芳香族氨基酸羟化酶的辅酶,被氧化成BH4-4α-甲醇胺。BH4-4α-甲醇胺能够被蝶呤4а-甲醇胺甲醇脱氢酶(pterin-4a-carbinolamine dehydratase,PCD)还原成醌式二氢蝶呤(quinonoid dihydrobiopterin,qBH2)。另外,BH4是潜在还原剂,能被活性氧、亚硝酸盐直接氧化成qBH2。qBH2在体内可以被醌式二氢蝶呤还原酶还原成为BH4,完成再生供循环使用。qBH2不稳定,如果不能被及时地还原,分子将发生重排形成二氢蝶呤(7,8 - dihydrobiopterin,BH2)[5],BH2不能被DHPR所还原,能被二氢叶酸还原酶(dihydrofolate reductase,DHFR)还原成BH4。但DHFR的活性较弱,在生理状况下只有大约1/3的BH2能够被还原[6]。BH4的代谢过程可见图1。
2 BH4代谢紊乱导致血管内皮功能障碍分子机制
2.1 通过NO及活性氧的生成影响血管内皮功能 血管内皮功能异常主要与NO减少以及氧自由基增加相关[7],而BH4在调节NO生成和氧自由基产生两方面均起着重要作用。一氧化氮合酶(nitric oxide synthase,NOS)有三种同功酶,分为内皮型一氧化氮合酶(eNOS)、神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS),它们在血管内皮细胞中均有表达。BH4是所有NOS同功酶的辅因子,具有稳定NOS结构、稳定NOS活性二聚体、增加L-精氨酸和NOS结合力等作用,BH4还可直接影响NO和超氧阴离子的产生。当BH4含量充足时,NOS接受并储存来自NADPH的电子,在底物L-精氨酸和O2存在时,NOS将电子转运给L-精氨酸而使后者被氧化成L-胍氨酸,同时伴随NO产生;当BH4水平不足时,激活的NOS不能催化L-精氨酸氧化生成L-胍氨酸和NO,但是NOS仍然能够接受来自蛋白二硫化物还原酶(Protein-disulfide reductase,NADPH)的电子并将电子储存在与其相结合的四羟酮醇中,然后再将电子传递给另一底物氧气,导致主要的终产物是超氧阴离子,而不是NO,此过程称作NOS脱偶联。NOS脱偶联所产生的超氧阴离子能迅速与NO结合,消耗NO并生成毒性更强的过氧化亚硝基,后者又能迅速将BH4氧化,导致BH4进一步减少,从而形成恶性循环。总之,BH4缺乏时,NOS脱偶联,NO产生减少,而主要产生超氧阴离子,从而导致血管内皮功能障碍。
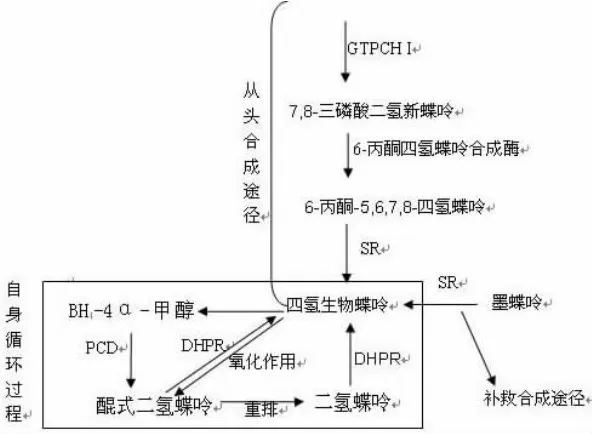
图1 BH4的代谢过程
2.2 依靠自身还原性对抗氧化应激影响血管内皮功能 BH4本身具有很强的还原性,有清除氧化性物质,减少组织、细胞的氧化损伤作用,保护血管内皮功能。国内有学者在进行BH4抗心肌缺血再灌注损伤的研究时,发现内皮细胞内BH4的抗氧自由基作用值得肯定[8]。因此,BH4缺乏很可能直接影响氧自由基的清除,不利于保护内皮细胞。
2.3 其他途径对血管内皮功能的影响 BH4是苯丙氨酸、酪氨酸和色氨酸等芳香氨基酸在羟化过程中所必需的共同辅酶,正常生理状态下,苯丙氨酸可通过一系列反应转化为酪氨酸,酪氨酸转化为多巴胺(Dopamine,DA),色氨酸可转化为5-羟色胺(5-hydroxytryptamine,5-HTA),BH4的缺乏使上述过程发生障碍,造成DA与5-HTA合成减少及苯丙氨酸的蓄积。
2.3.1 5-HTA。5-HTA是人体重要的神经体液激素,分布于全身。在中枢神经系统和周围组织中起着多种生理作用,如对心血管、呼吸、体温、睡眠、摄食行为、情绪反应、下丘脑神经激素分泌和平滑肌张力的调节[9]。5-HTA可以通过对神经节前5-HTA能受体的激活、刺激β-肾上腺素能受体合成前列环素等途径扩张血管。同时,5-HTA也可通过激活血管壁上α-肾上腺能受体、释放去甲肾上腺素和激活肾素-血管紧张素-醛固酮系统,促进血管紧张素Ⅱ释放等作用机制收缩血管。不难看出5-HTA可在血管中同时起到内皮依赖性血管扩张作用和对血管平滑肌直接收缩的作用,其平衡决定了血管内皮的病理生理反应状态[10]。作为5-HTA合成过程中的必需物质,BH4生理量的降低直接导致体内5-HTA含量的减少,打破血管收缩与扩张的平衡,引起血管内皮功能障碍。
2.3.2 苯丙氨酸。BH4可通过影响体内苯丙氨酸的含量进而对BH4缺乏患者脑血管内皮产生影响。体内的苯丙氨酸主要代谢途径是通过苯丙氨酸羟化酶(phenylalanine hydroxylase,pah)作用转变为酪氨酸,而pah发挥作用需要BH4作为辅酶,BH4生理量下降会导致苯丙氨酸正常代谢途径的障碍,而旁路代谢产物苯丙酮酸、苯乙酸及苯乳酸显著增加,引起脑损伤,而脑微循环障碍是脑损伤后主要病理生理学基础之一[11]。致病因素有:① Jacob J M等[12]研究表明成年鼠脑血管内皮细胞无NOS表达,老年鼠有表达,神经损伤后不同时间段诱导型NOS(iNOS)表达均增高。说明年龄和神经损伤对iNOS上调起重要作用。Cobbs CS等[13]测得中度脑损伤后24h脑微血管内皮细胞NOS下降,可导致微血管充血和破坏血脑屏障。②前列腺环素主要由内皮细胞生成,有强力扩血管及抗血小板凝集作用。可通过扩张血管,输送更多的能量至损伤组织,参与创伤愈合而对脑起保护作用。有研究表明,严重脑损伤时,脑血流量或所需底物供给障碍,血管内皮细胞合成前列腺环素受阻,其保护作用未能表达。并且前列腺环素已应用于靶向治疗重度颅脑损伤[14]。③内皮素是已发现的具有很强缩血管作用的多肽类血管活性物质[15]。颅脑损伤后常有脑缺血存在,且有血浆和脑脊液ET含量升高。伤后ET含量迅速升高,与脑血管内皮细胞上调的ETA结合,使脑血流量下降,致脑缺血。④血栓素A2(TXA2)是由脑血管内皮细胞经血栓素合成酶合成和释放,其对脑血管产生收缩作用,还明显地参与并介导去甲肾上腺素和三磷酸腺苷的缩血管效应。Marmarou等[16]报告颅脑损伤后检测TXA2的代谢产物TXB2明显增高,间接反映脑血管内皮细胞TXA2表达增高。组织学证实TXB2明显增高会加重继发性颅脑损害[17]。另外,内皮细胞收缩因子、ICAM-1、热休克蛋白等均参与脑损伤后脑血管的发病。由此可见,BH4含量的降低可间接导致BH4缺乏患者脑血管损伤,进而引起内皮功能障碍。
2.3.3 DA。DA是一种神经传导物质,在下丘脑和脑垂体腺中起重要作用,具有影响人的情绪、提高兴奋性等功能。在外周主要对心血管产生作用。少量DA主要兴奋多巴胺D1受体,使血管舒张,血流量增加。中等量的DA可兴奋多巴胺D1和β受体,使心率、心肌收缩力和心输出量增加。同时,皮肤和黏膜血管收缩,肠系膜和冠状动脉扩张,血流增加,血压和总外周阻力升高或不变。大量DA作用于外周组织,使血压和外周总阻力增加,肾血流降低,尿量减少。另外,DA也是去甲肾上腺素的前体物质,去甲肾上腺素对心血管系统也具有重要的调节作用。人体内,DA等儿茶酚胺主要由肾上腺髓质合成,内皮细胞也会合成和释放一部分儿茶酚胺来维持血管生理的稳定[18]。因此,BH4生理量的异常可导致DA及去甲肾上腺素量的紊乱,进而引起血管内皮细胞功能障碍。
3 小结与展望
综上所述,BH4可通过多种途径对人体血管内皮功能产生影响。大量的研究也已经证明了BH4与心血管疾病存在密切的关系。随着研究工作的进一步深入,必将为通过干扰BH4代谢途径治疗心血管系统疾病提供更多的信息。另外NO代谢紊乱、氧化应激、神经递质代谢异常是多种疾病的共同通路,BH4代谢紊乱在这些疾病中的作用值得深入探讨。
[1] Masanobu Yoshidal,Hirofumi Tomiyamal,Jiko Yamada,et al.Relationship of Insulin Resistance to Macroand Microvasculature Reactivity in Hypertension[J].American Journal of Hypertension,2010,105:427
[2] Ruslan Rafikov,Fabio V Fonseca,Sanjiv Kumar,Daniel Pardo,Charles Darragh,Shawn Elms,David Fulton,and Stephen M Black.eNOS activation and NO function:Structural motifs responsible for the posttranslational control of endothelial nitric oxide synthase activity[J].J Endocrinol,2011,210(3):271
[3] Schubert S,Abdu -lKhaliq H,W ellnhofer E.Coronary flow reserve measu rement detectst ransplant coronary artery disease in pediatric heart transplant patients[J].J Heart Lung Transplant,2008,27(5):514
[4] Thony B,AuerbachG,BlauN.Tetrahydrobiopterin biosynthesis regeneration and function[J].Biochem J,2000,347:1
[5] Davis M.D,Kaufman S.and Milstien S.The auto - oxidation of tetrahydrobiopterin[J].Eur J Biochem,1988,(2):345
[6] Katusic Z.S,d'Uscio L.V.and Nath K.A.Vascular protection by tetrahydrobiopterin:progress and therapeutic prospects[J].Trends Pharmacol Sci,2009,(1):48
[7] 朱宝亮.四氢生物蝶呤对高胆固醇血症所致血管内皮功能异常的转复机制探讨[J].四川生理科学杂志,2008,30(3):106
[8] 王文生.四氢生物蝶呤抗心肌缺血再灌注损伤中的研究进展[D].沈阳:中国医科大学,2004
[9] Houston D,Vanhoulc P.Serotonin and the vascular systerm:Role in heath and discase and implications for therapy[J].Drugs,1986,31:149
[10] Nakamura K,Kariyazono H,Masuda H,et a1.Efects of sarpogrelate hydrochloride on adenosine dlphosphate-or collagen-induced platelet responses in arteriosclerosis obliterans[J].Blood Coagul Fibrinolysis,2001,12:391
[11] J .of Chinese Microcirculation[J].Sep,2001,5(3)
[12] Jacob J M ,Dorheim MA ,Grammas P.The effect of age and injuryon the expression of inducible nitric oxide synthase in facial motor neurons in F344 rats[J].Mech AgeingDev,1999,107(2):205
[13] Cobbs CS,FenoyA,Bredt DS,et al.Expression of nitric oxide synthase in the cerebral microvasculature after traumatic brain injuryin the rat[J].Brain - Res,1997,751(2):336
[14] Olivecrona M,Rodling- Wahlstr?m M,Naredi S,et al.Prostacyclin treatment and clinical outcome in severe traumatic brain injury patients managed with an ICP - targeted therapy:a prospective study[J].Brain Inj,2012,26(1):67
[15] Yanagisawa M,Kurihara H,Kimura S,et al.A novelpotent vasoconstrictor peptide produced byvascular endothelial cell[J].Nature,1988,332(6l63):411
[16] Marmarou A,Abd elfattan Foda MA,Brinl WV,et al.A new model of diffuse brain injuryin rats[J].J Neurosurg,1994,80:291
[17] KongDL,Prough DS,WhitleyJ M.Hemorrhage and intracranial hyper2 tension in combination increase cerebral production of thromboxane A2[J].Crit Care Med,1991,19(4):532
[18] Sorriento D,Santulli G,Del Giudice C,et al.Endothelial cells are able to synthesize and release catecholamines both in vitro and in vivo[J].Hypertension.,2012,60(1):129
