BARF1基因转染对人胃上皮细胞Bcl-2表达的影响
2013-08-25李淑英杜海军张云茹
张 科 张 垅 李淑英 杜海军 赵 莹 张云茹 周 玲 曾 毅
(河北联合大学基础医学院 河北唐山 063000;①河北省辛集市第二医院;②中国疾病预防控制中心病毒病预防控制所肿瘤病毒室,传染病预防控制国家重点实验室病毒性肿瘤组)
胃癌(gastric carcinoma,GC)的发生、发展与多种因素相关,如化学致癌物(包括吸烟、嗜酒及亚硝胺)、营养(包括维生素和微量元素)缺乏及微生物(包括细菌、真菌及病毒)感染等。有研究显示:大约10%的胃癌与EB病毒(EPstein-Barr virus,EBV)有关[1],BARF1是EBV编码的BamH I A区域的早期裂解基因,是近年来确认的EBV新的致癌基因,可促进上皮细胞永生化和转化等功能[2,3]。本项研究采用携带 BARF1基因的真核表达载体,转染人胃上皮细胞,探讨BARF1基因转染对人胃上皮细胞Bcl-2表达的影响。
1 材料与方法
1.1 材料 B95-8细胞、真核表达载体 PIRES2-EGFP/BARF1及GES-1细胞本室保存。RNA提取试剂盒、RT-PCR试剂盒、RPMI1640细胞培养液、DMEM培养液、小牛血清、CCK-8试剂盒及2xPower Taq PCR Master Mix均购于北京百泰克生物公司。
1.2 方法
1.2.1 细胞培养。B95-8细胞使用 RPMI1640,GES-1细胞使用DMEM,并在培养液中添加10%灭活的小牛血清、100U/mL青霉素和100U/mL链霉素。培养于37℃,5%CO2的温箱中,每2~3天换1次液。
1.2.2 细胞的转染与克隆。用 lipofectamine2000介导,将PIRES2-EGFP空载体及携带目的基因BARF1的真核表达载体转染人胃上皮细胞GES-1(按试剂盒说明书操作)。用有限稀释法进行克隆,转染后第3天将细胞消化分散,按每孔200个细胞接入48孔细胞培养板,用含有300μg/mL的G418培养液进行筛选,每2~3天换1次液,长出抗性克隆后扩大培养。
1.2.3 转染细胞鉴定BARF1基因的表达。将抗性克隆细胞扩大培养后,提取细胞RNA,RT-PCR鉴定BARF1基因的表达,所用引物如表1。PCR产物在含0.01%Gold View(核酸染料)的1.5% 琼脂糖凝胶上电泳检测。电泳后在凝胶成像仪照相。

表1 本研究中使用的扩增引物
1.2.4 免疫组化法检测Bcl-2的表达状况。取对数生长期细胞,经0.25%胰酶消化,用含10%胎牛血清的DMEM制成单细胞悬液,做活细胞计数,使细胞浓度为1×104个细胞/mL。将细胞悬液加入6孔板中,每孔加入10片已灭菌的盖玻片,待盖玻片中细胞汇合度达70% ~80%,停止培养。用PBS洗3次;用4%多聚甲醛4℃固定;免疫组化法(按试剂盒说明书操作)检测Bcl-2的表达;Bcl-2定位于细胞浆,在染色标本片上于细胞浆中见到均匀棕黄色颗粒分布判为阳性,阴性结果不显色,经苏木精复染后,细胞核显示复染的蓝色。
2 结果
2.1 单克隆细胞的获得 G418为新霉素类似物,可以杀死没有其抗性的细胞,而我们构建的BARFl真核表达载体和空载体PIRES2-EGFP均具有neo抗性,所以通过G418可以筛选出阳性克隆细胞。约2周后即可看到有G418抗性克隆出现,而载体没有成功转染的细胞均已死亡。每种转染细胞分别挑出3个单克隆扩大培养。
2.2 转染细胞鉴定BARF1基因的表达 从阳性克隆细胞(包括BARFl转染的细胞和空载体转染的细胞)里提出总RNA,逆转录,以逆转录产物为模板PCR扩增BARF1,扩增长度为524 bp(图1)。
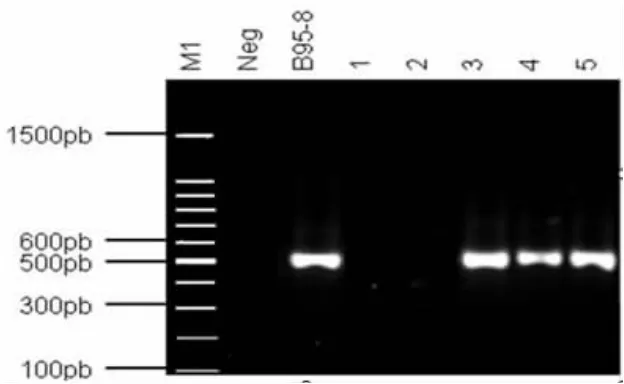
图1 真核质粒双酶切鉴定
2.3 Bcl-2表达结果 Bcl-2的表达定位在细胞浆,阳性表达在细胞浆可见到均匀棕黄色颗粒分布,阴性结果不显色,经苏木精复染后,显示复染的蓝色。免疫组化染色结果显示:GES-1、转染了空载体的GES-1细胞均为检测到Bcl-2的表达,而转染BARF1基因组的细胞浆中都能见到棕褐色的阳性结果(如图①、②、③)。

图1 GES-1未转染细胞bc1-2检测结果

图2 GES-1转染空载体细胞Bc1-2检测结果

图3 GES-1转染BARF1细胞Bc1-2检测结果
3 讨论
BARF1是近年来确认的EBV新的致癌基因,其致癌作用日益受到关注。李友琼等[4]将 BARF1基因转染胃癌细胞系SGC7910后,能够全面增强胃癌细胞的肿瘤原性。
本研究通过脂质体介导,将携带BARF1基因的真核表达载体PIRES2-EGFP/BARF1转染人胃上皮细胞GES-1,建立了稳定表达BARF1基因的人胃上皮细胞GES-1/BARF1,为进一步探讨BARF1基因在胃癌发生及发展中的作用奠定了基础。
Bcl-2是目前已知抑制细胞凋亡最重要的一种基因,其编码蛋白是抑制细胞程序化死亡的关键因子,Bcl-2的高表达能使细胞凋亡减少,存活细胞数量增多而诱使肿瘤发生。Ohfuji[5]等研究了bcl-2在伴有淋巴基质的EBVaGC与不伴有淋巴基质胃癌的表达,结果表明,在EBVaGC中bcl-2表达增加,凋亡信号减少;Kume等[6]对EBVaGC及EBVnGC进行细胞凋亡率及凋亡相关蛋白表达进行对比研究,结果发现EBVaGC组表现为低凋亡和 bcl-2 高表达[7,8],EBVaGC 中高 bcl-2 表达可能对肿瘤细胞的凋亡有保护作用。Sheng等[9]利用缺失突变的方法证实,EBV编码的BARF1基因N-末端蛋白是细胞发生恶性转化所必须的区域,并且BARF1基因具有活化抗凋亡基因bcl-2表达的能力。本项研究结果显示:未转染的GES-1细胞中不表达或低表达Bcl-2蛋白,而BARF1转染的GES-1细胞中Bcl-2高表达。这些结果表明,BARF1与Bcl-2的相互协调对于恶性转化的发生是至关重要的,该基因可促进上皮细胞永生化和转化,在EB病毒相关胃癌的发生、维持恶性细胞的肿瘤原性及抗调亡中均起重要作用。
[1] Burke A P,Yen T S,Shekitka K M,et al.Lymphoepithelial carcinoma of the stomach with Epstein-Barr virus demonstrated by polymerase chain reaction[J].Mod Pathol,1990,3(3):377
[2] Seto E,Yang L,Middeldorp J,et al.Epstein Barr virus(EBV)encoded BARF1 gene is expressed in nasopharyngeal carcinoma and EBV-associated gastric carcinoma tissues in the absence of lytic gene expression[J].J Med Virol,2005,76(1):82
[3] Fiorini S,Ooka T.Secretion of Epstein Barr virus encoded BARF1 oncoprotein from latently infected B cells[J].Virol J,2008,5(70):1186
[4] 李友琼,张雪怡,曾 健,等.EB病毒BARF1基因表达对胃癌细胞株SGC7910生物学行为的影响[J].江苏大学学报(医学版),2009,19(3):214
[5] Ohfuji S,Osaki M,Tsujitani S,et al.Low frequency of apoptosis in Epstein-barr virus-associated gastric carcinoma with lymphoid stroma[J].Cancer,1996,68(6):710
[6] Kume T,oshima K,Shinohara T,et al.Low rate of apoptosis and overexerpression of bcl-2 in Epstein-barr virus-associated gastric carcinoma[J].Hisopathology,1999,34(6):502
[7] Yang J,Liu X,Bhalla K,et al.Prevention of apoptosis by bcl-2:release of cytochromec from mitochondira blocked[J].Science,1997,275(5303):1129
[8] Vaux DL,Cory S,Adams J,et al.Bcl-2 gene promotes haemopoietic cell survival and cooperates with c-myc to immortalize pre-B cells[J].Nature,1988,335(6189):440
[9] Sheng W,Decaussin G,Sumner S,et al.N - terminal domain of BARF1 gene encoded by Epstein-Barr virus is essential for malignant transformation of rodent fibroblasts and activation of BCL -2[J].Oncogene,2001,20(10):1176
