破布木果总多酚的超声提取工艺研究
2013-08-24刘枫张雪佳李洁田树革
刘枫 张雪佳 李洁 田树革
维药破布木果为紫草科(Boraginaceae)植物破布木Cordia dichotoma Forst.f的干燥成熟果实,秋季果实采摘,晒干[1]。维吾尔医认为破布木果功效生湿生热,成熟异常黑胆质,润肺润喉,止咳化痰,清音止渴,通便利尿。主治干寒性或黑胆质性疾病,如咽干喉燥,乃孜来性感冒,干咳顽痰,失音口渴,小便不利,大便不畅等[2]。破布木喜生于低海拔林中,云南、广西、广东、台湾、福建有分布,印度、越南、澳大利亚东北部、菲律宾等亦有分布[2]。
植物多酚是一种广泛存在于植物体内的多元酚类化合物,又称单宁,是植物的次生代谢产物,属于天然有机化合物,在维管植物中的含量仅次于纤维素、半纤维素和木质素,广泛存在于植物的皮、根、叶、果中,含量可达20%[3]。植物多酚的多元酚结构使其具有抗肿瘤、抗氧化、抗脉硬化、防治冠心病与中风等心脑血管疾病以及抗菌等多种理功能[4-7],从而广泛应用于食品、医药、化妆品、日用化学品以及保健品等领域[8-11]。
超声波辅助提取是一种利用外力强化提取的新技术,具有提取时间短、提取效率高、能耗低等优点,被广泛用于天然香料、植物酶、中草药活性成分等的提取[12]。超声的空化作用对细胞膜的破坏有助于化合物的释放与溶出,超声波使提取液不断振荡,有助于溶质扩散,可以明显地加速植物体和种子中有机成分的提取过程[13]。本文以破布木果作为原料,以没食子酸为对照品,采用超声辅助Folin-Ciocalteu比色法[14]测定破布木果中多酚含量,优化了最佳提取条件,进行了方法学考察,建立了破布木果总多酚含量的分析方法,为破布木果的开发利用提供研究基础。
1 仪器与材料
1.1 仪器
KQ-500DE型数控超声波发生器(昆山市超声仪器有限公司);紫外可见分光光度计(澳大利亚GBC科学仪器公司GBCCintra-40型);AL204型电子天平(梅特勒-托利多仪器(上海)有限公司);TGL-16B型离心机(上海安亭科学仪器厂);B-260型水浴锅(上海亚荣生化仪器厂);AK-1000A型500克摇摆式中药粉碎机(温岭市奥力中药机械有限公司)。
1.2 材料
没食子酸对照品(天津市光复精细化工研究所,含量:99%);破布木果来自新疆麦迪森维药有限责任公司饮片厂。经高速万能粉碎机粉碎后成细粉,过40目筛,即得。无水碳酸钠、钨酸钠、钼酸钠、硫酸锂、乙醇等。所用试剂均为分析纯,实验用水为自制蒸馏水。
2 方法与结果
2.1 总多酚含量测定
2.1.1 对照品溶液的制备 精密称取没食子酸对照品10 mg,置于100 ml容量瓶中,加蒸馏水溶解,并定容至刻度,即得0.1 mg/ml的没食子酸对照品溶液。
2.1.2 供试品溶液的制备 取干燥后的破布木果粉末1 g,置于锥形瓶中,加50%(体积分数)乙醇50 ml,超声提取30分钟。离心,取上清液定容至50 ml的容量瓶中,摇匀,即得供试品溶液。
2.1.3 Folin—Cioealteu试剂(磷钼钨酸试液)的制备 称取钨酸钠100.0 g和钼酸钠25.0 g,置于圆底烧瓶中用700 ml蒸馏水溶解,加入85%的磷酸50 ml和100 ml浓盐酸充分混匀,小火加热回流12小时,放冷,再加入150 g硫酸锂,50 ml蒸馏水及0.2 ml双氧水,加热沸腾15分钟至亮黄色,不得带微蓝和绿色,使双氧水完全挥发,冷却后用蒸馏水定容至1000 ml,过滤,于棕色瓶中避光储存。
2.1.4 最大吸收波长的扫描 取对照品溶液和供试品溶液各1 ml,置于25 ml比色管中,加入磷钼钨酸试液1 ml,再加20%(质量分数)的碳酸钠溶液2 ml,用蒸馏水稀释至刻度,摇匀,在40℃水浴恒温30分钟。以相应的试剂为空白,在波长 550~800 nm范围内进行扫描,结果表明二者最大波长均为746 nm,故确定检测波长为746 nm,见图1。
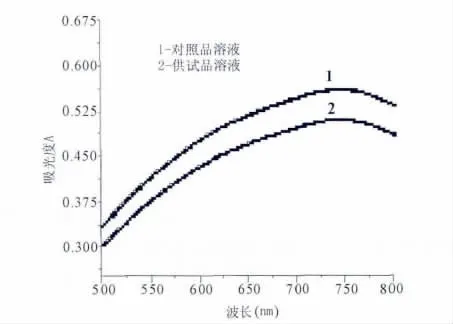
图1 对照品溶液和供试品溶液的吸收谱图
2.1.5 测定方法 准确量取1 ml供试品溶液置25 ml干燥具塞比色管中,加入磷钼钨酸试液1 ml,再加20%(质量分数)的碳酸钠溶液2 ml,用蒸馏水稀释至刻度,摇匀,在40℃水浴恒温30分钟。为消除供试品溶液本身颜色的干扰,制作不加显色剂的对照管。于746 nm波长处测定各吸光度值。
2.1.6 标准曲线的绘制与线性关系 精密吸取对照品溶液 0.1、0.2、0.3、0.4、0.5、0.6、0.7 ml于10 ml干燥具塞比色管中,加入Folin—Cioealteu试剂1 ml,再加20%(质量分数)的碳酸钠溶液2 ml,用蒸馏水稀释至刻度,摇匀,在40℃水浴恒温30分钟,于746 nm波长处测定各吸光度值。以吸光度值A对对照品质量浓度C作图,绘制标准曲线,并进行线性回归,得 回 归 方 程 为 A=145.2857C+0.03271,r=0.9995。没食子酸在0.001~0.007 mg/ml范围内与其吸光度值呈现良好的线性关系,标准曲线见图2。
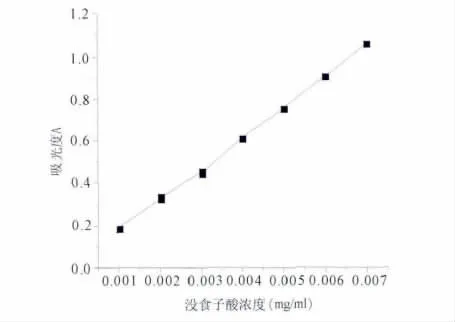
图2 没食子酸标准曲线
2.1.7 精密度试验 精密吸取质量浓度为0.003 mg/ml的对照品溶液,按2.1.5方法显色后连续测定6次吸光度。计算RSD值为0.41%,结果表明该方法测定破布木果多酚精密度良好。
2.1.8 稳定性试验 取供试品溶液,分别于配制后的0、30、60、120、180、240 分钟,按 2.1.5 方法显色后连续测定6次吸光度。结果表明,供试品溶液在30分钟内较为稳定,然后稳定下降,因此,供试品溶液在配制完成后应在30分钟内测定吸光度。
2.1.9 重现性试验 取同一批号的药材粉末6份,按2.1.2所述方法制备,按2.1.5方法显色后连续测定6次吸光度。计算RSD值为0.19%,结果表明该方法测定破布木果多酚重现性很好。
2.1.10 加样回收率试验 精密称取已知质量分数(3.23 mg/g)的样品各0.5 g,共6份,精密加入没食子酸对照品3.2 mg,按“2.1.2”所述方法制备,按“2.1.5”所述方法显色后测定吸光度,计算RSD值为101.46%,结果表明该方法加样回收率试验很好。
2.2 单因素试验
2.2.1 乙醇体积分数对提取率的影响 取破布木果粉末5份,每份1 g,以乙醇体积分数分别为10%,30%,50%,70%,90%,固定料液比为 1∶20,超声时间30分钟,超声波功率400 W进行超声提取。以提取液中多酚含量为指标,研究乙醇体积分数对提取率的影响。乙醇体积分数对提取率的影响见图3。
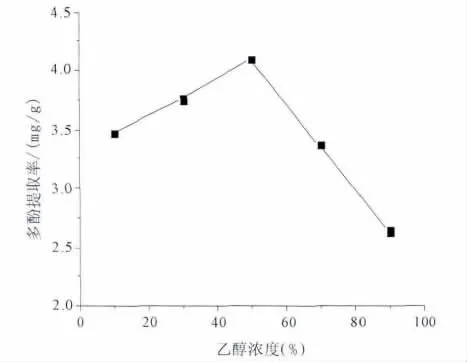
图3 乙醇浓度对破布木果总多酚提取率的影响
结果表明,其他条件不变时,随着乙醇体积分数的增大,多酚含量先升高后降低,并且当乙醇体积分数为50%时,多酚质量浓度最高为4.10 mg/g。所以选择乙醇体积分数为50%。
2.2.2 料液比对提取率的影响 取破布木果粉末5份,每份1 g,改变料液比,以体积分数50%的乙醇为溶剂,超声时间30分钟,超声波功率400 W进行提取。以破布木果提取液中多酚含量为指标,考察固料液比对提取率的影响。料液比对提取率的影响见图4。
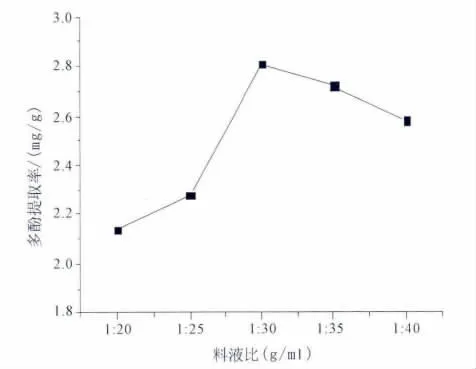
图4 料液比对破布木果总多酚提取率的影响
结果表明,其他条件不变时,当料液比为1∶30时,多酚的得率最高,随着溶剂量的增大,多酚含量呈上升趋势;但当料液比在1∶30~1∶35时,提取液中多酚含量变化不大,所以选择料液比为1∶30。
2.2.3 时间对提取率的影响 取破布木果粉末5份,每份1 g,以体积分数50%的乙醇为提取溶剂,料液比为1∶30,超声波功率400 W,超声时间分别10、20、30、40、50 分钟进行提取。以提取液中多酚含量为指标,考察提取时间对提取率的影响。提取时间对提取率的影响见图5。
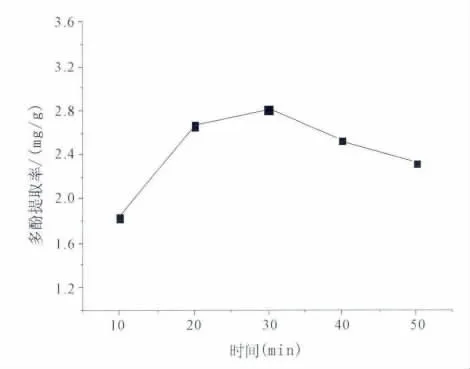
图5 时间对破布木果总多酚提取率的影响
结果表明,其他条件不变时,随着提取时间的延长,提取液中多酚含量先升高后降低。当提取时间为30分钟时,多酚含量最高为2.81 mg,30分钟后提取液中多酚含量反而降低,所以选择提取时间为30分钟。
2.2.4 功率对提取率的影响 取破布木果粉末4份,每份1 g,以体积分数50%的乙醇为提取溶剂,料液比为1∶30,超声时间30分钟,超声波功率分别为200、300、400、500 W,超声波作用时间为30 分钟时进行提取。以提取液中多酚含量为指标,考察超声功率对提取率的影响。超声功率对提取率的影响见图6。结果表明,其他条件不变时,随着超声功率增大,破布木果多酚提取率增大。所以选择超声功率为500 W。
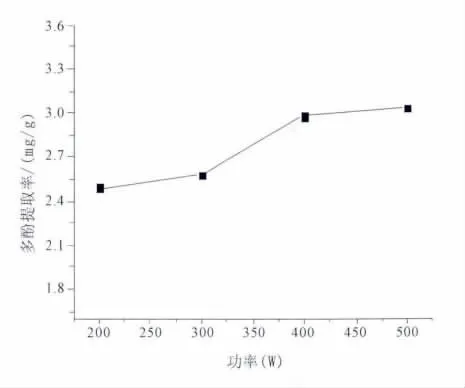
图6 功率对破布木果总多酚提取率的影响
2.3 正交试验优选破布木果总多酚超声辅助提取工艺
在单因素实验的基础上,为了筛选更适宜的提取条件,选取乙醇体积分数(A)、料液比(B)、超声时间(C)和超声功率(D)4个因素,每个因素3个水平,按照L9(34)正交表的试验设计,以优化超声波提取破布木果中总多酚的最佳提取工艺参数。正交试验因素与水平设计见表1,正交试验结果与方差分析结果见表2及表3。

表1 破布木果总多酚提取因素及水平表
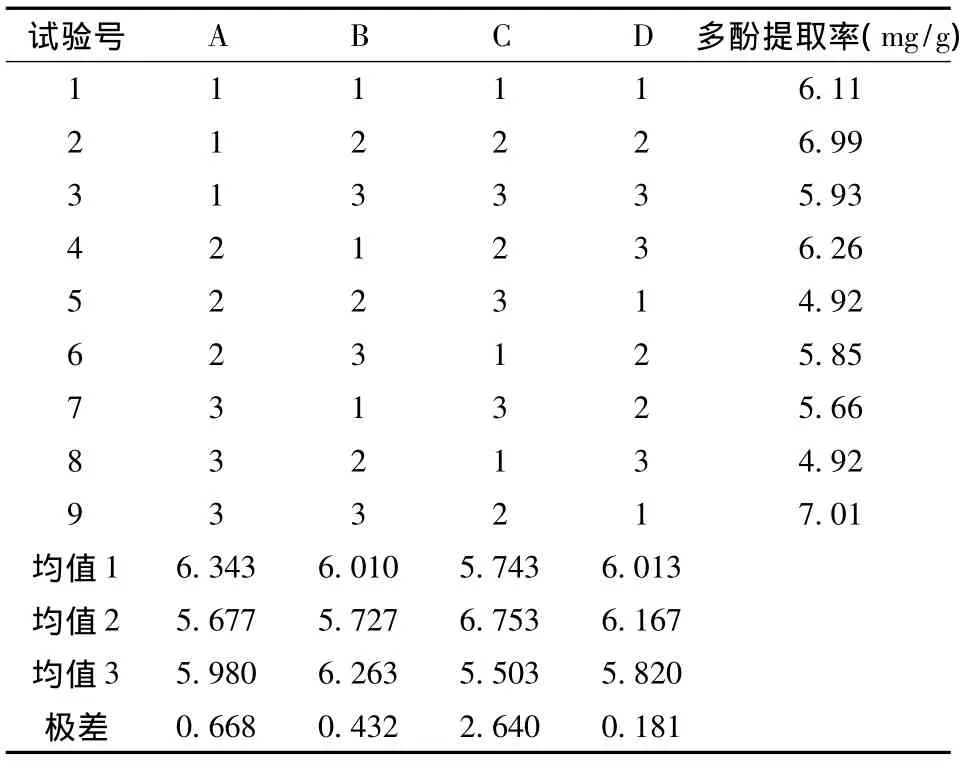
表2 破布木果总多酚提取正交试验结果
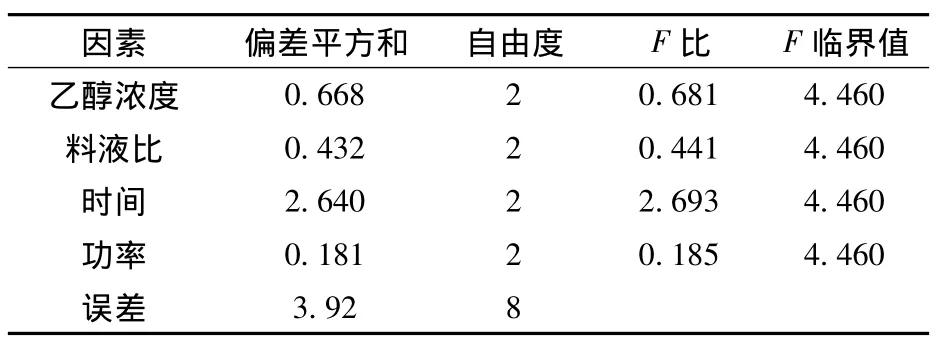
表3 破布木果总多酚提取方差分析表
由表1、2、3可知,以破布木果多酚提取率为检测指标,各因素影响顺序为C>A>B>D。时间对提取工艺有显著性影响。优化出破布木果中多酚提取最佳方案为A1B3C2D2,即提取溶剂为体积分数为30%的乙醇,料液比1∶35,提取时间30分钟,超声功率400 W。
2.4 验证试验
取供试品3份,按照优化工艺条件,重复3次试验进行验证,结果多酚提取率较高,平均为7.15 mg/g,比正交试验中最高提取率(7.01 mg/g)高,表明正交试验所确定的工艺条件为最佳工艺条件。
3 结论
本实验以乙醇溶液为最佳提取试剂,采用单因素试验和L9(34)正交试验设计优化超声波辅助提)取破布木果中总多酚,确定了最佳工艺条件,并进行了验证试验。结果证明,该工艺提取破布木果总多酚线路简单、提取率高、稳定性好,因此为破布木果总多酚提取的工业生产提供了合理的依据。
[1]刘勇民,沙吾提·伊克木.维吾尔药志(上册)[M].乌鲁木齐:新疆人民出版社,1986:351.
[2]刘勇民,沙吾提·伊克木.维吾尔药志(下册)[M].乌鲁木齐:新疆科技卫生出版社,1999:663-665.
[3]袁苏宁,杜卫军,刘丛,等.不同来源薰衣草中总黄酮及总多酚含量测定研究[J].环球中医药,2012,5(9):641-644.
[4]卢结文.丹参多酚酸盐治疗冠心病心绞痛68例[J].环球中医药,2009,2(4):278-279.
[5]梁新华,刘健,马丽娜.茶多酚对肾缺血再灌注损伤大鼠血清超氧化物歧化酶和丙二醛的影响[J].新疆医科大学学报,2008,31(5):573-575.
[6]李雅丽,邢英,杨新玲.丹参多酚酸盐对代谢综合征患者血液流变学的影响[J].新疆医科大学学报,2012,35(8):1062-1064.
[7]杨国萍,顾正一,徐芳.芩蒿滴鼻剂中一枝蒿抗炎有效成分的提取工艺研究[J].新疆医科大学学报,2013,36(1):47-51.
[8]张力平,孙长霞,李俊清,等.植物多酚的研究现状及发展前景[J].林业科学,2005,41(6):157-162.
[9]李健,杨昌鹏,李群梅,等.植物多酚的应用研究进展[J].广西轻工业,2008,121(21):1-9.
[10]尹志娜.植物多酚分离提取方法和生物功能研究进展[J].生命科学仪器,2010,8(6):43-49.
[11]冯丽,宋曙辉,赵霖,等.植物多酚种类及其生理功能的研究进展[J].江西农业学报,2007,19(10):105-107.
[12]王晓琳,钟方丽,孙威,等.东北铁线莲总多酚的超声提取工艺研究[J].河北科技大学学报,2012,33(1):32-35,88.
[13]王英,张玉刚,戴洪义.超声波法提取苹果果实中类黄酮最佳条件研究[J].食品研究与开发,2012,33(2):24-27.
[14]唐金华,丁文欢,李永和,等.Folin-Ciocalteu比色法测定阜康阿魏叶中总多酚的含量[J].新疆医科大学学报,2012,35(9):1143-1145.
