纤维蛋白胶复合骨形态发生蛋白与VEGF修复兔桡骨缺损的实验研究
2013-08-23肖裕华李绍琴潘文峰李建飞陈宗和
肖裕华 ,李绍琴 ,潘文峰 ,李建飞 ,陈宗和
(1.江西省人民医院骨一科,南昌 330006;2.上高县中医院骨科,江西 上高 336400)
骨缺损修复治疗一直是临床上的难题之一,目前尚无妥善的解决方法。随着组织工程学的发展,骨组织工程技术为骨缺损的修复提供了新的方法。目前大部分研究集中于支架性骨修复材料,但其需要手术切开才能应用,不适用于只需要非手术治疗的骨折,且修复材料内部的再血管化问题一直未得到有效的解决[1]。纤维蛋白胶(FS)具有良好的生物相容性和可注射性。骨形态发生蛋白(BMP)可诱导诱导性骨源性前体细胞向确定性骨源性前体细胞分化[2]。血管内皮生长因子(VEGF)是促进血管生长最重要的生长因子,对骨折愈合过程中的血管增生发挥着重要的作用。笔者的前期研究表明,用可注射的FS为载体复合BMP和VEGF具有良好的诱导大鼠异位成骨作用[2]。本研究在前期研究的基础上探索以FS为载体复合BMP和VEGF的新型骨修复材料修复兔桡骨节段性缺损,通过X线摄片观察测量、生物力学测试、组织形态学观察等手段,评价其修复的效果,为其临床应用奠定基础。
1 材料与方法
1.1 材料的制备
FS(广州倍秀生物技术有限公司)抑胰肽酶溶液内分别加入rhBMP-2(北京华宇泰克生物工程公司)和VEGF(美国Ebioscience公司)。
1.2 可注射型组织工程骨的构建
注射型组织工程骨由溶液Ⅰ和Ⅱ组成。溶液Ⅰ,为催化剂溶液,其成分为 CaCl2(40 mmol·mL-1)、凝血酶(400 U·mL-1)及 VEGF 和 rhBMP-2 冻干粉用重蒸水溶液组成;溶液Ⅱ为以抑肽酶溶液溶解纤维蛋白原(80 mg·mL-1)。使用时以双联注射器分别吸入溶液Ⅰ、Ⅱ,注入体内后约25 s形成黏稠果冻状凝胶。rhBMP-2的浓度为2.5 mg·L-1,VEGF的浓度为0.3 mg·L-1。
1.3 实验动物分组、模型的建立及药物处理
健康的新西兰大白兔24只,雌雄不拘,3个月龄,体质量为2.0~2.5 kg,由南昌大学实验动物学部提供。随机分为A、B、C 3组,每组8只,编号分笼饲养。采用速眠新、氯胺酮和阿托品复合液肌内注射麻醉。麻醉成功后,将动物仰卧固定于兔台上,术区备皮消毒,铺无菌巾。以双侧前肢桡骨中段为中心行约3 cm直切口,切开皮肤钝性分离皮下组织,于肌间隙暴露桡骨,线锯取骨,连同骨膜切除造成约10 mm节段骨缺损,缺损区用无菌干纱布填塞止血,建立兔桡骨节段性缺损模型。
A组将FS+VEGF+BMP经正常皮肤注射骨缺损处、B组将FS+BMP经正常皮肤注射骨缺损处、C组将FS注射骨缺损处,各组根据骨缺损大小,植入相应材料体积约0.5 mL。逐层缝合切口,术后3 d连续肌内注射青霉素40万U·d-1。每组均于术后6、12周各处死4只动物取材(骨缺损处)。
1.4 大体标本观察
术后观察动物饮食、日常活动能力及术后伤口愈合情况。观察组织工程骨的表面变化、骨痂形成、骨缺损修复情况及周围组织反应。
1.5 组织学观察
各组于术后6、12周分别取4只兔标本 (包括植入体、受体界面远近端各0.5 cm),小心剥离界面区组织,所取标本置于10%甲醛液中固定24 h,10%硝酸脱钙2 d,水洗,系列脱水,常规石蜡包埋,纵切,厚度5 μm,HE染色,光镜下观察各组缺损再生性修复情况。
1.6 X线检查
曝光条件为40 kV,50 mA,0.2 s,距离为60 cm。拍摄兔桡骨正位X线片,观察术区骨修复情况。阻射密度以同一X线片骨缺损临近正常骨区域相同面积皮质骨密度为100、相同面积X线片底色设为0测量的骨缺损阻射密度相对值表示。
1.7 生物力学测试
取A、B组术后12周骨缺损愈合的尺、桡骨各8根于万能材料实验机上行抗扭转、垂直压缩及三点弯曲试验,计算机记录测试数据并绘制力位移曲线,根据曲线计算其扭转刚度、压缩刚度、最大折断力及抗折弯刚度。C组无骨性愈合标本,未行生物力学检测。
1.8 统计学方法
2 结果
2.1 一般情况
术后1~3 d所有兔精神、饮食稍差,活动少,无畏寒、发热征象,全身未见皮疹,手术切口无明显红肿、渗液等。4 d后精神好转,饮食正常,活动增加。
2.2 大体标本观察
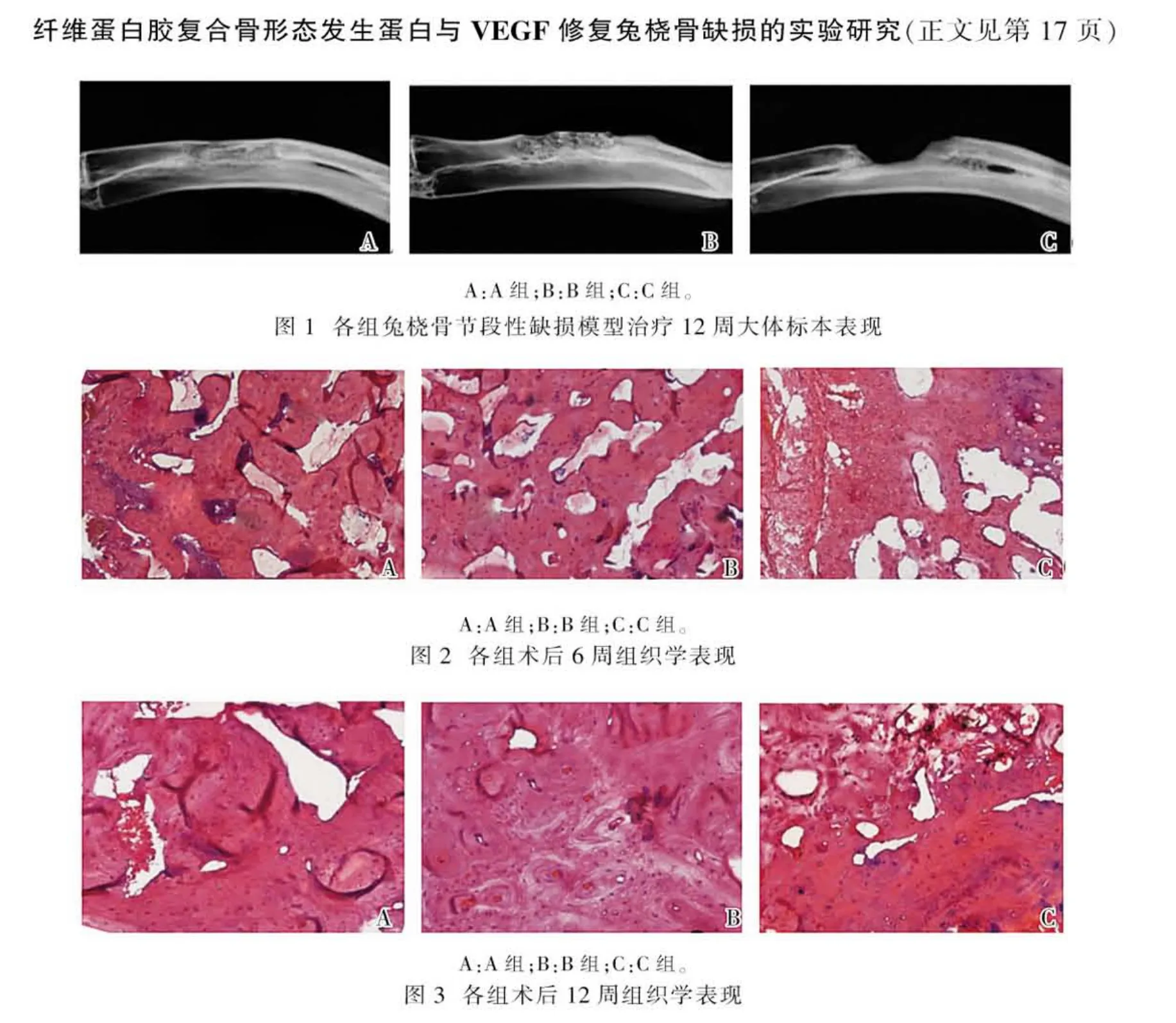
术后6周A组骨缺损的断端出现硬度较多的类骨样组织;B组骨缺损断端类骨样生成较少,纤维组织量较多;C组均为较致密的纤维组织。术后12周A组骨缺损区已完全修复,新生骨直径较邻近宿主骨直径大小较一致,完全离断后发现髓腔已再通(封四图1A);B组可见骨缺损部位有连续性新骨生成,但直径较邻近宿主骨部分略纤细(封四图1B);C组仅在骨缺损断端见少量新生骨,缺损区域填充大量纤维组织(封四图1C)。
2.3 组织学观察
术后6周,A、B、C 3组骨缺损处纤维蛋白凝胶均大部分降解吸收。A组新生组织周围见新生血管丰富,纤维组织下有大量新生骨组织,明显钙盐沉积,可见骨小梁结构,部分区域有髓腔样结构形成(封四图2A)。B组新生组织为纤维组织充填,新生血管不如A组丰富,有散在片状骨小梁结构,骨细胞较多,骨组织较少(封四图2B)。C组新生组织为纤维组织结构,成纤维细胞丰富,未见成骨(封四图2C)。术后12周,A组为成熟骨组织结构,骨基质丰富,骨细胞缩小,可见少量破骨细胞,骨髓腔贯通,可见造血细胞(封四图3A)。B组骨组织成熟度较A组稍差,髓腔结构不完整(封四图3B)。C组仍以纤维结缔组织为主,中间仅见少量岛状或片状骨组织(封四图 3C)。
2.4 X线表现
术后6周:A组宿主骨与植入组织之间界面模糊,出现较多骨痂,骨缺损部位出现较多散在的密度增浓影;B组骨断端出现骨痂量较少,骨痂不连续,密度不高;C组可见清晰骨缺损区,只在截骨断端有少许骨痂形成。术后12周:A组骨缺损处的骨痂已完全骨化,直径与宿主骨的直径较一致,髓腔贯通。B组缺损区骨痴密度、数量增加,但直径小于断端宿主骨。C组骨缺损区依然清晰,部分断端硬化停止生长。术后6、12周骨缺损修复的X线阻射密度值均为A组>B组>C组(P<0.05)。见表1。

表1 各组骨缺损分析平均阻射密度值 x±s
2.5 生物力学测试
A组标本压缩、扭转刚度及三点弯曲最大负荷生物力学表现均优于B组(表2)。
表2 A、B组术后12周标本压缩、扭转刚度及三点弯曲最大负荷的比较 ±s

表2 A、B组术后12周标本压缩、扭转刚度及三点弯曲最大负荷的比较 ±s
*P<0.05与B组比较。
组别 n 压缩刚度(N·m-1) 扭转刚度(N·m-1) 最大负荷/N A 组 8 (305.32±4.78)×103* (89.41±1.64)×10-3*175.49±8.32*B 组 8 (265.41±5.63)×103 (75.39±1.75)×10-3 145.81±9.45
3 讨论
BMP是一种高效的骨诱导生长因子,它能诱导血管周围未分化间充质细胞和骨髓基质细胞分化为成软骨细胞和成骨细胞,促进骨细胞的生长增殖,进而合成胶原,形成钙化的骨组织,它可以促进原位或异位骨的形成[3]。 研究[4]表明,BMP-2 是促进骨形成和诱导成骨细胞分化最重要的细胞外信号分子之一,BMP-2/Smads/Runx2/Osterix信号通路和BMP-2/Smads/Msx2/Osterix信号通路是骨组织形成过程中间充质细胞分化为成骨细胞及骨细胞外基质合成、分泌所必需的。BMP-2通过激活Smads信号转导和调节成骨基因转录而发挥其成骨作用。VEGF具有强的促血管内皮细胞有丝分裂的作用,增加血管通透性及血管维持功能,有利于毛细血管的生成,为局部材料的降解及新骨的形成创造最佳的微环境;还能提高成骨细胞的活性和软骨内成骨,从而促进骨形成,并且血管内皮细胞和成骨细胞之间还存在生长因子分泌和旁分泌的相互关系[5]。有研究发现,BMP和VEGF在骨愈合中对成骨有相互依赖及调控的作用[6]。但VEGF和BMP在体内半衰期短,直接注人体内易降解,故外源性单纯给予上述蛋白的治疗效果有限[7]。FS是一种具有多向生物活性的生物蛋白制剂,由纤维蛋白原、凝血酶及其他生物活性因子组成,具有止血、趋化及促细胞有丝分裂等特性,氯化钙与抑肽酶是影响纤维蛋白凝固稳定性的2种重要成分[8-9]。FS具有多孔的三维立体结构,细胞容易贴附,利于营养物质的渗透及代谢产物的排出;还有良好的骨传导性及可降解可塑性,容易与其他生物活性材料制成注射剂,操作十分简便。
笔者的前期实验研究表明,FS复合VEGF和BMP具有良好的诱导异位成骨的作用,其机制可能是FS天然的网状微观结构有助于BMP、VEGF的附着和BMP、VEGF与靶细胞接触,利于BMP和VEGF的缓慢释放。因此,随着FS的降解,在植入材料的周围形成了一个BMP浓度梯度,增加了BMP和VEGF与靶细胞作用的时间,并且FS作为生物性材料,其内部良好的微环境及大分子蛋白可保护BMP和VEGF不发生非特异性蛋白水解,从而使其骨诱导活性及促进增殖活性得以最大限度地发挥。本研究在前期实验的基础上,利用FS成形前各成分为液体的特性,复合BMP和VEGF,在体外构建出可注射状的组织工程骨用于修复兔桡骨缺损。实验结果表明,从组织学方面观察,术后6周A组新生组织周围见丰富的新生血管,纤维组织下有大量新生骨组织,明显钙盐沉积,可见骨小梁结构,部分区域有髓腔样结构形成。这表明本方法构建的组织工程骨体内植入后有较好的促细胞增殖作用和血管化作用。而B组新生血管不如A组丰富,有散在片状骨小梁结构,骨细胞较多,骨组织较少。C组仅形成纤维组织,未见骨细胞,新生血管较少。表明VEGF促进新生血管组织的生长,一方面给细胞带来丰富的营养,可促进细胞的成活和增殖,另一方面也利于其他部位的间充质细胞聚积于骨缺损部位。同样,在X线检测和生物力学检测方面,A组修复兔桡骨缺损的效果明显优于B组及C组。
综上所述,FS复合BMP和VEGF修复骨缺损的效果理想,明显优于只复合BMP及单纯应用FS的效果,说明VEGF+BMP促进骨生长具有协同作用。同时,这种新型可注射型组织工程骨材料有望在临床得到广泛应用。
[1] Kanczler J M,Ginty P J,White L,et al.The effect of the delivery of vascular endothelial growth factor and bone morphogenic protein-2 to osteoprogenitor cell populations on bone formation[J].Biomaterials,2010,31(6):1242-1250.
[2] 李建飞,肖裕华,李绍琴,等.纤维蛋白胶复合VEGF和BMP诱导异位成骨的实验研究[J].实用临床医学,2010,11(7):8-10.
[3] Srouji S,Ben David D,Lotan R,et al.Slow-release human recombinant bone morphogenetic protein-2 embedded within electrospun scaffolds for regeneration of bone defect:in vitro and in vivo evaluation[J].Tissue Eng Part A,2011,17(3/4):269-277.
[4] 符来想,程迅生.负载BMP-2组织工程骨修复骨缺损的研究进展[J].医学综述,2013,19(4):590-593.
[5] Kaigler D,Wang Z,Horger K,et al.VEGF scaffolds enhance angiogenesis and bone regeneration in irradiated osseous defects[J].J Bone Miner Res,2006,21:735-744.
[6] Kempen D H,Lu L,Heijink A,et al.Effect of local sequential VEGF and BMP-2 delivery on ectopic and orthotopic bone regeneration[J].Biomaterials,2009,30(14):2816-2825.
[7] 瞿向阳,蒋电明,安洪,等.复合 rhVEGF+rhBMP-2促进犬异体脱蛋白骨关节磷骨水泥的成骨研究[J].重庆医科大学学报,2007,32(5):484-488.
[8] Le G L,Go E,Ag E,et al.Influence of calcium chloride and aprotinin in the in vivo biological performance of a composite combining biphasic calcium phosphate granules and fibrin sealant[J].J Mater Sci Mater Med,2007,18(8):1489-1495.
[9] Le Nihouannen D,Saffarzadeh A,Aguado E,et al.Osteogenic properties of calcium phosphate ceramics and fibrin glue based composites[J].J Mater Sci Mater Med,2007,18(2):225-235.
