肾透明细胞癌组织中miR-34a 和miR-34b/c基因CpG 岛甲基化状态的变化及意义
2013-08-23徐仁芳何小舟徐海燕
殷 帅,徐仁芳,何小舟,徐海燕
(苏州大学第三附属医院、常州市第一人民医院泌尿外科,江苏 常州 213001)
miRNA是一类大小为21~25个核苷酸的内源性非编码小RNA,miRNA在发育、衰老、肿瘤发生等病理生理过程的调控中发挥着重要的作用,miRNA通过靶向不同的目的mRNA,在不同程度上调节蛋白表达水平,进而在生物的生长发育中起重要作用[1]。 新近研究表明,miR-34s(miR-34 家族)在抗癌基因p53的调控通路中发挥着不可忽视的作用[2-10]。miR-34s的转录受 p53蛋白调节,并参与p53 作用通路[3-10];此外,miR-34s 还通过对 SIRT I和E2F3的抑制进而对p53活性产生正反馈调节作用[2,11-12];其中,miR-34a 和 miR-34b/c 的编 码基 因为p53目的基因并且拥有肿瘤抑制功能,如诱发细胞凋亡、细胞周期阻滞、促进细胞衰老等,同时miR-34a和miR-34b/c基因启动子序列区存在一个CpG岛,在一些肿瘤如结肠癌、乳腺癌、胰腺癌等,该CpG岛被甲基化后导致miR-34a和miR-34b/c的失活并伴随着p53的突变及功能的抑制[13-14]。本研究观察肾透明细胞癌组织中miR-34a和miR-34b/c基因CpG岛的甲基化水平,旨在为探讨miR-34a和miR-34b/c在肾癌中的生物学功能及其与肿瘤的关系提供实验依据。
1 材料与方法
1.1 标本来源
选择2008年1月至2012年7月在苏州大学第三附属医院泌尿外科进行手术切除并保存于液氮中的30例肾癌组织标本及其癌旁正常组织 (癌旁正常组织距离肿瘤边缘>5 cm)标本。其中男19例,女11例,年龄35~78岁,术后病理诊断均为肾透明细胞癌。依据是否伴有淋巴结转移,将冻存的肾癌组织标本和癌旁正常组织标本分为2组:A组15例为无淋巴结和(或)远处转移标本,B组15例为有淋巴结和(或)远处转移标本。
1.2 主要试剂与仪器
Wizard基因组DNA纯化试剂盒(美国Promega公司),EZ DNA甲基化试剂盒(德国 Zymo Research公司),常规试剂由常州市第一人民医院泌尿外科实验室提供。DU800紫外分光光度计(美国BECKMAN COULT ER 公司),ChemiDo cTM XRS+电泳照胶仪(美国BIORAD公司),EPPENDORF 6325型普通PCR仪(德国EPPENDORF公司),Himac CT15E低温高速离心机(日本Hitachi公司)。
1.3 实验方法
为了分析miR-34基因启动子序列在肾透明细胞癌中的甲基化水平,本研究从收集的标本中分离提纯基因组DNA(gDNA),并用重亚硫酸盐处理(来源于甲基化试剂盒),从而使启动子序列CpG岛中未甲基化的胞嘧啶转化成胸腺嘧啶,同时将已甲基化的胞嘧啶保留下来。经转化后的gDNA用于甲基化型 PCR 分析[15]。
1.3.1 组织标本中DNA的提取
冻存组织标本经碾碎后,使用Wizard DNA快速提取试剂盒提取、纯化组织标本中的基因组DNA,DU800紫外分光光度计检测DNA浓度及纯度,选取OD260/OD280吸光度比值位于1.6~1.8的样本,详细提取步骤可参阅产品说明书。
1.3.2 DNA的甲基化修饰
每份 200~500 ng的基因组 DNA(gDNA),经 EZ DNA甲基化试剂盒中的重亚硫酸盐处理,最终可获得 10 μL 甲基化修饰后的 DNA,每次取 1~2 μL 用于甲基化型 PCR(MSP)。
1.3.3 RT-PCR
取 1~2 μL甲基化修饰型 DNA进行 PCR,PCR的引物序列已经是经验证过的[14],序列见表1。
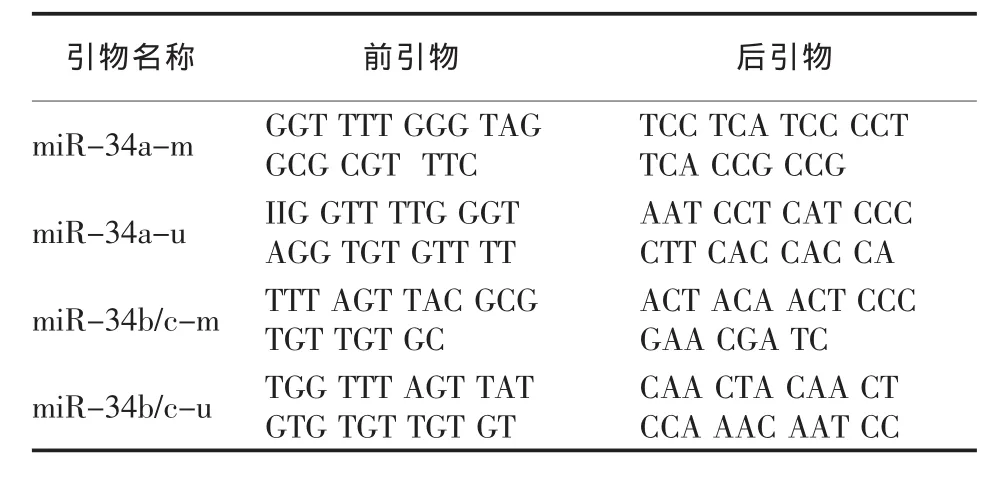
表1 PCR引物序列
PCR反应的条件:1)miR-34a反应温度:95℃10 min,2 次循环 95 ℃ 20 s、68 ℃ 30 s、72 ℃ 30 s,2次循环 95 ℃ 20 s、66 ℃ 30 s、72 ℃ 30 s,34次循环 95 ℃ 20 s、65 ℃ 30 s、72 ℃ 30 s,72 ℃ 4 min。2)miR-34b/c反应温度:95 ℃ 10 min,95 ℃ 20 s、68 ℃30 s、72℃ 30 s。PCR结果用4% 琼脂糖胶上样电泳,电泳照胶仪下观察。
1.4 统计学方法
使用 SPSS11.5统计软件。本实验采用χ2检验,分析miR-34s启动子序列甲基化水平在肿瘤组织和正常组织中的差异以及与肾肿瘤淋巴结转移的相关性,以P<0.05为差异有统计学意义。
2 结果
甲基化型PCR电泳结果显示,miRNA-34a和miR-34b/c基因成单一条带,其所处的位置及其在正常组织和癌组织中的甲基化情况符合前期的预计(图1-2),证明相应的试验条件和所设计的引物均符合实验要求。
PCR结果显示,A组肾癌组织中miR-34a基因CpG 岛甲基化 4例,占 26.7%(4/15),miR-34b/c 15例,占 100.0%(15/15),癌旁正常组织均为 0;B组肾癌组织中miR-34a基因CpG岛甲基化13例,占86.7%(13/15),miR-34b/c 15 例,占 100.0%(15/15),癌旁正常组织均为0。结果表明,miR-34a和miR-34b/c基因CpG岛甲基化状态在肾癌组织中明显增高;伴有淋巴结转移的肾癌组织中,miR-34a基因CpG岛甲基化明显高于无淋巴结转移的肾癌组织(86.7%比 26.7%,P<0.05)。 见表2。
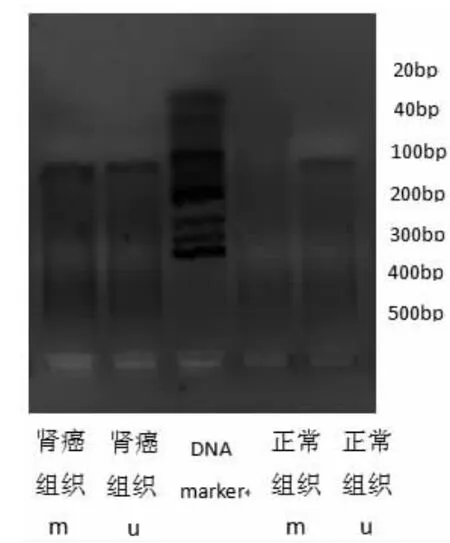
图1 miR-34/a电泳图
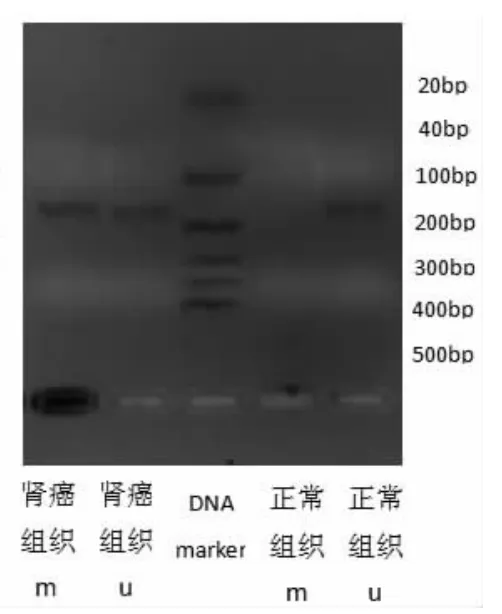
图1 miR-34b/c电泳图
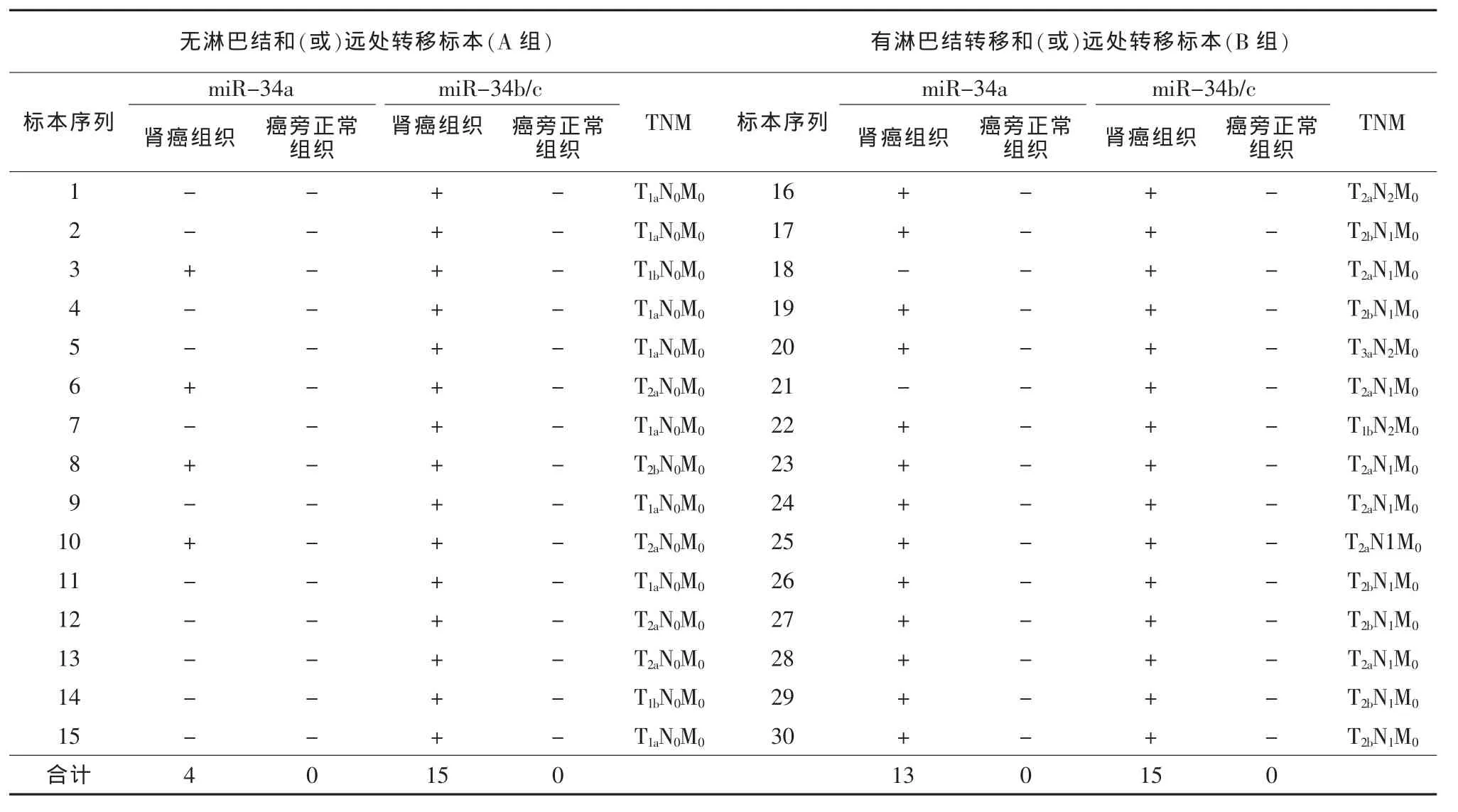
表2 miR-34a和miR-34b/c基因CpG岛甲基化状态比较
3 讨论
目前,随着对miRNA研究的深入,许多miRNA都显示出其抑制肿瘤的能力,以miRNA作为治疗肿瘤的新型基因药物也成为目前的热点。在本次实验中,笔者发现肾透明细胞癌组织中miR-34a和miR-34b/c基因启动子CpG岛均存在较高的甲基化水平,而基因启动子的甲基化状态的改变,促使miR-34a和miR-34b/c基因沉默,引起肾透明细胞癌低表达miR-34a和miR-34b/c,与肿瘤的发生、发展、演变具有一定的联系。
新近研究表明,miR-34a和miR-34b/c具肿瘤抑制作用,不仅通过参与p53通路对肿瘤的抑制,而且也直接有抑制肿瘤的作用,如:1)细胞周期阻滞。Tarasov等[16]将miR-34a全长转录体导入骨肉瘤细胞U-2OS 48 h后,发现导入细胞组相对对照组停滞在G1期的细胞数目增加,同时伴随S期细胞的减少,说明miR-34a可使细胞周期阻滞在G1期。 2)促进细胞衰老。 Tazawa 等[12]将 miR-34a 转染入HCT116细胞、RKO细胞和p53突变的SW480细胞后,发现细胞体积增大且衰老,表明miR-34a可以诱发细胞衰老。3)诱导细胞调亡。miR-34s在癌细胞中重新激活可促使caspase3和PARP的裂解,诱发caspase调控的凋亡途径[4,6,12]。 4)阻止细胞迁移。在黑色素瘤和肝癌组织中,miR-34的再活化能够抑制c-Met蛋白,阻止肿瘤细胞的迁移和浸润[17]。
检测释放到体液中的启动子CpG岛甲基化型miR-34a和miR-34b/c,有可能成为一种新的肿瘤诊断标记,这在其他基因诊断中已被证实,如GSTP[18]。最近研究表明,应用miR-34a治疗肿瘤的小鼠模型,可完全抑制肿瘤的生长[19]。因此,基于miR-34启动子甲基化的诊断和miR-34治疗的结合是可行的。如何采用特定而有效的方法来检测miR-34启动子的甲基化及运用miR-34治疗肿瘤,作为泌尿系统肿瘤诊断的指标、治疗的手段或靶点有可能成为从根本上防治这些疾病的一个新的突破口。
[1] Hammond S M,Sharpless N E.HMGA2,microRNAs,and stem cellaging[J].Cell,2008,135(6):1013-1016.
[2] Yamakuchi M,Lowenstein C J.MiR-34,SIRT1 and p53:the feedback loop[J].Cell Cycle,2009,8(5):712-715.
[3] Rokhlin O W,Scheinker V S,Taghiyev A F,et al.Micro-RNA-34 mediates AR-dependent p53-induced apoptosis in prostate cancer[J].Cancer Biol Ther,2008,7(8):1288-1296.
[4] Paris R,Henry R E,Stephens S J,et al.Multiple p53-independent gene silencing mechanisms define the cellular response to p53 activation[J].Cell Cycle,2008,7(15):2427-2433.
[5] Raver Shapira N,Marciano E,Meiri E,et al.Transcriptional activation of miR-34a contributes to p53-mediated apoptosis[J].Mol Cell,2007,26(5):731-743.
[6] Hermeking H.p53 enters the microRNA world[J].Cancer Cell,2007,12(5):414-418.
[7] He L,He X,Lowe S W,et al.microRNAs join the p53 network-anotherpiece in the tumour-suppression puzzle[J].Nat Rev Cancer,2007,7(11):819-822.
[8] He L,He X,Lim L P,et al.A microRNA component of the p53 tumour suppressor network [J].Nature,2007,447(7148):1130-1134.
[9] Corney D C,FleskenNikitin A,Godwin A K,et al.Micro-RNA-34b and MicroRNA-34c are targets of p53 and cooperate in control of cell proliferation and adhesionindependent growth[J].Cancer Res,2007,67(18):8433–8438.
[10] Chang T C,Wentzel E A,Kent O A,et al.Transactivation of miR-34a by p53 broadly influences gene expression and promotes apoptosis[J].Mol Cell,2007,26(5):745-752.
[11] Yamakuchi M,Ferlito M,Lowenstein C J.miR-34a repression of SIRT1 regulates apoptosis[J].Proc Natl Acad Sci USA,2008,105(36):13421-13426.
[12] Tazawa H,Tsuchiya N,Izumiya M,et al.Tumorsuppressive miR-34a induces senescence-like growth arrest through modulation of the E2F pathway in human colon cancer cells[J].Proc Natl Acad Sci USA,2007,104(39):15472-15477.
[13] Vogt M,Munding J,Grüner M,et al.Frequent concomitant inactivation of miR-34a and miR-34b/c by CpG methylation in colorectal,pancreatic,mammary,ovarian,urothelial,and renal cell carcinomas and soft tissue sarcomas[J].Virchows Arch,2011,458:313-322.
[14] Lodygin D,Tarasov V,Epanchintsev A,et al.Inactivation of miR-34a by aberrant CpG methylation in multiple types of cancer[J].Cell Cycle,2008,7(16):2591-2600.
[15] Herman J G,Graff J R,Myohanen S,et al.Methylationspecific PCR:a novel PCR assay for methylation status of CpG islands[J].Proc Natl Acad Sci USA,1996,93(18):9821-9826.
[16] Tarasov V,Jung P,Verdoodt B,et al.Differential regulation of microRNAs by p53 revealed by massively parallel sequencing:miR-34a is a p53 target that induces apoptosis and G1-arrest[J].Cell Cycle,2007,6(13):1586-1593.
[17] Yan D,Zhou X,Chen X,et al.MicroRNA-34a inhibits uveal melanoma cell proliferation and migration through downregulation of c-Met[J].Invest Ophthalmol Vis Sci,2009,50(4):1559-1565.
[18] Laird P W.The power and the promise of DNA methylation markers[J].Nat Rev Cancer,2003,3(4):253-266.
[19] Wiggins J F,Ruffino L,Kelnar K,et al.Development of a lung cancer therapeutic based on the tumor suppressor MicroRNA-34[J].Cancer Res,2010,70(14):5923-5930.
