还原型谷胱甘肽对脐带间质干细胞生物学特性的影响
2013-08-22孙晓春吴乐乐陈巧林陆荣柱许文荣
孙晓春 孙 敏 谢 岩 吴乐乐 朱 伟 陈巧林 陆荣柱 许文荣
(江苏大学基础医学与医学技术学院,江苏 镇江 212013)
人脐带间充质干细胞(hUC-MSC)是一类具有自我更新、增殖和多向分化潜能的干细胞〔1~3〕,具有来源易得、易于分离培养、免疫原性较弱、无伦理学争议等诸多优点。还原型谷胱甘肽(GSH)广泛分布于人体各器官内,对维持细胞生物功能,保护细胞膜的完整性,对抗细胞衰老都有着重要作用〔4〕。因hUC-MSC在体外扩增时并非无限增殖,通常扩增7~10代左右就趋于老化而停止增殖,使得其实际应用中受到一定的限制。本研究拟通过一定浓度的GSH来促进hUC-MSC细胞增殖并对抗其衰老,从而使其在体外得以充分扩增以满足临床应用。
1 材料与方法
1.1 主要实验材料 胎牛血清、DMEN1(GIBCO),胰酶(SIGMA),PI(INVITROGEN),CD29PE、CD34FITC、CD44PE(BD)。
1.2 方法
1.2.1 hUC-MSC的分离培养 取新鲜无菌的脐带组织,先用PBS冲洗,冲去脐静脉及动脉内的残存血,剔除脐带组织内的血管,将剩余组织剪碎至1 mm3大小的组织块。组织块接种于含10%FBS的L-DMEM培养液(含青霉素105U/L,链霉素100 mg/L)2 ml的直径为3 cm的细胞培养皿中,放置于37℃、5%CO2、饱和湿度孵箱内培养。3 d后,首次换液,以后隔2 d换一次液,两周后剔除组织块。细胞长到80%融合时,用含0.1 mmol/L EDTA-Na2的0.25%胰酶室温消化,以1×105的细胞个数接种于传代培养瓶(T-25)中进行扩增培养。
1.2.2 GSH对hUC-MSC活性的影响 取第3代对数生长期的hUC-MSC,0.25%的胰酶消化后,用含10%FBS的DMEM营养液配成细胞悬液,接种每孔1×103个细胞于96孔板。每孔加入100μl营养液。置于37℃ 5%CO2培养箱中培养过夜后,换用含2%FBS的DMEM营养液继续培养24 h后,加入不同浓度的 GSH(用2%FBS的 DMEM营养液配制),设0.09、0.12、0.15、0.18、0.21 mg/ml等5 个浓度,每个浓度设 11 个复孔,同时设空白对照组。继续培养24 h后每孔加入20μl MTT。置37℃ 5%CO2培养箱培养4 h后,弃培养上清液,每孔加入150μl DMSO,振荡器振荡10 min后酶联免疫吸附试验检测仪上570 nm测吸光度值。
1.2.3 GSH对hUC-MSC增殖的影响 取对数生长期的hUCMSC,用0.25%的胰酶消化,计数离心,用含10%的 FBS的DMEM营养液配成细胞悬液,接种于2只24孔板内,每孔1 000个细胞。8 h后,其中一只24孔板换含2%FBS的DMEM营养液,另一只板加入含0.15 mg/ml GSH的2%FBS的DMEM营养液,于加药后的第2天开始计数复孔取均值并绘制生长曲线。并对细胞进行长期传代。
1.2.4 GSH对hUC-MSC细胞周期的影响 取对数生长期的细胞,用0.25%的胰酶消化后,用含10%FBS的DMEM营养液配成细胞悬液,接种于六孔板内,换用5%FBS的营养液继续培养48 h后,加入终浓度为0.15 mg/ml的GSH,再培养24 h后,收集细胞,设空白对照组,每管加入500μl PI,避光30 min,用滤网过滤成单个细胞悬液,上机检测。
1.2.5 GSH对hUC-MSC表面标志物的影响 取第3代的hUC-MSC,用0.25%的胰酶消化,平均分两瓶,一瓶加入10%FBS的DMEM营养液,另一瓶加入含0.15 mg/ml GSH的10%FBS的DMEM营养液。次日消化收集细胞,一瓶分四管,一管作对照,其余三管分别加入鼠抗人的 CD29PE、CD34FITC、CD44PE,冰上避光染色30 min,用滤网过滤成单个细胞悬液上流式细胞仪检测。
1.2.6 GSH对hUC-MSC成骨分化的影响 取对数生长期的hUC-MSC,用0.25%的胰酶消化,计数离心,用含10%的FBS的DMEM营养液配成细胞悬液,接种于24孔板内,每孔4 000个细胞。次日10只孔加入成骨诱导液(含终浓度地塞米松0.1 μmol/L、维生素 C 50 mg/L、β2磷酸甘油 10 mmol/L、bFGF 4 mg/L),再取10只孔加含0.15 mg/ml GSH的成骨诱导液,剩余4只孔做空白对照。诱导14 d后进行ALP染色。计算ALP阳性细胞百分率。
1.3 统计学方法 采用SPSS16.0统计学软件进行配对资料的t检验。
2 结果
2.1 GSH对hUC-MSC细胞活性的影响(MTT法检测) 加入不同浓度的GSH后,hUC-MSC的活性是不同的。0.09、0.12、0.15及0.18mg/ml GSH,hUC-MSC活性分别为:0.22、0.29、0.31、0.14、0.12,其中0.15 mg/ml吸光度均值最高,其后随着GSH浓度加大,细胞增殖逐步受抑。
2.2 GSH对hUC-MSC增殖的影响 细胞生长曲线显示,实验前4 d生长曲线无显著性差异,进入对数生长期后,GSH组要快于对照组,并提前到达平台期(图1)。对细胞传代结果显示,未加GSH组约可传代9~10代细胞老化较为严重,镜下颗粒化明显,增殖非常缓慢。而加入GSH组可传代12~13代后细胞老化较为严重。
2.3 GSH对hUC-MSC周期的影响 细胞周期结果显示GSH未处理组S期比例为(9.7±3.5)%,GSH处理组S期比例为(21.5±6.0)%,两组间存在显著性差异(P<0.01)。
2.4 GSH对hUC-MSC表面标志的影响 经流式细胞仪检测,与对照组相比加入GSH组hUC-MSC表面标志CD44、CD29阳性表达,CD34阴性表达,与对照组结果完全一致,提示GSH对hUC-MSC表面标志无明显影响。
2.5 GSH对hUC-MSC成骨分化的影响 成骨诱导结果显示,阴性对照组表达ALP阳性细胞率在1%左右,不加GSH成骨诱导后ALP阳性细胞表达率在45%,而GSH组的ALP阳性细胞表达率在46%,两者间无明显差异(P>0.05)。见图2。
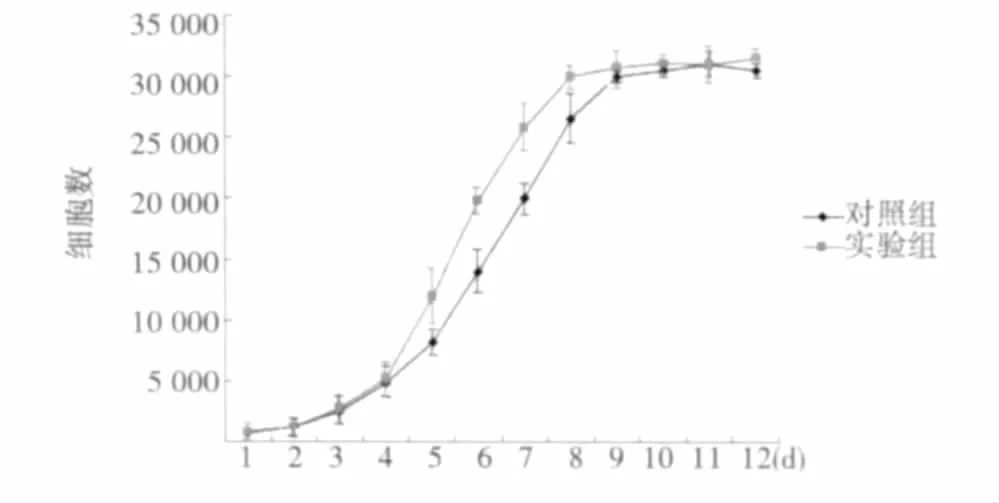
图1 GSH对hUC-MSC增殖的影响

图2 GSH对hUC-MSC成骨分化ALP染色的影响(×200)
3 讨论
人间质干细胞是目前干细胞研究的热点之一,可来自骨髓、脂肪组织、脐带等多种来源〔5~7〕,其在体外容易扩增培养,我们在多年的MSC研究过程中注意到一个关键性的实际问题,即人的MSC在体外培养时其扩增代数有限,分离培养几代后人的MSCs即趋于老化而停止增殖。GSH在体内具有较好的抗自由基抗氧化作用,可以延缓细胞衰老。细胞内外的GSH水平与细胞的生长速度有着一定的相关性,刘梅等〔8〕发现在一浓度范围内,GSH可促进肝细胞增殖;Schneildorfer等〔9〕报道生长迅速的肿瘤细胞对GSH的需求量显著增加。本研究发现在低于0.15 mg/ml GSH作用时,其可以促进hUC-MSC的增殖,并随浓度增加而促进作用增加,但如果浓度高于0.15mg/ml时,则随浓度增加对细胞增殖出现逐步抑制。
本研究应用0.15 mg/ml GSH处理hUC-MSC后细胞周期分析发现可以明显提高S期细胞比例,从细胞生长曲线也可发现其可以缩短细胞达到生长平台期的时间。传代结果也显示GSH对细胞培养传代代数可起到一定的延长作用。GSH促进hUC-MSC活性的机制目前尚不明确,低浓度时可能通过GSH的抗氧化作用,清除自由基,增强呼吸链酶复合体Ⅰ的活性,保护线粒体正常功能〔10〕从而促进hUC-MSC的增殖。
那么GSH在促进hUC-MSC增殖的前提下,是否会对MSC细胞的一些生物学特性带来改变呢?我们采用MSC表面阳性标志CD44、CD29与阴性标志CD34来观察应用GSH处理后的变化,发现GSH处理后对细胞的表面标志没有带来明显的改变。我们又进一步研究了GSH是否会对MSC的分化潜能带来改变,我们应用较成熟的成骨细胞诱导方案〔11〕,发现GSH处理前后,诱导后ALP阳性表达率无显著性差异。
综上所述,可以得知,在较低剂量的GSH除可促进细胞的增殖速度延缓老化时间外,对hUC-MSC的细胞表面分子特征无明显改变,对细胞分化的潜能也无明显影响。因此,采用GSH可以在一定程度上提高MSCs的增殖速度延长传代代数,可以应用于MSCs的体外细胞培养与扩增。
1 Can A,Karahuseyinoglu S.Concise review:human umbilical cord stroma with regard to the source of fetus-derived stem cells〔J〕.Stem Cells,2007;25(11):2886-95.
2 Tolar J,Hippen KL,Blazar BR.Immune regulatory cells in umbilical cord blood:T regulatory cells and mesenchymal stromal cells〔J〕.Br JHaematol,2009;147(2):200-6.
3 Fan CG,Zhang QJ,Zhou JR.Therapeutic potentials of mesenchymal stem cells derived from human umbilical cord〔J〕.Stem Cell Rev,2011;7(1):195-207.
4 胡圣尧,聂志妍,袁勤生.还原型谷胱甘肽的研究进展〔J〕.食品与药品,2009;11(1):69-76.
5 Ding DC,Shyu WC,Lin SZ.Mesenchymal stem cells〔J〕.Cell Transplant,2011;20(1):5-14.
6 Pittenger MF,Mackay AM,Jaiswal SC,et al.Multilineage potential of adult human mesenchymal stem cells〔J〕.Science,1999;284(5411):143-7.
7 Chamberlain G,Fox J,Ashton B,et al.Concise review:mesenchymal stem cells:their phenotype,differentiation capacity,immunological features,and potential for homing〔J〕.Stem Cells,2007;25(11):2739-49.
8 刘 梅,陆伦根,窦爱霞,等.还原型谷胱甘肽对人肝星状细胞增殖和氧应激及转化生长因子表达的影响〔J〕.中华消化杂志,2007;27(10):666-9.
9 Schneildorfer T,Gansauge S,Gansauge F,et al.Glutathione depletion causes cell growth inhibition and enhanced apoptosis in pancreatic cancer cells〔J〕.Cancer,2000;89(7):1440-7.
10 王恒会,罗蔚锋,包仕尧.还原型谷胱甘肽拮抗6-OHDA对骨髓基质细胞的毒性作用〔J〕.中国临床神经科学,2007;15(6):605-8.
11 孙晓春,许文荣,朱 伟,等.大鼠骨髓间质干细胞体外分化为成骨细胞的实验研究〔J〕.江苏大学学报(医学版),2004;14(5):369-74.
