利福平和异烟肼结核分枝杆菌药敏表型和基因型的关系
2013-08-17刘厚明陈建波肖颜玉吴驰叶飞娣蔡舒豪赵艳敏邓群益单万水
刘厚明 陈建波 肖颜玉 吴驰 叶飞娣 蔡舒豪 赵艳敏 邓群益 单万水
·论 著 ·
利福平和异烟肼结核分枝杆菌药敏表型和基因型的关系
刘厚明 陈建波 肖颜玉 吴驰 叶飞娣 蔡舒豪 赵艳敏 邓群益 单万水
目的 对利福平(RFP)和异烟肼(INH)进行药敏检测,分析相应的结核分枝杆菌药敏表型与基因型的关系。方法 对2009年至2012年深圳市第三人民医院结核病门诊和住院的137例结核病患者晨痰标本进行结核分枝杆菌培养,利用膜基因芯片法检测结核分枝杆菌耐药基因的突变情况(基因型检测),同时以绝对浓度法进行异烟肼和利福平药敏试验(表型检测),计算两种方法检测结果间的符合率,验证膜基因芯片方法的准确性,用Kappa检验分析两种方法的一致性。结果 137株结核分枝杆菌标本,表型检测利福平和异烟肼耐药率分别为27.01%(37/137)和22.63%(31/137);基因型检测利福平和异烟肼耐药率分别为26.28%(36/137)和23.36% (32/137);以绝对浓度法药敏结果为金标准,膜基因芯片检测利福平耐药的敏感度为83.78%(31/37),特异度为94.06%(95/101),符合率为91.97%(126/137),Kappa值为0.79,P<0.05;异烟肼耐药的敏感度为80.65% (25/31),特异度为94.29%(99/105),符合率为90.51%(124/137),Kappa值为0.73,P<0.05;两种药物药敏结果总符合率为91.24%(250/274)。结论 结核分枝杆菌耐药性基因型检测和表型检测结果高度一致,且基因型的检测方法能快速准确地检测结核分枝杆菌对利福平和异烟肼的耐药性,有望在临床治疗中广泛应用。
分枝杆菌,结核; 微生物敏感性试验; 利福平; 异烟肼; 表型; 基因型; 寡核苷酸序列分析
结核病为结核分枝杆菌侵入人体后引起的一种具有强传染性的慢性消耗性疾病。据 WHO统计,全世界有十几亿人口感染结核分枝杆菌,每年新发患者1000万例,并有将近200万例死亡,为传染病死亡例数的第一位,耐药菌株流行是结核病疫情日趋严重的主要原因[1-3]。目前用于结核分枝杆菌耐药性检测的方法大多时间较长,以培养为基础的绝对浓度法或比例法需要4周时间才能得到药敏结果[4],故结核病患者通常不能得到及时有效的治疗,导致耐多药结核病患者结核分枝杆菌的增殖和传播。因此,需要建立一种操作简便、快速的药物敏感试验方法,这对于控制耐多药结核病的传播具有重要意义。利用反向斑点杂交的原理建立膜基因芯片技术检测结核分枝杆菌耐利福平和异烟肼药物基因,该方法2 d就能出结果,但其与传统药敏方法的准确性比较少有报道。本研究以绝对浓度法药敏结果为金标准,评价膜基因芯片检测结果与绝对浓度法药敏实验结果的符合率,并探讨该方法在临床诊断中的应用前景。
材料和方法
1.标本来源:2009年至2012年6月深圳市第三人民医院结核病门诊和住院结核病患者137例,其中男81例,女56例,年龄介于2~82岁之间,中位年龄为40岁,留取2份晨痰标本,分别做结核分枝杆菌培养,异烟肼和利福平药敏试验及结核分枝杆菌耐药基因检测。所有患者诊断均依据2006年版《临床诊疗指南结核病分册》的诊断标准确诊[5],经晨痰结核分枝杆菌培养阳性的结核病患者。
2.试剂和仪器:分枝杆菌药敏试验罗氏培养管购自珠海贝索生物技术有限公司:利福平药物低、高浓度分别为50μg/L、250μg/L,异烟肼药物低、高浓度分别为1μg/L、10μg/L。结核分枝杆菌耐药基因检测试剂盒购自亚能生物技术(深圳)有限公司,采用ABI7500实时荧光PCR扩增仪(美国ABI公司),TY-80R脱色摇床(上海比朗仪器有限公司),FYY-3型分子杂交仪杂交(兴化市分析仪器厂)。
3.结核分枝杆菌利福平和异烟肼药敏试验:每份菌液配置成1mg/ml的菌液,10倍稀释至10-2mg/ml,混匀后吸取菌液0.1 ml,均匀接种于每种药物的高、低浓度2只培养基上,同时接种不含药的培养基0.1 ml为生长对照,以空白培养基作为空白对照,结核分枝杆菌标准株H37Rv为质控株(本室保存),每周观察1次,至少4周报告结果。以对照管生长结核分枝杆菌,空白管无生长,质控株“结果在控”。说明实验有效,高、低浓度的两份培养基斜面同时生长结核分枝杆菌菌落为耐药;低浓度培养基生长而高浓度培养基未生长结核分枝杆菌菌落为中介;高、低浓度的培养基均未生长结核分枝杆菌菌落为敏感。
4.膜基因芯片法检测耐药基因突变:结核分枝杆菌耐药突变基因检测试剂盒购自亚能生物技术(深圳)有限公司,操作严格按说明书进行。检测rpoB基因野生型和突变型位点511、513、516、522、523、526、529、531和533,检测katG基因野生型和突变型位点315,检测inhA基因野生型和突变型位点-15。从临床样本或纯培养物中提取结核分枝杆菌基因组DNA,取出PCR反应液Ⅰ和PCR反应液Ⅱ各一管,在管壁上做好标记,用相对离心力400×g离心2 s后加入4μl DNA样品上清液作为PCR扩增模板,相对离心力400×g离心2 s。每次实验同时设置测序分析已知突变株(实验室保存)作为阳性对照,以蒸馏水作为阴性对照。扩增程序:50℃预变性2 min,95℃变性10 min;95℃45 s,68℃1 min,30个循环;95℃30 s,54℃30 s,68℃1 min,30个循环;最后68℃5 min延伸。扩增完成后杂交按操作说明书进行。
5.对利福平敏感但杂交突变的5株结核分枝杆菌的测序结果:在传统方法利福平敏感的100株结核分枝杆菌菌株中,膜芯片杂交法有5株检出有突变,将此5株菌送至华大(深圳)基因研究院对rpoB基因进行测序分析。
6.统计学分析:应用SPSS 13.0统计软件进行统计分析,以绝对浓度法结果为金标准,计算两种方法的符合率。用χ2检验分析绝对浓度法药敏结果和膜基因芯片杂交检测利福平和异烟肼基因位点的结果的差异性,P>0.05提示两种方法检测结果差异没有统计学意义。用Kappa检验分析两种方法的一致性,即1≥Kappa≥0.75时提示高度一致性,0.75>Kappa≥0.4时提示中度一致性,Kappa<0.4时提示低度一致性。对Kappa值进行U检验,P<0.05提示可认为两种方法检测结果具有一致性。
结 果
1.结核分枝杆菌绝对浓度法检测结果:为方便与膜基因芯片检测结果比较,本研究药敏试验结果将中介归纳为耐药进行统计,利福平耐药率为27.01% (37/137),异烟肼耐药率为22.63%(31/137)。
2.结核分枝杆菌膜基因芯片检测结果:利福平耐药(突变型)率为26.28%(36/137),有21株531位点突变,8株526位点突变,6株516位点突变,还有1株511和513位点的缺失。异烟肼耐药率(突变型)为23.36%(32/137),23株315位点突变,有8株-15位点突变,还有1株inh A基因位点缺失。
3.绝对浓度法药敏试验与膜基因芯片杂交检测的结果比较:经χ2检验,利福平和异烟肼P值均是1,提示两种方法检验此两种药物结果的差异无统计学意义。以绝对浓度法结果为金标准,膜基因芯片杂交检测利福平耐药的敏感度为83.78% (31/37),特异度为94.06%(95/101),符合率为91.97%(126/137);膜基因芯片杂交检测异烟肼耐药的敏感度为80.65%(25/31),特异度为94.29% (99/105),符合率为90.51%(124/137);两种药物的总符合率为91.24%(250/274)。具体见表1、2。
利福平一致性检验Kappa值为0.79,>0.75,P2<0.05,可认为两种方法具有高度一致性;异烟肼的一致性检验Kappa值为0.73,结果<0.75而>0.4,P2<0.05,可认为两种方法具有中度一致性。
4.对利福平敏感但杂交突变的5株结核分枝杆菌的测序结果:经测序证实对利福平敏感但杂交突变的5株结核分枝杆菌rpoB基因都有突变(图1)。
讨 论
国内外学者对抗结核药物的作用位点及 Mtb耐药机制,尤其对利福平和异烟肼等一些常用的抗结核一线药物的耐药机制已经有了较深入的了解,认为 Mtb耐药性的发生与耐药相关基因突变有关[6-9]。近来研究发现,耐药性的产生与rpoB基因的突变有关。突变使编码RNA聚合酶β亚单位少数高度保守的氨基酸置换,空间构象发生变化,阻止了与利福平的结合,从而产生耐药[6]。对结核分枝杆菌耐异烟肼分子机制的研究发现与katG和inh A基因突变有关。katG基因编码结核分枝杆菌过氧化氢-过氧化物酶,若katG基因发生突变,有可能导致异烟肼活化效率降低或不能活化,从而引起结核分枝 杆菌 对异 烟肼 产 生不 同程 度的 耐药 性[7]。inh A基因编码脂肪酸转运蛋白(NADH依赖的enoyl-ACP还原酶),是分枝菌酸细胞壁合成的必需成分,活化的异烟肼结合到NADH上抑制了依赖NADH酶的活性,抑制了分枝菌酸的合成而导致了细胞的死亡。inh A基因的突变修改了该酶,使它失去和NADH的亲和力,导致异烟肼耐药[8-9]。因此,这些区域是利福平和异烟肼耐药株分子检测的主要靶位[10-12]。
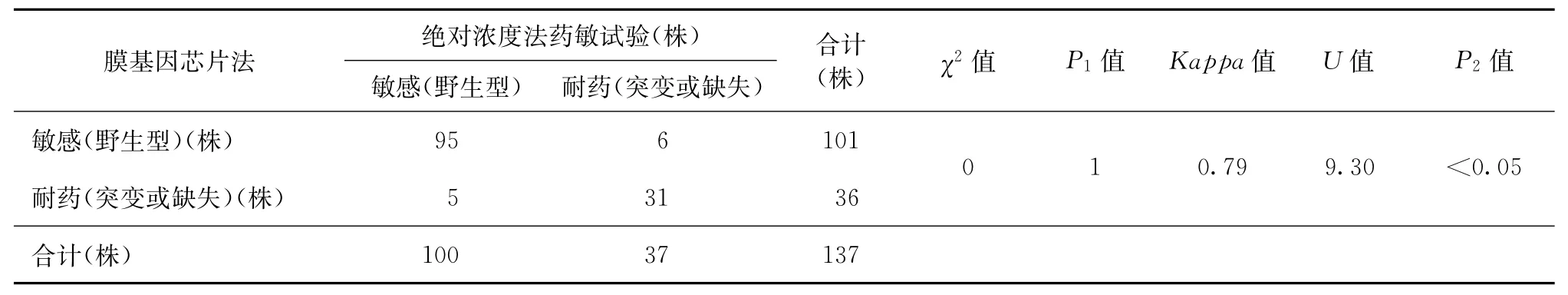
表1 膜基因芯片法与绝对浓度法药敏试验检测利福平耐药结果的对比分析
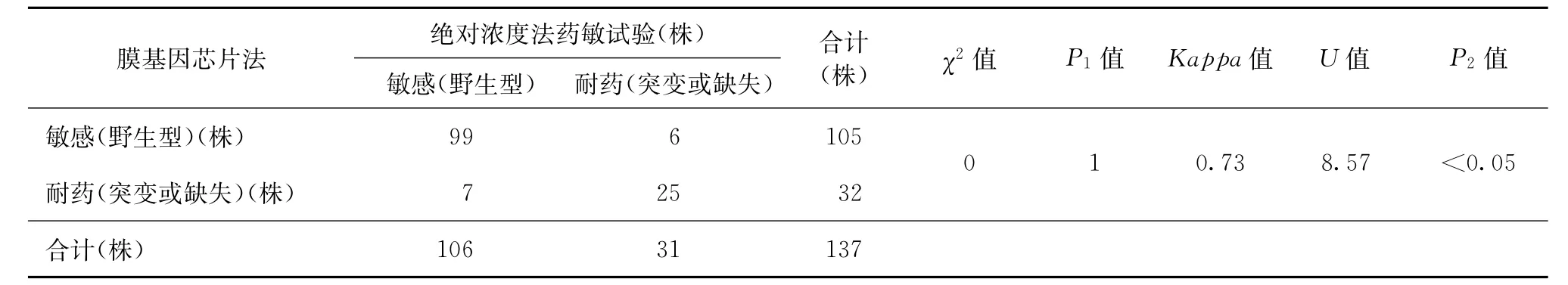
表2 膜基因芯片法与绝对浓度法药敏试验检测异烟肼耐药结果的对比分析
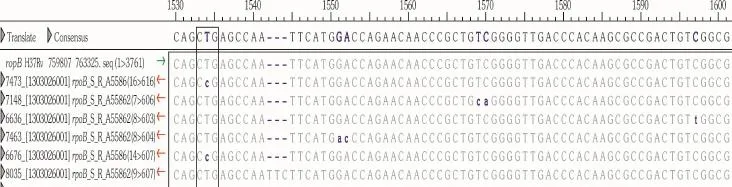
图1 对利福平敏感但杂交突变的5株结核分枝杆菌测序图
本研究结果表明利福平膜芯片检测结果与金标准的绝对浓度法的药敏检测结果差异无统计学意义;用Kappa检验分析两种方法的一致性,利福平一致性试验Kappa值为0.79,>0.75,P2<0.05,显示2种方法具有高度一致性。本研究耐药株rpoB基因突变检出率为83.78%(31/37),略低于文献报道约90%耐药株有rpoB基因的突变[13-14],可能因rpoB基因突变在位点检测之外引起。本研究36株结核分枝杆菌膜芯片杂交法都耐药的菌株中,有21株531位突变,8株526位突变,6株516位突变,还有1株511和513位点的缺失。突变序位频率531>526>516与Lee等[13]报道相同,但与Sajduda等[15]报道的531>516>526略有差异,突变序位差异可能与研究的标本数少有关,也可能存在地区差异。值得注意的是在传统方法利福平敏感的100株菌株中,膜芯片杂交法有5株检出有突变,经测序证实5株菌rpoB基因都有突变(图1),可能此5株突变基因不表达而致传统药敏敏感。在膜芯片法利福平敏感的101株菌株中,传统方法有6例耐药,可能是因为膜芯片法只包含高频的耐药探针基因,不包含临床上突变频率较低的耐药突变探针有关;或测定其 MIC值,有可能是一种低度耐药表型,通过上述途径,可以缩小两种方法间的差异。
本研究对异烟肼耐药性的检测结果也显示,膜芯片检测结果与金标准的绝对浓度法的药敏检测差异无统计学意义;用Kappa检验分析两种方法的一致性,异烟肼的一致性试验Kappa值为0.73,结果<0.75但>0.4,P2<0.05,可认为两种方法具有中度一致性。异烟肼耐药株katG基因315位点突变率为71.88%(23/32),inh A基因-15位点突变率为25.0%(8/32),还有1株inh A基因位点缺失。目前明确的结核分枝杆菌突变耐药基因有几十个位点之多,本方法选取耐药频率较高的11处基因位点检测。因只检测11个上述2种药突变耐药基因位点,没有检测到突变耐药基因位点并不表明没有11个位点之外的突变耐药基因。这也可能是2种方法检测结果不一致的原因。
膜基因芯片法对利福平和异烟肼检测的结果与绝对浓度法结果对比,符合率分别为91.97% (126/137)和90.51%(124/137),总符合率为91.24%(250/274),提示与绝对浓度法药敏为金标准的结果差异不大,与文献报道基本一致[16]。本研究采用反向点杂交膜基因芯片检测技术是一种建立于PCR基础上的反向点杂交方法。其原理是应用生物素修饰的特异引物扩增DNA,使PCR产物带有生物素标记,将PCR产物变性后与固定在膜上的特异寡核苷酸探针杂交,通过观察斑点杂交信号强弱判断结果。其探针数目多,可以同时检测到2种药物耐药基因型,分析rpoB基因、katG基因和inh A基因,能检出2种药物的绝大部分耐药突变株,检测时间仅需1 d,检测结果与传统药敏方法高度一致,具有快速、准确和特异的特点,且在时效性方面大大优于绝对浓度法药敏,显示了膜基因芯片法在临床耐药结核病的诊疗中有广阔的应用前景。但绝对浓度法药敏方法在目前仍无法完全被取代,两者结合使用将为临床治疗工作提供可靠的保证。
[1]Yu CC,Chang CY,Liu CE,et al.Drug resistance pattern of Mycobacterium tuberculosis complex at a medical center in central Taiwan,2003-2007.J Microbiol Immunol Infect,2010,43 (4):285-290.
[2]Gavín P,Iglesias MJ,Jiménez MS,et al.Multidrug-resistant Mycobacterium tuberculosis strain from Equatorial Guinea detected in Spain.Emerg Infect Dis,2009,15(11):1858-1860.
[3]Gumbo T.New susceptibility breakpoints for first-line antituberculosis drugs based on antimicrobial pharmacokinetic/pharmacodynamic science and population pharmacokinetic variability.Antimicrob Agents Chemother,2010,54(4):1484-1491.
[4]叶应妩,王毓三,申子瑜.全国临床检验操作规程.3版.南京:东南大学出版社,2006.
[5]中华医学会.临床诊疗指南结核病分册.北京:人民卫生出版社,2006.
[6]Kim BJ,Lee KH,Yun YJ,et al.Simultaneous identification of rifampin-resistant Mycobacterium tuberculosis and nontuberculous mycobacteria by polymerase chain reaction-single strand conformation polymorphism and sequence analysis of the RNA polymerase gene(rpoB).J Microbiol Methods,2004,58(1):111-118.
[7]Cade CE,Dlouhy AC,Medzihradszky KF,et al.Isoniazid-resistance conferring mutations in Mycobacterium tuberculosis KatG:catalase,peroxidase,and INH-NADH adduct formation activities.Protein Sci,2010,19(3):458-474.
[8]Luckner SR,Liu N,am Ende CW,et al.A slow,tight binding inhibitor of InhA,the enoyl-acyl carrier protein reductase from Mycobacterium tuberculosis.JBiol Chem,2010,285(19):14330-14337.
[9]Dessen A,Quémard A,Blanchard JS,et al.Crystal structure and function of the isoniazid target of Mycobacterium tuberculosis.Science,1995,267(5204):1638-1641.
[10]Drobniewski FA,Watterson SA,Wilson SM,et al.A clinical,microbiological and economic analysis of a national service for the rapid molecular diagnosis of tuberculosis and rifampicin resistance in Mycobacterium tuberculosis.J Med Microbiol,2000,49(3):271-278.
[11]Chaoui I,Sabouni R,Kourout M,et al.Analysis of isoniazid,streptomycin and ethambutol resistance in Mycobacterium tuberculosis isolates from Morocco.J Infect Dev Ctries,2009,3(4):278-284.
[12]Banerjee A,Dubnau E,Quemard A,et al.inh A,a gene encoding a target for isoniazid and ethionamidein Mycobacterium tuberculosis.Science,1994,263(5144):227-230.
[13]Lee AS,Lim IH,Tang LL,et al.High frequency of mutations in the rpoB gene in rifampin-resistant clinical isolates of Myco-bacterium tuberculosis from Singapore.J Clin Microbiol,2005,43(4):2026-2027.
[14]黄海荣,马玙,陈曦,等.中国耐利福平结核分枝杆菌rpoB基因突变特点.中华结核和呼吸杂志,2001,24(4):231-235.
[15]Sajduda A,Brzostek A,Poplawska M,et al.Molecular characterization of rifampin-and isoniazid-resistant Mycobacterium tuberculosis strains isolated in Poland.J Clin Microbiol,2004, 42(6):2425-2431.
[16]周杨,欧喜超,乐军,等.基因芯片诊断耐多药结核病的临床多中心研究.中华检验医学杂志,2011,34(9):793-799.
The relationship of drug susceptibility phenotype and genotype of Mycobacterium tuberculosis for rifampin and isoniozid
LIU Hou-ming,CHEN Jian-bo,XIAO Yan-yu,WU Chi,YE Fei-di,CAI Shu-hao,ZHAO Yan-min,DENG Qun-yi,SHAN Wan-shui. Laboratory of Shenzhen Third People’s Hospital,Affiliated of Guangdong Medical College,Shenzhen 518112,China
LIH Hou-ming,Email:eric120@126.com
Objective Analysis drug susceptibility phenotype and genotype of Mycobacterium tuberculosis (Mtb)to rifampin(RFP)and isoniozid(INH).Methods One hundred and thirty-seven morning sputum specimens were cultured for Mycobacterium tuberculosis at Shenzhen Third People’s Hospital from 2009 to 2012,Use membrane gene chip test technology to detect the mutation type of RFP and INH resistance gene,absolute concentration drug susceptibility test were performed at the same time,calculate the coincidence rate between membrane gene chip test results and the absolute concentration drug susceptibility test,to verify the accuracy of the membrane gene chip method.Results The ratio of phenotype drug-resistant for RFP and INH were 27.01(37/137)and 22.63% (31/137),the ratio of genotype drug-resistant for RFPand INH were 26.28(36/137)and 23.36%(32/137).Compared with the gold standard of absolute concentration drug susceptibility test,the membrane gene chip method for RFP displayed the sensitivity 83.78%(31/37),specificity 94.06%(95/101),concordance 91.97%(126/137),the value of Kappa was 0.79,P<0.05;INH displayed the sensitivity 80.65%(25/31),specificity 94.29%(99/105),concordance 90.51%(124/137),the value of Kappa was 0.73,P<0.05;the total concordances were 91.24% (250/274)for the two drugs.Conclusion The membrane gene chip susceptibility results and absolute concentration method susceptibility results are highly consistent,which is adapted for extensive application in clinical treatment,as it allows fast and accuracy detection of the resistance to RFP and INH in Mtb clinical isolates.
Mycobacterium tuberculosis; Microbial sensitivity tests; Rifampin; Isoniazid; Phenotype;Genotype; Oligonucleotide array sequence analysis
2012-10-23)
(本文编辑:张晓进)
518112广东医学院附属深圳市第三人民医院检验科(刘厚明、陈建波、肖颜玉、吴驰、叶飞娣、蔡舒豪、单万水);结核病重点专科(邓群益);深圳华大基因研究院(赵艳敏)
刘厚明,Email:eric120@126.com
