两种TiO2纳米颗粒的结构表征及其血液相容性研究
2013-08-14郑建辉张炫辉李国琴陈晓萍李国华
郑建辉,张炫辉,李国琴,邓 悦,陈晓萍,李国华
(1.浙江工业大学生物与环境工程学院,浙江 杭州310014;2.浙江工业大学化学工程与材料学院,浙江 杭州310014)
生物材料的血液相容性标准于20世纪60年代首先由美国国立卫生研究院建立,主要用于评价生物材料植入体内后血液成分对其的适应性[1]。血液相容性评价包括溶血和凝血性质两方面[2]。溶血是指红细胞溶解、血红蛋白释放的现象,而凝血是指血浆凝固的过程,涉及到多种血浆成分、血小板、血管内皮细胞。当一种生物材料与血液接触时,其表面的理化性质以及形貌特征是影响血液相容性的主要因素[3-5]。
TiO2纳米颗粒具有独特的物理、化学与生物特性,在化妆品、食品、医药领域有着潜在的广泛应用前景。因此,近年来其生物相容性受到越来越多的关注。血液是机体的运输系统,血液相容性是生物相容性评价的重要环节,根据文献报道,TiO2纳米颗粒可引起血细胞沉积、血液凝集以及红细胞溶血[6],这种血液特性与 TiO2纳米颗粒的表面特征有关[7,8]。
作者在此对自制金红石TiO2纳米颗粒与市售P25TiO2纳米颗粒进行结构表征,然后采用两种常规的血液相容性研究方法——红细胞溶血实验与血浆复钙时间(PRT)测定,分析比较了这两种TiO2纳米颗粒的血液相容性特点。
1 实验
1.1 试剂与仪器
四氯化钛(98.0%),上海美星化工试剂有限公司;P25TiO2纳米颗粒,德国Degussa公司;新鲜绵羊抗凝血,金华利民检验试剂经营部。
X′Pert PRO型 X-射线衍射仪,荷兰PANalytical公司;Tecnai G2F30S-Twin型300kV高分辨透射电镜,荷兰Philips-FEI公司;UV1000型紫外可见分光光度计,上海天美科学仪器有限公司。
1.2 金红石TiO2纳米颗粒的制备
利用自有专利技术(ZL200410084338.6)采用水凝胶方法制备金红石TiO2纳米颗粒,具体过程如下:首先于0~10℃将100mL四氯化钛液体缓慢滴入200mL去离子水中,充分搅拌混匀后形成浅黄绿色溶胶;溶胶在室温下放置老化24~48h后,取50mL溶胶放入三角烧瓶,在0~40℃下滴加去离子水,充分搅拌形成无色透明溶液;所得溶液于40℃继续搅拌0.5~1h,升温至60℃维持0.5~1h,最后将体系升温至95℃,搅拌回流2h后静置沉淀;过滤,沉淀物经去离子水洗涤、80℃干燥,即得金红石TiO2纳米颗粒。
1.3 纳米材料的结构表征
X-射线衍射测试采用 Cuκα 射线(λ=0.1541 nm),电压40kV,电流40mA,步长0.033°,范围20°~75°;HRTEM微结构表征采用高分辨透射电镜。在进行HRTEM测试之前,将样品超声分散在无水乙醇中,吸取上清液滴至Cu网,干燥。
1.4 血浆复钙时间的测定
血浆复钙时间的测定参照文献[9,10]。具体步骤如下:(1)取10mL新鲜绵羊抗凝血,以3000r·min-1离心20min,小心吸取上清液,即为乏血小板血浆(Platelet-poor plasma,PPP);(2)以生理盐水将金红石与P25TiO2纳米颗粒配成20mg·mL-1的悬液,超声分散1h,121℃ 灭菌30min得纳米储备液;(3)以生理盐水将金红石和P25纳米储备液配成0mg·mL-1、1mg·mL-1、2mg·mL-1、3mg·mL-1、4mg·mL-1、5mg·mL-1、6mg·mL-1的溶液,超声分散1h,得纳米悬浮液;(4)将纳米悬浮液以2500r·min-1离心10min,吸取上清液,得纳米浸出液;(5)取2.5cm×7.5cm洁净载玻片,加入100μL PPP、100 μL纳米悬浮液或浸出液、100μL 0.025mol·mL-1CaCl2溶液,混匀,37℃孵育,立即计时,每隔30s以不锈钢注射器针头挑动混合液,当针头上出现纤维沉淀时停止计时,即为血浆复钙时间。
1.5 红细胞溶血实验
通过检测静态条件下红细胞中血红蛋白的释放评价红细胞溶血程度[11]。具体步骤如下:(1)取新鲜绵羊抗凝血6mL置于10mL离心管中,以2500r·min-1离心10min,弃上清液。沉淀的红细胞用生理盐水反复洗涤2~3次,至离心后上清液无色。将所得的红细胞用生理盐水配成2%的红细胞悬液,现配现用,使用时摇匀;(2)将金红石与P25纳米储备液以生理盐水配成0mg·mL-1、0.4mg·mL-1、0.8mg·mL-1、1mg·mL-1、2mg·mL-1、3mg·mL-1、4mg·mL-1的纳米使用液,取2mL纳米使用液,加入2mL红细胞悬液,混匀后成为溶血测试液;(3)溶血测试液分别进行紫外激发和无紫外激发两种处理。紫外激发组溶血测试液先用波长280nm的紫外灯照射2h,然后放入37℃的电热恒温水浴锅中孵育4h。无紫外激发组溶血测试液先于室温下静置2h,再和紫外激发组一起于37℃孵育4h。孵育后的溶液以2500r·min-1离心10min,小心吸取上清液,用紫外可见分光光度计测定545nm波长下的吸光度,测定时用生理盐水调零,以去离子水加等量红细胞悬液作为阳性对照;(4)溶血率计算公式:溶血率=(样品管OD值/阳性对照管OD值)×100%。
1.6 统计学处理
定量测定中每个样本重复测定5次,实验数据以(均数±标准误差)表示,t-Student方法进行显著性检验,以P<0.05为显著性差异、P<0.01为非常显著性差异。
2 结果与讨论
2.1 金红石与P25TiO2纳米颗粒的XRD分析(图1)
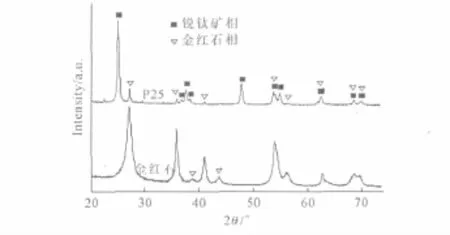
图1 金红石和P25TiO2纳米颗粒的XRD图谱Fig.1 XRD Patterns of rutile and P25TiO2nanoparticles
从图1可以看出,金红石TiO2纳米颗粒在衍射角2θ=27.446°、d=0.3247nm处出现最明显的衍射峰,其次分别在2θ=36.085°、d=0.2487nm 和2θ=54.322°、d=0.1687nm 处出现较明显的衍射峰,分别属于金红石相的(101)、(110)、(211)晶面(PDF#21-1276)。表明所制备的纳米TiO2晶型为纯金红石相。P25TiO2纳米颗粒在2θ=25.281°、d=0.352nm(PDF#21-1272)和2θ=27.446°、d=0.3247nm处有较明显的衍射峰,但锐钛矿相的衍射峰峰面积比金红石相的大,证实其组成为80%~75%锐钛矿相和20%~25%金红石相。
2.2 金红石与P25TiO2纳米颗粒的HRTEM分析
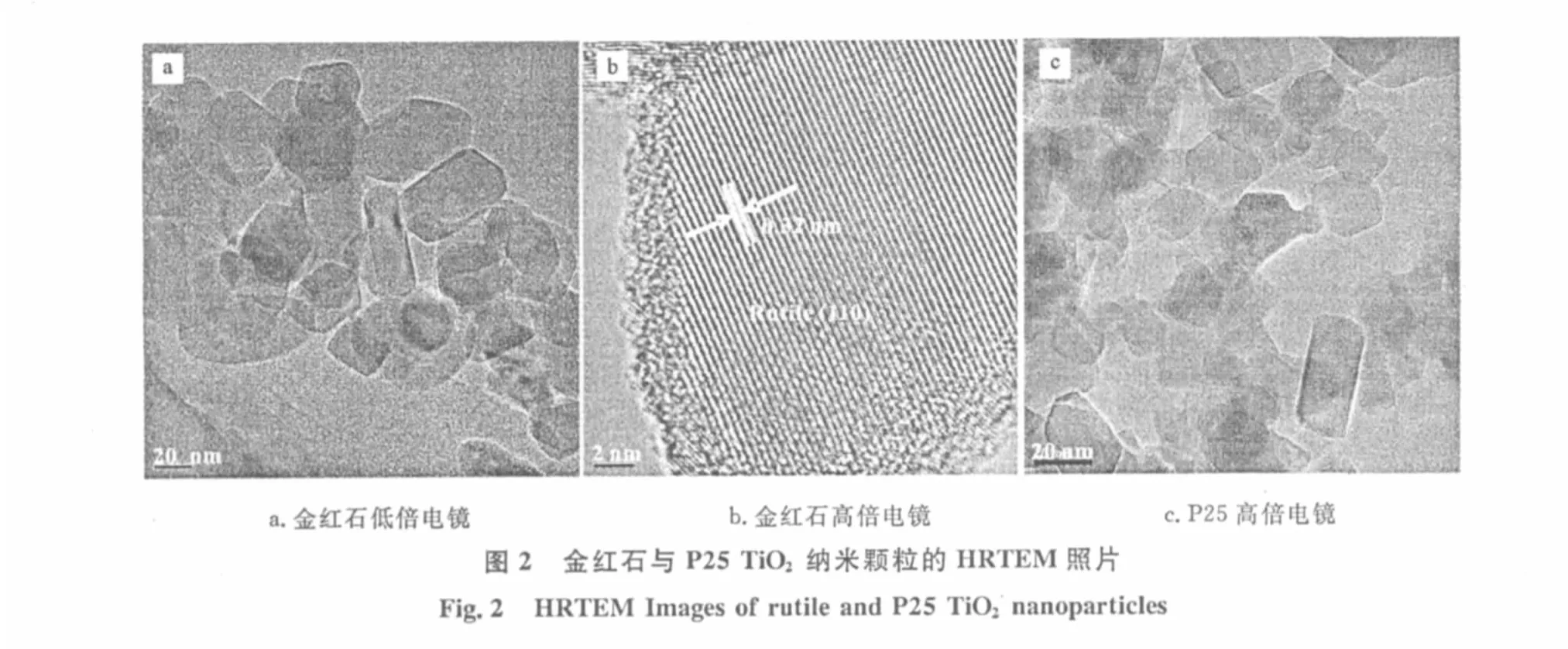
图2为两种TiO2纳米颗粒的高分辨透射电镜(HRTEM)照片。
从图2a、b可以看出,金红石TiO2纳米颗粒呈多面体形状,粒径20~60nm,其晶格条纹清晰,相邻的晶格间距为0.32nm,与金红石相的主晶面(101)(0.3247nm,PDF#077-0441)接近。从图2c可以看出,P25TiO2纳米颗粒也呈多面体形状,粒径15~50 nm,与金红石TiO2纳米颗粒相近,但P25的晶形不如金红石规整,粒径分布较广,这可能是由于晶体的多面体畸变程度以及相互连接方式不同所致。
2.3 金红石与P25TiO2纳米颗粒对血浆凝集的影响
金红石与P25TiO2纳米颗粒对血浆复钙时间的影响见图3。

从图3可以看出,在0.4~4.0mg·mL-1范围内,无论是采用悬浮液还是浸出液,两种TiO2纳米颗粒都没有引起血浆复钙时间的改变,相互之间也没有显著的差异(P>0.05)。表明金红石与P25TiO2纳米颗粒对血浆凝集无明显影响。
2.4 金红石与P25TiO2纳米颗粒对红细胞溶血活性的影响
金红石与P25两种TiO2纳米颗粒对红细胞溶血活性的影响如图4所示。

图4 金红石(a)和P25(b)TiO2纳米颗粒对红细胞溶血活性的影响Fig.4 Effects of rutile(a)and P25(b)TiO2nanoparticles on hemolytic activity
从图4可以看出,在低剂量(≤0.8mg·mL-1)作用下,两种TiO2纳米颗粒对红细胞溶血率无明显影响(P>0.05);当作用剂量为1.0~4.0mg·mL-1时,如不经紫外线激发,金红石与P25TiO2纳米颗粒对红细胞溶血活性仍无明显影响,但经紫外线处理后的TiO2纳米颗粒引起了轻度的红细胞溶血。
2.5 讨论
关于TiO2纳米颗粒的血液相容性近年来受到了许多关注,多数文献认为,纳米TiO2是生物安全度高的生物材料,如使用超疏水TiO2纳米管进行体外实验未引起明显的溶血现象[11];陈效等[12]用 TiO2纳米溶胶进行体外实验也未引起溶血现象,通过尾静脉注射TiO2纳米颗粒到小鼠体内,凝血时间无明显改变;但Li等[6]在以TiO2纳米颗粒与红细胞共孵育后,发现纳米颗粒引起红细胞聚集与沉淀,并出现轻度溶血。
TiO2纳米颗粒的表面特性会影响其血液相容性,如覆盖于抛光Ti表面的网络状TiO2纳米颗粒诱导血小板聚集与活化[8],表面包覆TiO2的镍钛合金导致血液凝集能力降低[13],掺Gd3+的无定形TiO2纳米颗粒具有较高的生物相容性[14],掺磷的金红石TiO2晶体的血液相容性得到改善[15],掺磷纳米TiO2薄膜的血液相容性也发生了改变[16]。
本研究用TiCl4制备的金红石TiO2纳米颗粒与P25TiO2纳米颗粒粒径相近,但纯度、晶体规整性与粒径均匀度不同。从红细胞溶血和凝血实验来看,两种纳米颗粒仅在高浓度作用同时伴有紫外激活条件下才会引起溶血率轻度升高,对血浆复钙时间没有明显的影响。由于纳米材料的生物相容性涉及敏感的生态安全性问题,对这种轻微溶血现象仍需加以进一步的关注。
3 结论
不同TiO2纳米颗粒的血液相容性具有差别。采用高分辨透射电镜和X-射线衍射仪对自制金红石TiO2纳米颗粒和市售P25TiO2纳米颗粒进行结构表征,并研究了这两种纳米颗粒对红细胞溶血活性与血浆复钙时间的影响。结果表明,两种TiO2纳米颗粒都具有很好的血液相容性,在一定剂量范围内不引起红细胞溶血和凝血现象,但金红石与P25TiO2纳米颗粒在浓度大于1.0mg·mL-1的高剂量下伴以紫外线激发后可造成轻微的溶血现象。这种轻微溶血现象需引起纳米材料生物相容性评价的关注。
[1]Ranucci M,Cirri S,Conti D,et al.Beneficial effects of DurafloⅡheparin-coated circuits on postperfusion lung dysfunction[J].Ann Thorac Surg,1996,61(1):76-81.
[2]郝和平.医疗器械生物学评价标准实施指南[M].北京:中国标准出版社,2000:81-100.
[3]Clarotti G,Schue F,Sledz J,et al.Modification of the biocompatible and haemocompatible properties of polymer substrates by plasma-deposited fluorocarbon coatings[J].Biomaterials,1992,13(12):832-840.
[4]Warheit D B,Webb T R,Reed K L,et al.Pulmonary toxicity study in rats with three forms of ultrafine-TiO2particles:Differential responses related to surface properties[J].Toxicology,2007,230(1):90-104.
[5]Liu Q,Cheng X N,Fei H X.Effects of micro-magnetic field at the surface of 316Land NiTi alloy on blood compatibility[J].Med Biol Eng Comput,2011,49(3):359-364.
[6]Li S Q,Zhu R R,Zhu H,et al.Nanotoxicity of TiO2nanoparticles to erythrocyte in vitro[J].Food Chem Toxicol,2008,46(12):3626-3631.
[7]Takemoto S,Yamamoto T,Tsuru K,et al.Platelet adhesion on titanium oxide gels:Effect of surface oxidation[J].Biomaterials,2004,25(17):3485-3492.
[8]Huang H H,Chen J Y,Lin M C,et al.Blood responses to titanium surface with TiO2nano-mesh structure[J].Clin Oral Implants Res,2012,23(3):379-383.
[9]Kang I K,Kwon O H,Kim M K,et al.In vitro blood compatibility of functional group-grafted and heparin-immobilized polyurethanes prepared by plasma glow discharge[J].Biomaterials,1997,18(16):1099-1107.
[10]Dash B C,Rethore G,Monaghan M,et al.The influence of size and charge of chitosan/polyglutamic acid hollow spheres on cellular internalization,viability and blood compatibility[J].Biomaterials,2010,31(32):8188-8197.
[11]Yang Y,Lai Y,Zhang Q,et al.A novel electrochemical strategy for improving blood compatibility of titanium-based biomaterials[J].Colloids Surf B Biointerfaces,2010,79(1):309-313.
[12]陈效,冯凌云,彭仁,等.羟基磷灰石和二氧化钛纳米粒子溶胶的血液相容性[J].卫生研究,2002,31(3):197-199.
[13]高淑春,翟玉春,胡金玲.TiO2覆膜Ni-Ti形状记忆合金生物材料的血液相容性研究[J].生物医学工程学杂志,2011,28(5):968-971.
[14]Chandran P,Sasidharan A,Ashokan A,et al.Highly biocompatible TiO2:Gd3+nano-contrast agent with enhanced longitudinal relaxivity for targeted cancer imaging[J].Nanoscale,2011,3(10):4150-4161.
[15]Maitz M F,Pham M T,Ieser E G W.Blood compatibility of titanium oxides with various crystal structure and element doping[J].J Biomater Appl,2003,17(4):303-318.
[16]Wang J B,Yang P,Su H B,et al.Structure differences between TiO2and phosphorus implanted TiO2films caused by thermal treatment[J].Surf Coat Technol,2011,206(5):1024-1028.
