培养条件及培养基组分对粘质沙雷氏菌生长及产D-乳酸的影响
2013-08-14满永博范季瀛沈亚领华东理工大学生物反应器工程国家重点实验室鲁华生物技术研究所上海200237
满永博,范季瀛,苏 刚,饶 犇,沈亚领(华东理工大学 生物反应器工程国家重点实验室 鲁华生物技术研究所,上海200237)
乳酸[1-4]是一种重要的有机酸,是合成多种物质的基础原料,同L-乳酸相比,D-乳酸的经济价值更大,除应用在医药、日化和化学工业外,其更重要的应用价值体现在可以改良聚乳酸特性[5],提升其熔点并延长降解时间。高光学纯度D-乳酸市场需求量大且价格昂贵,有良好的经济效益。
目前,化学合成法生产D-乳酸存在诸如工艺复杂、成本高、聚合物光学纯度低等缺点[6];生物催化法原料昂贵且应用范围小;发酵法[7]生产D-乳酸是较好的生产工艺,多数细菌代谢途径中存在葡萄糖代谢生成乳酸的途径,且发酵工艺的原料来源广泛、价格低廉[8],具有广阔的应用前景。工业生产高光学纯度D-乳酸的菌株大多为乳酸菌属,该菌属乳酸产量高,但其培养基成分复杂、培养条件苛刻,因而生产成本较高[9]。因此,通过优化培养基组分[10],获得廉价、高效的培养基配方具有现实意义。
与乳酸菌属相比,粘质沙雷氏菌(Serratia marcescens)[11]培养条件要求较低,培养基组分相对简单、廉价,在转化率和产率上具有优势。作者首次选用粘质沙雷氏菌作为乳酸生产菌,考察了其培养条件及培养基组分对菌体生长及D-乳酸产量的影响,拟为深入研究其代谢途径[12,13]及产物提供参考。
1 实验
1.1 菌株
重组粘质沙雷氏菌 R1(Serratia marcescens R1,KnR,α-乙酰乳酸合成酶基因缺失),本实验室构建,甘油悬液保藏法保存于-80℃冰箱。
1.2 方法
(1)菌株活化:取1mL菌液接种至装液量为50 mL LB培养基的250mL摇瓶中,置于28℃、200r·min-1摇床培养12h。取适量菌体稀释后涂布于种子培养基平板上,倒置于恒温培养箱内培养24h至长出单菌落。
(2)种子培养:从固体培养基平板上挑取生长良好的单菌落接种至装有50mL种子培养基的250mL摇瓶中,加入适量卡那霉素以防止染菌,置于28℃、200 r·min-1摇床培养12h,得种子培养液。如有需要,再次转接种子制成二级种子培养液备用。
(3)摇瓶发酵:按照5%接种量,转接种子培养液至装有发酵培养基的摇瓶中,加入适量卡那霉素防止染菌,分两阶段培养:第一阶段28℃、200r·min-1摇床培养12h左右;其后,调节适合温度静置厌氧培养产酸,添加软性碳酸钙或4mol·L-1碱液维持一定pH值。
1.3 分析测试
1.3.1 葡萄糖浓度测定
取适量培养上清液稀释N倍后振荡混匀,使其葡萄糖浓度在1g·L-1左右。取两支试管,各加入葡萄糖试剂1mL后,分别加入10μL校准液及待测液于试管中,37℃水浴10min后,用1.0cm比色杯(用空白管调零点),于505nm处测定其吸光度值,校准液记为A0,待测液记为A。按式(1)计算上清液葡萄糖浓度S(g·L-1):

1.3.2 菌体浓度的测定
取微量不同生长阶段的菌液,适当稀释N倍使得其吸光度值A处于0.2~0.8范围内,测其在600nm处的吸光度值。菌体浓度OD600=A×N,根据干重标准曲线换算为菌体干重。
1.3.3 乳酸浓度测定
采用岛津高效液相色谱仪测定发酵液中乳酸浓度。
色谱 条 件:Bio-Rad Aminex HPX-87H 色 谱 柱(300mm×7.8mm);流动相5mmol·L-1H2SO4;流速0.6mL·min-1;进样量50μL;柱温65℃。
液相色谱法测定结果为总乳酸浓度,采用乳酸试剂盒法准确测定各对映体构型乳酸浓度,同时与液相色谱法的测定结果进行比较。测定原理如下[14]:

由上述反应式可知,NADH的生成量与乳酸的量等摩尔,NADH的量可以通过测定其在340nm处吸光度值的变化量ΔA获得。
按c=0.3204×ΔA分别计算出L-乳酸和D-乳酸的浓度,则光学纯度POptical按式(2)计算:

2 结果与讨论
2.1 培养条件的确定
2.1.1 培养温度、pH 值的影响
细菌厌氧发酵有机酸过程中,随着厌氧培养的进行,菌体所消耗糖类转化为有机酸,后者的积累会致使培养环境中的pH值降低,抑制菌体胞内有机酸代谢过程中关键酶的活性,降低菌体利用基质的速率并改变菌体细胞形态、结构等,对目的产物的生成造成不利影响。考察培养温度及pH值对菌体量和乳酸产量的影响,结果见图1。

图1 培养温度(a)和pH值(b)对菌体量和乳酸产量的影响Fig.1 Effects of culture temperature(a)and culture pH value(b)on biomass and lactic acid yield
由图1a可知,培养温度在28~34℃范围内,菌体量、乳酸产量均随培养温度升高而增大,超过34℃后,菌体量、乳酸产量均急剧下降。同时,菌体在相对低培养温度条件下的耗糖量更大。从菌体生长方面考虑,应该控制培养温度低于34℃,此时,菌体量大且残糖量低近乎零。因此,选择培养温度为34℃。
由图1b可知,偏碱性(pH值>7.5)培养条件和偏酸性(pH值<6.5)培养条件下的乳酸产量和菌体量均低于近中性条件,且碱性培养条件需要中和剂维持,增加成本。在粘质沙雷氏菌生长及代谢过程中,近中性(pH值7.5~6.5)培养条件下,乳酸产量及菌体量均较大。但pH值6.5培养条件可以减少中和剂的加入,降低成本。因此,选择pH值为6.5。
2.1.2 溶氧的影响
粘质沙雷氏菌作为兼性好氧菌,在有氧及无氧条件下均可以生长,但在无氧条件下发酵生成乳酸。摇瓶实验中的溶氧状况和载液量相关,载液量的增加意味着溶氧及传质速率的下降。考察载液量对菌体量和乳酸产量的影响,结果见图2。
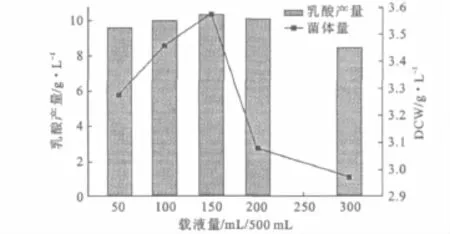
图2 载液量对菌体量和乳酸产量的影响Fig.2 Effects of loaded liquid on biomass and lactic acid yield
由图2可知,随着载液量的增加,乳酸产量和菌体量均增大,载液量为150mL/500mL时,乳酸产量最大,达10.35g·L-1;但载液量超过150mL/500mL后,乳酸产量略微下降,而菌体量急剧下降。50mL/500mL装液量下,原本最利于氧的传递及菌体的生长,但总营养物质相对偏少,其菌体量及乳酸产量较低。因此,选择载液量为150mL/500mL。
2.2 培养基的确定
2.2.1 碳、氮源的选择[15](图3)
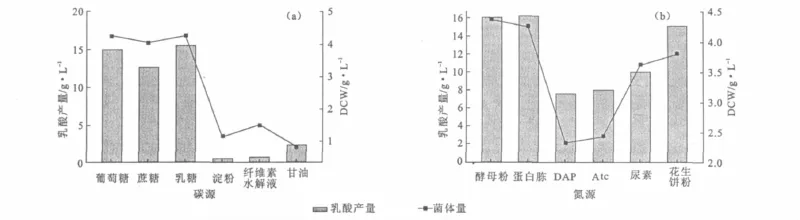
图3 碳源(a)和氮源(b)对菌体量及乳酸产量的影响Fig.3 The effects of carbon sources(a)and nitrogen sources(b)on biomass and lactic acid yield
由图3a可知,菌株的碳源谱较广,可利用多种碳源。其中以葡萄糖、蔗糖和乳糖为碳源的菌体量及乳酸产量均优于甘油、淀粉和纤维素水解液。葡萄糖相对廉价,作为碳源培养微生物,菌体生长迅速且代谢途径清楚,利于分析代谢过程及计算生长过程中的参数,是有机酸发酵比较常用的碳源。因此,选择葡萄糖作为碳源。
由图3b可知,菌株可利用多种氮源,其中有机氮源如酵母粉、蛋白胨、花生饼粉和尿素的菌体量要高于磷酸氢二铵(DAP)和柠檬酸铵(Atc),且蛋白胨、酵母粉为氮源时的乳酸产量较高。因此,选择酵母粉作为氮源。
综上,选择葡萄糖和酵母粉作为碳、氮源,用量较大时选择工业葡萄糖和国产酵母粉。
2.2.2 葡萄糖及酵母粉浓度的选择
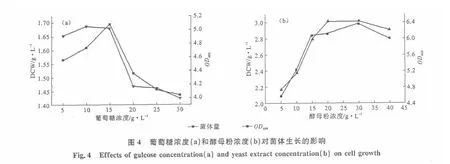
培养基中碳、氮源浓度对菌体生长及产物生成均有较大影响。当培养基中碳源浓度超过5%时,细菌会因细胞脱水而衰亡,且存在克列勃特里效应抑制细胞的有氧呼吸产能。设计葡萄糖及酵母粉浓度梯度实验考察菌体生长状况,摇瓶有氧培养16h,测定吸光度值及菌体干重,结果见图4。
由图4a可知,随着葡萄糖浓度的增大,菌体量增加;葡萄糖浓度为15g·L-1时,菌体量最大;当葡萄糖浓度超过15g·L-1后,菌体量急剧下降。低葡萄糖浓度(≤15g·L-1)下菌体生长良好,获得较大积累。但是,过低葡萄糖浓度使得能源供应不足,致使菌体量偏小。葡萄糖浓度在10~15g·L-1范围内,阻遏效应小,菌体量能够短期内较多积累,因此,选择最佳葡萄糖浓度为15g·L-1。
由图4b可知,酵母粉浓度的增大为细菌提供足量的氮源、氨基酸、生长因子等物质,菌体量大幅增加,但高浓度的酵母粉会致使氮源过饱和,促进能量向菌体积累方向转移,反而对目的产物生成不利。工业发酵过程中,往往对氮源,特别是碳氮比应合理掌控,促使能够获得更多目的产物。因此,综合考虑生产成本、菌体生物量积累等,选择最佳酵母粉浓度为15g·L-1。
2.2.3 磷酸盐的选择
磷是核酸的重要组成成分,参与细胞的多种代谢,是微生物不可或缺的营养成分。此外,加入磷酸盐可起到缓冲pH值的效果。按照前述的培养方法,配制含磷酸氢二钾、磷酸二氢钾浓度梯度的培养基,摇瓶有氧培养16h,测定吸光度值及菌体干重,结果见图5。

由图5a可知,随着K2HPO4·3H2O浓度的增大,菌体量快速增加,K2HPO4·3H2O浓度为2.0g·L-1时,菌体干重最大,为4.02g·L-1;但过多磷酸盐的加入会使得菌体生长变慢,生物量减少。因此,选择最佳K2HPO4·3H2O浓度为2.0g·L-1。
由图5b可知,KH2PO4浓度为1.5g·L-1时,其菌体干重最大,为3.99g·L-1。因此,选择最佳KH2PO4浓度为1.5g·L-1。
2.2.4 金属离子盐的选择
金属离子参与细胞结构组成、能量转移、调节细胞通透性,是微生物正常生长和代谢过程中非常重要的一类元素。细胞内分子成分包括Ca2+、Mg2+、Fe2+,生理调节物质如Na+、K+可以维持细胞渗透压,Mg2+、Cu2+、Zn2+可以作为某些酶的激活剂,特殊分子结构物质如Co2+、Mo2+等。因此,考察金属离子盐对粘质沙雷氏菌生长及产物乳酸生成的影响是很有必要的。对细菌培养中常见的金属离子进行实验,考察其对菌体生长的影响,结果见图6。
由图6可知,Mg2+、Mn2+、Fe2+对菌体的生长有一定的促进作用;Cu2+、Co2+有抑制作用;Zn2+无促进或抑制效应。因此,进一步考察3种金属离子盐浓度对菌体生长和乳酸产量的影响,结果见图7。
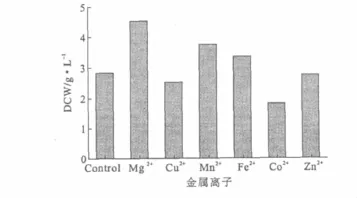
图6 金属离子对菌体生长的影响Fig.6 Effects of metal ions on cell growth
由图7a可知,Mg2+作为乳酸脱氢酶激活剂可以促进代谢产物乳酸的生成。在MgSO4·7H2O浓度为1.0g·L-1时,菌体量和乳酸产量均最大。因此,选择最佳 MgSO4·7H2O浓度为1.0g·L-1。
由图7b可知,当MnSO4·H2O浓度低于5mg·L-1时,菌体量及乳酸产量偏低;当浓度高于5mg·L-1时,Mn2+影响菌体细胞壁等结构进而对菌体生长及乳酸生成不利。因此,选择最佳MnSO4·H2O浓度为5mg·L-1。
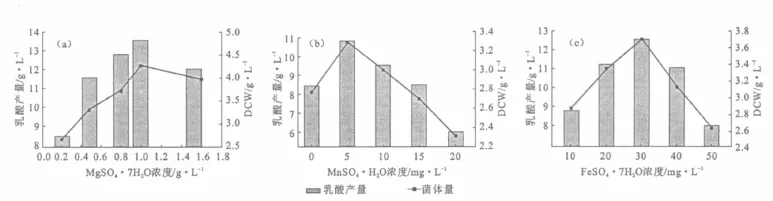
图7 金属离子盐浓度对菌体生长及乳酸产量的影响Fig.7 Effects of concentration of metal ion salts on cell growth and lactic acid yield
由图7c可知,当FeSO4·7H2O浓度为30mg·L-1时,菌体量及乳酸产量均最大;当浓度低于或高于30mg·L-1时,Fe2+对菌体生长及产物积累有抑制作用。因此,选择最佳FeSO4·7H2O浓度为30mg·L-1。
2.3 验证实验
在最佳培养基和培养条件下进行摇瓶发酵实验,D-乳酸产量由(13.5±1.29)g·L-1提高至(29.0±1.42)g·L-1,提高一倍以上,光学纯度大于97%。表明通过培养基、培养条件的优化,得到的是发酵优化初始阶段提升产量的较优方案,同时也为发酵罐放大实验、进一步优化发酵工艺[16]提供了参考和依据。
3 结论
采用粘质沙雷氏菌发酵产D-乳酸,考察了培养条件和培养基组分对菌体生长和乳酸产量的影响。确定了最佳培养条件如下:温度为34℃,pH值为6.5,接种量为5%,载液量为150mL/500mL,采用两阶段培养工艺——前期通气有氧培养16h、后期厌氧发酵产酸的培养方案。优化的培养基(g·L-1)为:葡萄糖15,酵母粉15,KH2PO41.5,K2HPO4·3H2O 2.0,MgSO4·7H2O 1.0,FeSO4·7H2O 0.03,MnSO4·7H2O 0.005。在最佳培养基和最佳培养条件下进行摇瓶发酵实验,D-乳酸产量由(13.5±1.29)g·L-1提高至(29.0±1.42)g·L-1,产量提高一倍多,光学纯度大于97%。
[1]许婷婷,何冰芳.D-乳酸制备研究进展[J].化工进展,2009,28(6):991-996.
[2]汪新华.乳酸及其衍生物的应用与开发前景[J].湖北化工,2002,19(1):42-43.
[3]Wee Y,Kim J,Ryu H.Biotechnological production of lactic acid and its recent applications[J].Food Technology and Biotechnology,2006,44(2):163-172.
[4]Miller C,Fosmer A,Rush B,et al.Industrial Production of Lactic Acid[M].Bio-Based Chemicals,2011:179-188.
[5]Shen L,Worrell E,Patel M.Present and future development in plastics from biomass[J].Biofuels,Bioproducts and Biorefining,2010,4(1):25-40.
[6]Gao C,Ma C,Xu P.Biotechnological routes based on lactic acid production from biomass[J].Biotechnol Adv,2011,29(6):930-939.
[7]Singhvi M,Joshi D,Adsul M,et al.D-(-)-Lactic acid production from cellobiose and cellulose by Lactobacillus lactis mutant Rm2-24[J].Green Chemistry,2010,12(6):1106-1109.
[8]John R P,Nampoothiri K M,Pandey A.Fermentative production of lactic acid from biomass:An overview on process developments and future perspectives[J].Appl Microbiol Biotechnol,2007,74(3):524-534.
[9]Okano K,Tanaka T,Ogino C,et al.Biotechnological production of enantiomeric pure lactic acid from renewable resources:Recent achievements,perspectives,and limits[J].Appl Microbiol Biotechnol,2010,85(3):413-423.
[10]代志凯,张翠,阮征.试验设计和优化及其在发酵培养基优化中的应用[J].微生物学通报,2010,37(6):694-903.
[11]Rao B,Zhang L Y,Sun J,et al.Characterization and regulation of the 2,3-butanediol pathway in Serratia marcescens[J].Appl Microbiol Biotechnol,2012,93(5):2147-2159.
[12]Zhang L,Yang Y,Sun J,et al.Microbial production of 2,3-butanediol by a mutagenized strain of Serratia marcescens H30[J].Bioresour Technol,2010,101(6):1961-1967.
[13]Grimont F,Grimont P D.The genus Serratia[J].Prokaryotes,2006,6:219-244.
[14]Bischoff K M,Liu S,Hughes S R,et al.Fermentation of corn fiber hydrolysate to lactic acid by the moderate thermophile Bacillus coagulans[J].Biotechnol Lett,2010,32(6):823-828.
[15]Coelho L F,De Lima C J,Bernardo M P,et al.D-(-)-Lactic acid production by Leuconostoc mesenteroides B512using different carbon and nitrogen sources[J].Appl Biochem Biotechnol,2011,164(7):1160-1171.
[16]唐开宇,宋喜军,高大成,等.乳酸连续化发酵进展[J].化学与生物工程,2006,23(11):4-6.
