3-氨基-5-甲氧基异唑的合成与表征
2013-08-14马春燕陈春光陈学玺
马春燕,陈春光,陈学玺
(1.青岛科技大学化工学院,山东 青岛266042;2.黄海出入境检验检疫局,山东 青岛266042)
盐酸头孢唑兰是第四代注射用头孢菌素,于1995年6月在日本批准上市,日本已将其作为外感染初期的首选药物。盐酸头孢唑兰对包括葡萄球菌在内的革兰氏阳性菌以及包括绿脓杆菌在内的革兰氏阴性菌均具有抗菌作用[1],目前国内还处于研发阶段[2-4]。
合成头孢唑兰及其它第四代头孢菌素的必需中间体为(Z)-2-(5-氨基-1,2,4-噻二唑-3-基)-2-甲氧亚氨基乙酸-S-苯并噻唑硫酯[5],它是以(Z)-2-(5-氨基-1,2,4-噻二唑-3-基)-2-甲氧亚氨基乙酸和二硫化二苯并噻唑为原料,通过氧化还原反应制得。3-氨基-5-甲氧基异口恶唑是合成(Z)-2-(5-氨基-1,2,4-噻二唑-3-基)-2-甲氧亚氨基乙酸的重要中间体[6,7],研究其合成工艺对头孢唑兰抗生素的合成具有十分重要的意义。
作者在此以3,3,3-三甲氧基丙腈为原料,通过两步反应合成了3-氨基-5-甲氧基异口恶唑,优化了工艺条件,并通过核磁共振氢谱等手段对其结构进行了表征。
合成路线如图1所示。

图1 3-氨基-5-甲氧基异口恶唑的合成路线Fig.1 Synthetic route of 3-amino-5-methoxyisoxazole
1 实验
羟胺、NaOH的反应液中,反应完毕后,过滤分离出无机沉淀物,浓缩、萃取、结晶,得到3-氨基-5-甲氧基异唑。
1.1 试剂
盐酸羟胺、氢氧化钠、正己烷、乙酸乙酯,天津博迪化工股份有限公司;甲醇,莱阳经济技术开发区精细化工厂。所用试剂均为分析纯。
1.2 3,3-二甲氧基丙烯腈的合成
将3,3,3-三甲氧基丙腈脱去1分子甲醇,得到3,3-二甲氧基丙烯腈。
1.3 3-氨基-5-甲氧基异口恶唑的合成
将3,3-二甲氧基丙烯腈溶解在甲醇中,加至盐酸
2 结果与讨论
2.1 合成条件优化
2.1.1 氧气对3,3-二甲氧基丙烯腈合成的影响
进行3组平行实验,取等量的3,3,3-三甲氧基丙腈分别放入3个圆底烧瓶中,第一组用氮气置换3次(完全隔氧),第二组用氮气置换1次(半隔氧),第三组不做任何置换(未隔氧)。考察氧气对3,3-二甲氧基丙烯腈合成的影响,结果见表1。
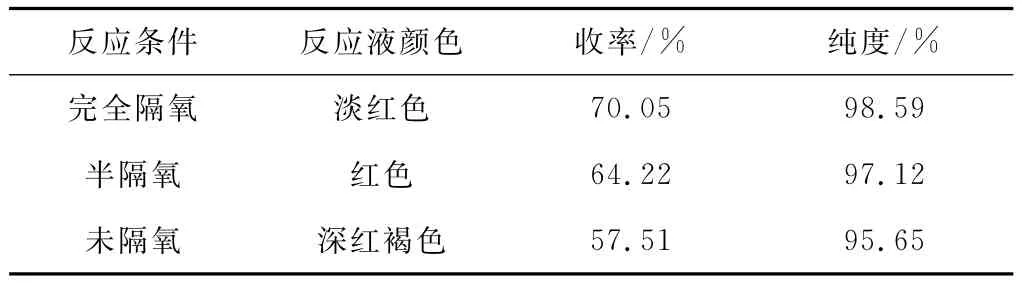
表1 氧气对3,3-二甲氧基丙烯腈合成的影响Tab.1 Effect of oxygen on synthesis of 3,3-dimethoxyacrylonitrile
由表1可以看出,氮气置换3次后(完全隔氧)所得产品颜色较浅、纯度和收率最高。因此,3,3,3-三甲氧基丙腈在222~225℃脱甲醇时要进行完全隔氧操作。
2.1.2 搅拌时间对3,3-二甲氧基丙烯腈合成的影响称取4份等量的糖浆状3,3,3-三甲氧基丙腈于圆底烧瓶中,于222~225℃完全隔氧条件下分别搅拌5 min、7min、9min、11min、13min,用泊松色谱(展开剂为甲醇∶己烷=1∶20)检测反应情况,结果见图2。

图2 搅拌时间对3,3-二甲氧基丙烯腈合成的影响Fig.2 Effect of stirring time on synthesis of 3,3-dimethoxyacrylonitrile
实验发现,搅拌7min后,原料才能消耗完毕,且随着搅拌时间的延长反应物颜色逐渐加深。
由图2可以看出,随着搅拌时间的延长,3,3-二甲氧基丙烯腈的收率和纯度均先升高后降低,在7~9 min时达到最高。因此,选择搅拌时间为7~9min。
2.1.3 光照对3-氨基-5-甲氧基异口恶唑合成的影响
进行3组平行实验:第一组完全避光处理,第二组半避光处理,第三组不做任何避光处理,考察光照对3-氨基-5-甲氧基异口恶唑合成的影响,结果见表2。
由表2可以看出,完全避光组的纯度和收率高于未避光组和半避光组。这是因为,氨基在某些特殊分子结构中遇光分解,从而造成了产品损失。因此,由3,3-二甲氧基丙烯腈合成3-氨基-5-甲氧基异口恶唑时应进行避光处理。
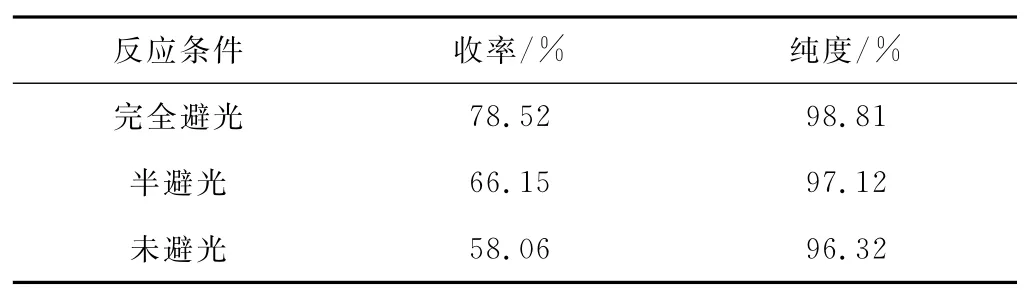
表2 光照对3-氨基-5-甲氧基异口恶唑合成的影响Tab.2 Effect of light on synthesis of 3-amino-5-methoxyisoxazole
2.1.4 氧气对3-氨基-5-甲氧基异口恶唑合成的影响
进行3组平行实验:第一组用氮气置换3次(完全隔氧),第二组用氮气置换1次(半隔氧),第三组不进行氮气置换(未隔氧),考察氧气对3-氨基-5-甲氧基异口恶唑合成的影响,结果见表3。

表3 氧气对3-氨基-5-甲氧基异口恶唑合成的影响Tab.3 Effect of oxygen on synthesis of 3-amino-5-methoxyisoxazole
由表3可以看出,完全隔氧组和半隔氧组所得产品颜色较浅,容易萃取,纯度和收率均高于未隔氧组。因此,3-氨基-5-甲氧基异口恶唑合成过程中应进行隔氧操作。
2.2 产物表征
2.2.1 熔点
用熔点仪测得产品熔点为81~82℃,与3-氨基-5-甲氧基异口恶唑的熔点相符,可以初步断定产物为3-氨基-5-甲氧基异口恶唑。
2.2.2 核磁共振氢谱分析
用核磁共振氢谱分析产物结构时发现,在相同的溶剂下,-O-CH3和-NH2的出峰位置相同。因此,设计两组实验以进一步表征产物的结构:第一组,检测溶剂为CDCl3和重水的混合物,目的是掩盖-NH2,以证实-C-H和-O-CH3的存在;第二组,检测溶剂为CDCl3,目的是在第一组测定的基础上证实-NH2的存在。结果如图3所示。
由图3a可以看出,1HNMR(CDCl3+D2O),δ:3.931(3H,s,OMe),4.832(1H,s,H-4)。化学位移在3.931ppm处的单峰由一个甲氧基上的3个质子产生,4.832ppm处的单峰由连接一个双键碳和一个单键碳上的1个质子产生,表明了产物中C-H和-O-CH3的存在。
由图3b可以看出,1HNMR(CDCl3),δ:3.928~3.949(5H,s,OMe),4.826(1H,s,H-4)。结合图3a可知,化学位移在3.928~3.949ppm处的峰由一个甲氧基上的3个质子和-NH2上的2个质子产生,4.826ppm处的单峰由连接一个双键碳和一个单键碳上的1个质子产生,表明了产物中C-H、-O-CH3和-NH2的存在,这正是3-氨基-5-甲氧基异口恶唑所具有的特征。结合产品的熔点,证实了产物结构与预期相符。
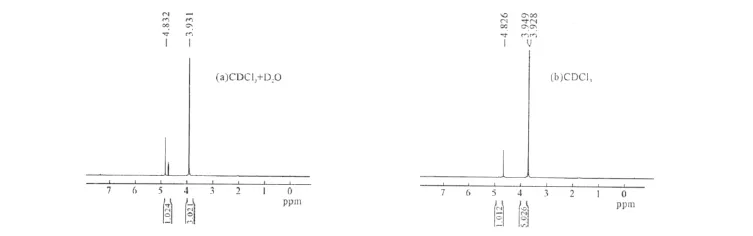
图3 3-氨基-5-甲氧基异口恶唑的核磁共振氢谱Fig.3 1 HNMR Spectra of 3-amino-5-methoxyisoxazole
3 结论
以3,3,3-三甲氧基丙腈为原料,通过两步反应合成了3-氨基-5-甲氧基异口恶唑,通过单因素实验确定3,3-二甲氧基丙烯腈的最佳合成条件为:在222~225℃下完全隔氧搅拌7~9min脱甲醇,在此条件下3,3-二甲氧基丙烯腈收率为70.05%,纯度为98.59%;3-氨基-5-甲氧基异口恶唑的最佳合成条件为:45℃下避光隔氧搅拌3h和60℃下避光隔氧搅拌3.5h,在此条件下目标产物收率达79.35%,纯度达98.91%。
[1]张致平.抗菌药物研究进展[J].中国抗生素杂志,2002,27(2):67-69.
[2]夏成才,程冬萍,于文博,等.第四代头孢研究进展及合成综述[J].应用化工,2005,34(3):137-140.
[3]蒋锦,刘秉全,郭慧元.第四代头孢菌素——盐酸头孢唑兰[J].国外医药抗生素分册,2006,27(2):61-68.
[4]陈国华,任重,杨阳.盐酸头孢唑兰的合成[J].中国抗生素杂志,2009,34(8):479-480.
[5]李爱军,周雪琴,刘东志.2-(2-氨基噻唑-4-基)-2-(Z)-甲氧亚胺基乙酸苯并噻唑硫酯合成工艺的改进[J].精细化工,2005,22(10):792-794.
[6]Miyake A,Yoshimura Y,Yamaoka M,et al.Studies on condensedheterocyclic azolium cephalosporins.Ⅳ.Synthesis and antibacterial activity of 7β-[2-(5-amino-1,2,4-thiadiazol-3-yl)-2(Z)-alkoxyiminoacetamido]-3-(condensed-heterocyclic azolium)methyl cephalosporins[J].J Antibiot,1992,45(5):709-720.
[7]Sugiyama I,Komatsu Y,Yamauchi H.Synthesis and structure-activity relationships of a new series of cephalosporins,E1040and related compounds[J].J Antibiot,1992,45(1):103-112.
