含氮杂环多亚甲基双酰基硫脲化合物的合成及生物活性
2013-08-14杨曼丽梁爱琴闫世凤
杨曼丽,梁爱琴,闫世凤,许 宁
(1.青岛农业大学化学与药学院,山东 青岛266109;2.华中师范大学化学学院,湖北 武汉430079;3.威海乳山五中,山东 乳山264500)
含氮杂环化合物有着独特的生物活性且毒性低、内吸性高,常被用作农药结构组成单元,在农药领域起着重要的作用[1-4]。其中酰基硫脲衍生物由于具有杀虫、杀菌、除草、抗病毒及植物生长调节等广泛的生物活性而倍受关注[5-7]。
为了寻找新的活性物质,作者在此设计合成了9个新型含氮杂环多亚甲基双酰基硫脲化合物,并对其进行了结构表征和生物活性测试。
目标化合物的合成路线为:首先分别合成杂环胺;然后以脂肪羧酸与氯化亚砜反应制得酰氯,酰氯在溶剂乙腈存在下与硫氰酸钾反应生成酰基异硫氰酸酯;最后通过亲核加成反应将杂环胺类化合物与酰基硫脲连接在一起,得到目标化合物。如图1所示。

图1 目标化合物的合成路线Fig.1 The synthetic route of the target compounds
1 实验
1.1 试剂与仪器
所用试剂均为化学纯或分析纯。氯化亚砜用前蒸馏,硫氰酸钾及各种取代酸用前烘干。
回流反应装置;Avatar FTIR 8000型红外光谱仪(KBr压片),美国尼高力公司;Varian-300MHz或Varian-400MHz超导核磁共振仪(DMSO-d6为溶剂,TMS为内标);Varian ELⅢ型元素分析仪;8100系列电热熔点仪(温度计未校正);Finnigan TRACE-MS型质谱仪。
1.2 中间体的制备
(1)戊(己、癸)二酰氯参照文献[8]制备。
(2)异硫氰酸酯的制备:上步反应所得酰氯不经分离,加入20mL无水乙腈、1.5g硫氰酸钾(约0.015 mol),在70~75℃反应0.5h,冷却,过滤除去KCl沉淀,得黄色透明的异硫氰酸酯乙腈溶液。
(3)2-氨基-6-甲基苯并噻唑参照文献[9]制备。(4)2-氨基-1,3,4-噻二唑参照文献[10]制备。
1.3 目标化合物的制备
向异硫氰酸酯乙腈溶液中加入约0.010mol杂环胺,回流反应数小时,冷却,过滤,先用少量乙醇洗涤,再用大量乙醚洗涤,干燥,用DMF-乙醇混合溶剂重结晶,即得纯净的目标化合物。
2 结果与讨论
2.1 合成条件的探讨
所得产物除了目标化合物外,尚有少量的酰胺。其原因是杂环胺与烷基酰基异硫氰酸酯之间发生了亲核加成和亲核取代竞争[11]。由于质子的存在将增加羰基碳的亲电性,有利于亲核取代反应。因此,为了减少副产物的生成,反应应该在乙腈、丙酮、二氯甲烷等干燥的非质子溶剂中进行。
2.2 目标化合物I1~I9的理化性质及波谱数据
化合物I1~I9均不溶于石油醚、乙醚等弱极性溶剂,微溶于乙醇,易溶于DMF和DMSO等强极性溶剂。
化合物I1~I9的外观、收率、熔点、1HNMR、IR、元素分析及MS数据如下:
I1:棕色颗粒,产率37.6%,m.p.212~214 ℃;1HNMR(DMSO-d6,300MHz),δ:11.535(2H,s,2CSNH),11.324(2H,s,2CONHCS),7.486~7.321(10H,d,2Ar-H),3.075(6H,s,2N-CH3),2.550~2.480(4H,t,2CH2CO),2.146(6H,s,2CH3),1.764~1.834(2H,m,CH2);IR(KBr),ν,cm-1:3416、3165(NH),1685、1640(C=O),1172(C=S);C29H32N8O4S2元素分析实测值(理论值),%:C 56.42(56.11),H 5.38(5.20),N 18.24(18.05);MS(70eV),m/z:299.3(30.63),246.2(27.36),203.2(36.72),135.0(17.93),130.1(3.33),59.0(37.85),56.0(100.00)。
I2:棕 色颗粒,产率 36.9%,m.p.>300 ℃;1HNMR(DMSO-d6,300MHz),δ:11.560(2H,s,2CSNH),11.356(2H,s,2CONHCS),7.758~7.201(6H,m,2Het-H),2.424~2.289(4H,t,2CH2CO),2.228(6H,s,2CH3),1.281~1.342(2H,m,CH2);IR(KBr),ν,cm-1:3396、3268(N-H),1537(C=N),1630(C=O),1280(C=S);C23H22N6O2S4元素分析实测值(理论值),%:C 50.61(50.90),H 4.31(4.09),N 15.14(15.49);MS(70eV),m/z:424.1(30.56),206.1(28.98),130.2(56.01),164.0(100.00),59.0(8.56)。
I3:白色颗粒,产率41.2%,m.p.>300℃;1HNMR(DMSO-d6,300MHz),δ:11.498(2H,s,2CSNH),11.315(2H,s,2CONHCS),9.982(2H,s,2Het-H),2.459~2.278(4H,t,2CH2CO),1.279~1.390(2H,m,CH2);IR(KBr),ν,cm-1:3417、3167(N-H),1566(C=N),1693(C=O),1266(C=S);C11H12N8O2S4元素分析实测值(理论值),%:C 31.98(31.72),H 2.68(2.90),N 26.76(26.90);MS(70eV),m/z:298.0(37.78),246.2(23.54),143.3(56.08),130.1(34.65),100.0(100.0)。
I4:白色粉末,产率78.82%,m.p.214~216℃;1HNMR(DMSO-d6,300MHz),δ:9.964(2H,s,2CSNH),7.285~7.591(10H,d,2Ar-H),2.486~2.299(4H,t,2CH2CO),3.075(6H,s,2NCH3),1.564(6H,s,2CH3),1.272~1.302(4H,m,2CH2);IR(KBr),ν,cm-1:3408、3177(N- H),1680、1660(C=O),1242(C=S);C30H34N8O4S2元素分析实测值(理论值),%:C 56.45(56.76),H 5.96(5.78),N 17.86(17.65);MS(70eV),m/z:246.1(6.69),203.1(22.77),135.0(16.07),84.1(33.66),59.0(50.53),56.1(100.00),144.1(1.23)。
I5:棕色粉末,产率72.84%,m.p.>300℃;1HNMR(DMSO-d6,300MHz),δ:10.135(2H,s,2CSNH),9.986(2H,s,2CONHCS),7.782~7.267(6H,m,2Het-H),2.305~ 2.288 (4H,t,2CH2CO),2.189(6H,s,2CH3),1.765~1.605(4H,m,2CH2);IR(KBr),ν,cm-1:3426、3128(N - H),1664(C= N),1707(C=O),1265(C=S);C24H24N6O2S4元素分析实测值(理论值),%:C 51.55(51.78),H 4.56(4.34),N 15.32(15.09);MS(70eV),m/z:438.2(54.45),300.0(30.99),275.2(76.44),233.2(63.94),164.1(100.00),59.0(50.53)。
I6:黄色粉末,产率54.26%,m.p.>300℃;1HNMR(DMSO-d6,300MHz),δ:10.325(2H,s,2CSNH),9.786(2H,s,2Het-H),2.484~2.298(4H,t,2CH2CO),1.348~1.216(4H,m,2CH2);IR(KBr),ν,cm-1:3403、3125(N-H),1564(C=N),1694(C=O),1268(C=S);C12H14N8O2S4元素分析实测值(理论值),%:C 33.74(33.48),H 3.07(3.28),N 26.24(26.03);MS(70eV),m/z:312.2(13.56),143.2(34.64),143.3(63.78),59.1(100.00)。
I7:棕色粉末,产率68.92%,m.p.234~236℃;1HNMR(DMSO-d6,300MHz),δ:12.058(2H,s,CSNH),7.665~7.311(10H,d,2Ar-H),3.021(6H,s,2N-CH3),2.392~2.281(4H,t,2CH2CO),2.095(6H,s,2CH3),1.575~1.356(12H,m,6CH2);IR(KBr),ν,cm-1:3426、3065(N- H),1709、1695(C=O),1218(C=S);C34H42N8O4S2元素分析实测值(理论值),%:C 59.51(59.10),H 6.01(6.13),N 16.62(16.30);MS(70eV),m/z:263.1(38.57),246.0(8.32),231.1(13.47),202.1(19.13),169.0(43.90),67.1(100.00),59.1(4.15)。
I8:黄色颗粒,产率66.87%,m.p.>300 ℃;1HNMR(DMSO-d6,300MHz),δ:12.169(2H,s,2CSNH),7.712~7.199(6H,m,2Het-H),2.422~2.300(4H,t,2CH2CO),2.215(6H,s,2CH3),1.562~1.275(12H,m,6CH2);IR(KBr),ν,cm-1:3392、3224(N-H),1607(C=N ),1701(C=O),1261(C=S);C28H32N6O2S4元素分析实测值(理论值),%:C 54.49(54.88),H 5.05(5.26),N 13.97(13.71);MS(70eV),m/z:494.2(29.42),331.1(33.92),289.1(41.82),164.0(100.00),59.1(7.72)。
I9:黄色粉末,产率62.86%,m.p.>300 ℃;1HNMR(DMSO-d6,300MHz),δ:12.085(2H,s,2CSNH),9.989(2H,s,2Het-H),2.378~2.276(4H,t,2CH2CO),1.314~1.198(12H,m,6CH2);IR(KBr),ν,cm-1:3401、3160(N-H),1550(C=N ),1705(C=O),1264(C=S);C16H22N8O2S4元素分析实测值(理论值),%:C 39.74(39.49),H 4.88(4.56),N 23.40(23.03);MS(70eV),m/z:368.1(20.48),284.3(21.78),128.0(68.53),101.1(100.00)。
2.3 波谱分析
2.3.1 IR分析
化合物I1~I9的官能团均在对应位置表现出明显的特征吸收峰:在3430~3390cm-1之间有较强的N-H伸缩振动吸收峰;在3060~3270cm-1附近出现另一个N-H吸收峰,较正常的N-H吸收峰(3500~3300cm-1)向低波数移动,主要是因为形成了六元环的分子内氢键,此现象与文献报道一致[12]。
2.3.21HNMR 分析
化合物I1~I3的1HNMR谱图中出现了2个活泼氢信号。王积涛等[13]研究表明,在酰基硫脲结构N1H-CS-N2H-CO-中存在着六元环状的分子内氢键,由于羰基氧与N1-H形成分子内氢键,产生较强的去屏蔽效应,所以N1-H的化学位移出现在低场,而N2-H则出现在高场。
另外I4~I9的1HNMR 谱图中仅出现了单个N1-H活泼信号,观察不到N2-H吸收峰,主要是因为用DMSO-d6作溶剂,部分活泼氢被交换,使得信号峰变弱[12]。
2.4 生物活性
委托湖北省农药研究所生测研究室分别采用小麦芽鞘法和黄瓜子叶扩张法在室内测定化合物I1~I9的生长素活性和细胞分裂素活性。生长素活性的对照药样为β-吲哚乙酸(IAA),细胞分裂素活性的对照药样为6-呋喃甲基腺嘌呤(激动素,简称KT),IAA浓度为10mg·L-1和100mg·L-1,KT浓度为10mg·L-1,详细测试方法参照文献[14,15]。
生物活性测试结果见表1。
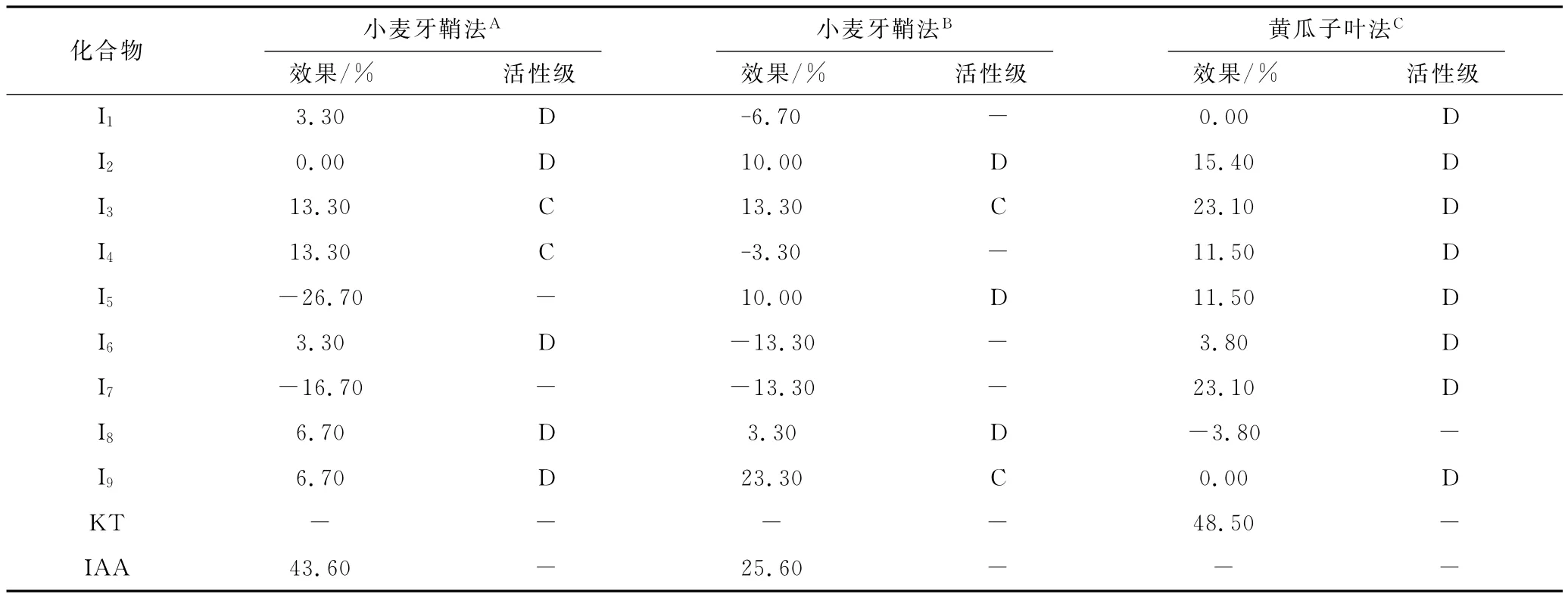
表1 化合物I1~I9植物生长调节活性测试结果Tab.1 The determination results of the plant growth regular activity of compounds I1~I9
由表1可知,目标化合物中I3、I4、I9在不同的浓度下表现出一定的生长素活性;但化合物I1~I9均未表现出细胞分裂素活性。
3 结论
合成了9个含氮杂环多亚甲基双酰基硫脲化合物,对其进行了1HNMR、IR、MS和元素分析表征,并测试了其植物生长调节活性。结果表明,部分化合物具有一定的植物生长调节活性。
[1]薛思佳,柴安,蔡志娟,等.4-(对取代苯基)-2-[2-(取代苯基)呋喃-4-甲酰胺]-1′,3′,4′-均三唑[1,2-d]-1,3,4-噻二唑类衍生物的合成和生物活性[J].有机化学,2008,28(3):494-497.
[2]Dayan F E,Vincent A C,Romagni J G,et al.Amino-and ureasubstituted thiazoles inhibit photosynthetic electron transfer[J].J Agric Food Chem,2000,48(8):3689-3693.
[3]Liu C L,Li L,Li Z M.Design,synthesis,and biological activity of novel 4-(3,4-dimethoxyphenyl)-2-methylthiazole-5-carboxylic acid derivatives[J].Bioorg Med Chem,2004,12(11):2825-2830.
[4]翁建全,刘会君,刘幸海,等.2-[4-(对氟苯基)噻唑-2-基]-3-羟基-3-烃氧基丙烯腈的合成及杀菌活性[J].农药学学报,2010,12(4):463-467.
[5]黄琴,覃章兰.1,3,4-口恶二唑取代芳酰基硫脲的合成及杀菌活性研究[J].化学试剂,2005,27(4):223-224,233.
[6]张杜蓓,任莹辉,傅丁薇,等.1-(4-甲氧基)苯甲酰基-3-(4,6-二甲基嘧啶-2-氨基)硫脲的晶体结构、理论计算及生物活性[J].化学学报,2008,66(21):2409-2415.
[7]傅颖,肖彩琴,张怀远,等.N-(2-吡啶氨基)-N′-苯甲酰基硫脲的合成及其生物活性测定[J].西北师范大学学报(自然科学版),2010,46(6):67-70.
[8]勃拉特,编.南京大学有机化学教研组,译.有机合成(第二集)[M].北京:科学出版社,1964:118.
[9]霍宁E C,编.南京大学有机化学教研室,译.有机合成(第三集)[M].北京:科学出版社,1981:46.
[10]李在国.有机中间体制备(第二版)[M].北京:化学工业出版社,2001:185.
[11]Elliott M,Farnham A W,Janes N F,et al.Potent pyrethroid insecticides from modified cyclopropane acids[J].Nature,1973,244(5416):456-457.
[12]王积涛,袁耀锋,许育明,等.酰基硫脲分子内氢键与取代基效应的定量关系[J].高等学校化学学报,1995,16(8):1233-1236.
[13]王积涛,张蕴文,许育明,等.N-二茂铁甲酰基-N′-芳(烷)基硫脲的合成及光谱性质研究[J].高等学校化学学报,1993,14(6):801-805.
[14]陈敬祥.植物生理学实验手册[M].上海:上海科学技术出版社,1985:320-321.
[15]郑巧兰,张祖新,唐除痴,等.某些硫代甲基膦酸酯类化合物的植物生长调节活性的研究[J].南开大学学报(自然科学版),1995,28(3):46-51.
