硼化合物催化的直接酰胺化反应研究进展
2013-08-14沙文彬黄文华
沙文彬,黄文华
(天津大学理学院化学系,天津300072)
酰胺键广泛存在于天然和人工合成的化合物中。20种α-氨基酸之间利用酰胺键组装形成了生命的基石——蛋白质与多肽。在很多天然或人工合成的药物分子中,酰胺键是重要的连接片段。2011年,对三大国际制药公司研发化合物的抽样统计表明,其中54%存在酰胺键[1]。在一些广泛使用的合成材料(如尼龙)中,酰胺键也扮演着不可替代的角色。通过酰胺的还原来制备胺类化合物也是有机合成中常见的一种转化[2]。因此酰胺键的形成无论在生命活动,还是在实验室制备和工业生产中都是十分常见的反应与过程。
目前,普遍采用的酰胺合成方法是:羧酸首先在活化试剂的作用下形成活泼中间体,如活泼酯、酰卤和酸酐等;然后该中间体再对胺进行酰化。数以百计的此类活化试剂已经被开发出来,如碳二亚胺类、有机膦类、活泼酯类等[3,4]。虽然这些活化试剂在酰胺的制备中得到了广泛应用,但它们的使用存在着如下的缺点:(1)这些活化试剂以及反应中添加的碱等,都要使用化学计量的,有时甚至是大为过量的;而酰化反应完成后,它们都转变成了无用的副产物,这与当今提倡的“原子经济性”原则相违背。(2)这些活化试剂以及它们产生的副产物往往是高毒的,给酰胺的制备和应用带来很多困难。(3)很多活化试剂都是昂贵的。(4)这些活化试剂产生的副产物与酰胺的分离,有时是困难而繁琐的。上述这些缺点均与“绿色化学”的理念不相符[5],尤其是在大规模制备酰胺产物时,这些缺点就更加突出。因而就不难理解2007年“避免采用低原子经济性的试剂合成酰胺”被评选为制药工业中的一项关键挑战[6]。此外,对一些反应活性很差(如位阻很大)的底物,往往要采用剧烈的反应试剂(如将羧酸转化为酰氯)或者需要改变合成策略,从羧酸和胺以外的底物出发来形成酰胺[7]。因此,寻找并开发高效、绿色和经济的酰胺键构建方法是合成化学中亟待解决的问题[8]。硼化合物催化的直接酰胺化反应正是其中研究较多、前景最为诱人的一种方法。
作者在此对硼化合物催化的直接酰胺化反应的研究进展进行了综述,并按照硼化合物催化剂的类型进行了分类。
1 直接酰胺化反应
不添加活化试剂,而利用羧酸和胺的直接缩合来形成酰胺(即直接酰胺化反应),可以避免使用活化试剂带来的诸多缺陷,是合成酰胺的理想途径。羧酸与胺是普遍而易得的底物,直接酰胺化反应的副产物只有水,而无其它废弃物。但是羧酸与胺混合时会形成羧酸铵盐,阻碍了酰胺的形成[9](图1)。虽然对于直接酰胺化反应,很早就有一些报道[10,11],但均需要长时间的高温(>160℃)加热,且反应只适用于某些特定的羧酸或胺,使其未能推广成为普遍采用的酰胺合成方法。
近年来出现的一系列催化剂可以使直接酰胺化反应的条件变得较为温和,并能拓展到一般酰胺键的形成上。这些催化剂包括过渡金属化合物[12]、非金属氧化物[13]和硼化合物等,其中硼化合物是最有潜力的一类催化剂。硼化合物作为化学计量的试剂,参与促进酰胺键的形成很早就有报道[14,15]。而硼化合物催化的直接酰胺化反应,虽然在早期专利中有所报道,但其方法仅局限于合成特殊类型的酰胺化合物,并未引起关注[16]。自1996年Ishihara等报道取代的苯硼酸可以催化一般的羧酸和胺的直接缩合反应后,硼化合物催化的直接酰胺化反应领域才开始受到研究者的普遍关注。
图1 羧酸与胺直接缩合形成酰胺Fig.1 Amide from direct condensation between carboxylic acid and amine
2 硼化合物催化的直接酰胺化反应
催化剂Ⅰ可以从1-溴-3,4,5-三氟苯出发,先制成Grignard试剂,再与硼酸三甲酯反应,进而水解得到。
催化剂Ⅰ可以催化一系列羧酸与胺的直接酰胺化反应,对于反应性较差的底物(如苯甲酸、苯胺)以及位阻很大的1-金刚烷甲酸,以高沸点(165℃)的均三甲苯代替甲苯(沸点111℃)作为共沸溶剂可以得到更满意的结果。催化剂Ⅰ的反应机理如图3所示[18]。

图3 催化剂Ⅰ的可能反应机理Fig.3 Proposed catalytic principle for catalyst I
2.1 芳基硼酸作为催化剂
芳基硼酸(Arylboronic acid)具有特异的反应活性、稳定性、易得性和低毒性,是Suzuki偶联、Chan-Lam偶联反应的重要底物,广泛应用于催化反应、药物、小分子识别等领域[17]。
2.1.1 含氟取代基的芳基硼酸催化剂
Ishihara等[18,19]发现,在甲苯共沸脱水条件下,间位与对位带有吸电子基的苯硼酸可以很好地催化直接酰胺化反应,其中3,4,5-三氟苯硼酸(Ⅰ)的催化活性最高(图2)。

图2 苯环上取代基对催化活性的影响Fig.2 Effect of substituents on catalytic activity
一般情况下,芳基硼酸(其中含有一定量的芳基硼酸酐)与羧酸反应可以生成单酰氧基硼酸(Ⅱ)(可视作羧酸与芳基硼酸的混合酸酐)。化合物Ⅱ中的分子内氢键和缺电子的硼可以活化羧基碳,有利于胺的亲核进攻。
催化剂Ⅰ也可用于尼龙66和其它聚酰胺的合成。例如,以摩尔分数为10%的化合物Ⅰ作为催化剂,己二酸与己二胺在间甲酚与邻二甲苯的混合溶剂(体积比1∶4)中回流脱水20h,可以得到数均分子量(Mn)和质均分子量(MW)分别为4690和22 400的尼龙66[20]。
2.1.2 可以重复利用的芳基硼酸催化剂
在催化剂Ⅰ的基础上,研究者又开发了一些可以重复利用的直接酰胺化催化剂,如图4所示。
含有全氟代烃基的催化剂Ⅲ在氟二相体系中可以很好地催化直接酰胺化反应,反应结束后,通过氟相和普通有机相的分离,可以使氟相中的催化剂Ⅲ得到完全回收和再利用[21]。
正离子芳基硼酸(Ⅳ)可以在苯甲醚、乙腈和N-甲基吡咯烷酮(NMP)等极性溶剂中使用,解决了催化剂Ⅰ无法适用于极性溶剂的缺陷。利用离子液体1-乙基-3-甲基咪唑三氟甲磺酸盐([emim][OTf])与甲苯的二相体系可以实现催化剂Ⅳ的重复利用[22]。
图4 可重复利用的芳基硼酸催化剂Fig.4 Reusable arylboronic acid catalysts
与聚苯乙烯结合的催化剂Ⅴ在甲苯中反应结束后,经简单过滤、洗涤就可以重复利用,其中Ⅴc重复利用10次后,其催化活性无明显下降[22]。
2.1.3 氨基硼酸类催化剂
Georgiou等[23]研究了氨基硼酸类化合物对直接酰胺化反应的催化活性。以沸点较低(85℃)的氟苯作为共沸溶剂,在无催化剂的条件下,苯甲酸与苄胺或4-苯基丁胺在氟苯中除水回流并不能生成相应的酰胺;而以自行合成的氨基硼酸Ⅵ(图5)可以有效地催化酰胺的生成,氮原子上位阻更大的Ⅵa的活性较Ⅵb要高,且二者活性都高于催化剂Ⅰ[24]。

图5 氨基硼酸类催化剂Fig.5 Aminoboronic acid catalysts
Arnold等[25]考察了苯环上不同取代基对催化活性的影响,结果发现,催化活性的顺序是Ⅷ>Ⅵa>ⅦaⅦb,即当硼原子的对位引入吸电子基时催化活性会增强;而当Ⅵa中硼的另一个邻位也被取代时,催化活性会下降,尤其是邻位引入供电子基时催化活性会大大减弱。
2008年,Arnold等[26]报道了第一例不对称的直接酰胺化反应。外消旋的α-甲基苄胺与非手性的羧酸在基于二茂铁的手性氨基硼酸Ⅸ的催化下,选择性地得到一种对映体过量的手性酰胺(图6)。虽然,对映体的选择性还不高,但这是第一次通过动力学拆分外消旋胺来实现不对称酰胺化,意义重大。

图6 催化剂Ⅸ催化的不对称直接酰胺化反应Fig.6 Asymmetric direct amidation catalyzed by catalystⅨ
2.1.4 邻碘代芳基硼酸类催化剂
Al-Zoubi[27]等通过对45种芳基硼酸的筛选,发现邻卤代苯硼酸在以二氯甲烷为溶剂、4分子筛为吸水剂的条件下,室温下就可以很好地催化羧酸与胺的直接缩合。其中尤以邻碘苯硼酸(Ⅹ)的催化活性最好,且这些邻卤代苯硼酸的活性顺序是I>Br>Cl>F(图7)。而当硼的另一个邻位也被卤素取代时,催化活性会明显下降,这一结果与Whiting等对氨基硼酸催化剂Ⅵa苯环上取代基效应的研究结果类似。

图7 邻卤代苯硼酸催化活性的比较Fig.7 Comparison of catalytic activity for ortho-halophenylboronic acids
最近,Gernigon等[28]在催化剂Ⅹ的基础上,对其结构进行了优化,以提高催化活性。首先,参照催化剂Ⅹ,在邻卤代苯硼酸的苯环上引入吸电子基,以提升催化活性,制备了含氟的催化剂Ⅺ,但催化剂Ⅺ的活性反而低于催化剂Ⅹ;随后Gernigon等又合成了带有供电子基的催化剂Ⅻ,但其催化活性与催化剂Ⅹ相比也未能提高(图8)。
图8 吸电子与供电子取代基对催化剂Ⅹ催化活性的影响Fig.8 Effect of electron-withdraw/-given substituent on catalytic activity of catalystⅩ
通过比较催化剂Ⅹ、Ⅺ和Ⅻ,发现在碘原子上保持较高的电子密度、同时不让硼原子上电子密度过高,可能会提高催化剂的活性。由此合成了碘的对位带有供电子取代基的催化剂ⅩⅢ(2-碘-5-甲氧基苯硼酸)和ⅩⅣ。研究发现它们与邻碘苯硼酸催化剂Ⅹ相比,催化活性有了显著提升,其中催化剂ⅩⅢ的活性最高。但若在催化剂ⅩⅢ上再引入吸电子基后,催化活性反而下降(图9)。
图10 催化剂Ⅹ与ⅩⅢ的可能催化机理Fig.10 Proposed catalytic principle for catalystⅩand catalystⅩⅢ
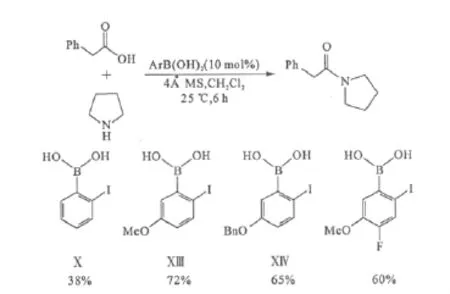
图9 碘的对位有供电子基的苯硼酸与催化剂Ⅹ的催化活性比较Fig.9 Activity comparison between arylboronic acids with electron-given groups parato iodine and catalystⅩ
计算化学研究表明,邻卤代苯硼酸对直接酰胺化反应显著的催化活性是由于其中的卤原子作为氢键供体,稳定了反应过渡态;且碘参与形成氢键的能力要强于其它卤素原子[29]。催化剂Ⅹ和ⅩⅢ相比,ⅩⅢ中碘原子上电子密度更高,使其形成的I-H更强,从而其参与的过渡态的能量较催化剂Ⅹ更低,因而其催化活性更高(图10)。
2.2 硼酸作为催化剂
硼酸(Boric acid)是一种廉价易得、性质稳定、环境友好的物质,近年来作为有机反应的催化剂引起了研究者的普遍兴趣[30,31]。Tang[32]报道了硼酸催化直接酰胺化反应。在摩尔分数为1%的硼酸催化下,4-苯基丁酸和苄胺在甲苯中回流分水16h,经简单后处理可得到收率91%的N-苄基-4-苯基丁酰胺。反应机理可能是:硼酸与羧酸先形成如化合物Ⅱ的混合酸酐,再与胺反应得到酰胺,并重新生成硼酸。
硼酸作为直接酰胺化反应的催化剂,用于制备一些结构较为复杂的药物活性成分(API)时,用量要提高到10%(摩尔分数)(图11)[33]。

图11 以硼酸为催化剂合成药物活性成分(API)Fig.11 Preparation of API catalyzed by boric acid
在此过程中醇羟基并不受影响,无需保护,且底物中的手性中心也不受影响。因此,硼酸催化的直接酰胺化反应为酰胺的制备,尤其是工业上大规模制备酰胺化合物,提供了一条成本低廉、过程简便的途径。
此外,羧酸与邻苯二胺在硼酸的催化下先形成酰化中间体ⅩⅤ,再缩合环化,生成2-取代的苯并咪唑类化合物(图12)。
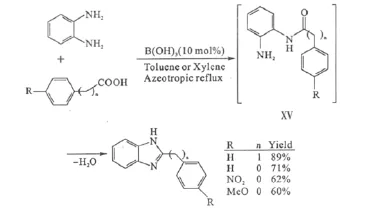
图12 硼酸催化的2-取代苯并咪唑化合物的合成Fig.12 Synthesis of 2-substituted benzimidazoles catalyzed by boric acid
传统上此类化合物的合成都需要在强酸性或高温(约200℃)条件下进行,因此,硼酸催化的缩合环化为此类化合物的制备提供了一条温和的方法,尤其适用于对酸性条件敏感的底物[34]。
2.3 其它硼化合物作为催化剂
Maki等[35]合成了基于四氯代邻苯二酚的催化剂ⅩⅥa和ⅩⅥb。ⅩⅥa对一些大位阻的羧酸(如叔丁基甲酸、1-金刚烷甲酸等)显示出很好的催化活性(图13)。

图13 基于四氯代邻苯二酚的催化剂ⅩⅥFig.13 CatalystⅩⅥ based on tetrachlorocatechol
ⅩⅥb可以通过四氯代邻苯二酚和硼酸在直接酰胺化反应前现场制备。对于芳基硼酸类催化剂,往往制备上较为困难,限制了其应用,但ⅩⅥb制备十分简便,且可以替代四氯代邻苯二酚的二酚、二醇和二酸的结构非常多,应用前景广阔。
此外,在早期的专利中还报道了其它硼化合物,如偏硼酸(HBO2)、氧化硼(B2O3)、三氟化硼-乙醚络合物等也具有与硼酸相似的催化直接酰胺化反应的能力[16]。但是这些硼化合物对一般酰胺键形成的催化作用还有待进一步研究。
3 结语
从最初需要在回流条件下起作用的催化剂Ⅰ,到在室温下就可以方便使用的催化剂Ⅹ和ⅩⅢ,硼化合物催化的直接酰胺化为酰胺的合成提供了全新途径。该途径具有原子经济、过程简便和成本低廉的特点,其中硼酸催化剂已可以应用到酰胺化合物的工业化大规模制备中。但对于更广范围的应用,还需要研究者进一步提升这些催化剂的活性,拓宽其适用的底物范围,并使反应条件变得更加温和;同时还需要对此类反应的机理进行深入的研究,以便能更好地指导催化剂的设计与优化。相信在不远的未来,硼化合物催化的直接酰胺化能够成为实验室与工业上都广泛采用的绿色、高效、简便的酰胺合成方法。
[1]Roughley S D,Jordan A M.The medicinal chemist′s toolbox:An analysis of reactions used in the pursuit of drug candidates[J].J Med Chem,2011,54(10):3451-3479.
[2]March J,Smith M B.Advanced Organic Chemistry(6th ed)[M].New Jersey:John Wiley & Sons,2007:1841-1842.
[3]El-Faham A,Albericio F.Peptide coupling reagents,more than a letter soup[J].Chem Rev,2011,111(11):6557-6602.
[4]Montalbetti C A G N,Falque V.Amide bond formation and peptide coupling[J].Tetrahedron,2005,61(46):10827-10852.
[5]陆熙炎.绿色化学与有机合成及有机合成中的原子经济性[J].化学进展,1998,10(2):123-130.
[6]Constable D J C,Dunn P J,Hayler J D,et al.Key green chemistry research areas—A perspective from pharmaceutical manufacturers[J].Green Chem,2007,9:411-420.
[7]Schfer G,Matthey C,Bode J W.Facile synthesis of sterically hindered and electron-deficient secondary amides from isocyanates[J].Angew Chem Int Ed,2012,51(36):9173-9175.
[8]Pattabiraman V R,Bode J W.Rethinking amide bond synthesis[J].Nature,2011,480:471-479.
[9]Charville H,Jackson D A,Hodges G,et al.The uncatalyzed direct amide formation reaction——Mechanism studies and the key role of carboxylic acid H-bonding[J].Eur J Org Chem,2011,2011(30):5981-5990.
[10]Mitchell J A,Reid E E.The preparation of aliphatic amides[J].J Am Chem Soc,1931,53(5):1879-1883.
[11]Webb C N.Benzanilide[J].Org Synth,1927,7:6-7.
[12]Lundberg H,Tinnis F,Adolfsson H.Direct amide coupling of nonactivated carboxylic acids and amines catalysed by zirconium(Ⅳ)chloride[J].Chem Eur J,2012,18(13):3822-3826.
[13]Comerford J W,Clark J H,Macquarrie D J,et al.Clean,reusable and low cost heterogeneous catalyst for amide synthesis[J].Chem Commun,2009,(18):2562-2564.
[14]Nelson P,Pelter A.Trisdialkylaminoboranes:New reagents for the synthesis of enamines and amides[J].J Chem Soc,1965:5142-5144.
[15]Sowa F J,Nieuwland J A.Organic reactions with boron fluoride.ⅩⅣ.The reaction of amides with acids and amines[J].J Am Chem Soc,1937,59(7):1202-1203.
[16]Ikeda T,Higuchi S,Hashimoto K,et al.Production of N-acylaminoacid amides[P].JP 61 000 050A,1986-01-06.
[17]Hall D G.Boronic Acids:Preparation and Applications in Organic Synthesis and Medicine[M].Weinheim:Wiley-VCH,2005:1-99.
[18]Ishihara K,Ohara S,Yamamoto H.3,4,5-Trifluorobenzeneboronic acid as an extremely active amidation catalyst[J].J Org Chem,1996,61(13):4196-4197.
[19]Ishihara K,Ohara S,Yamamoto H.(3,4,5-Trifluorophenyl)boronic acid-catalyzed amide formation from carboxylic acids and amines:N-benzyl-4-phenylbutyramide[J].Org Synth,2002,79:176-185.
[20]Ishihara K,Ohara S,Yamamoto H.Direct polycondensation of carboxylic acids and amines catalyzed by 3,4,5-trifluorophenylboronic acid[J].Macromolecules,2000,33(10):3511-3513.
[21]Ishihara K,Kondo S,Yamamoto H.3,5-Bis(perfluorodecyl)phenylboronic acid as an easily recyclable direct amide condensation catalyst[J].Synlett,2001,(9):1371-1374.
[22]Maki T,Ishihara K,Yamamoto H.N-Alkyl-4-boronopyridinium salts as thermally stable and reusable amide condensation catalysts[J].Org Lett,2005,7(22):5043-5046.
[23]Georgiou I,Ilyashenko G,Whiting A.Synthesis of aminoboronic acids and their applications in bifunctional catalysis[J].Acc Chem Res,2009,42(6):756-768.
[24]Arnold K,Davies B,Giles R L,et al.To catalyze or not to catalyze?Insight into direct amide bond formation from amines and carboxylic acids under thermal and catalyzed conditions[J].Adv Synth Catal,2006,348(7-8):813-820.
[25]Arnold K,Batsanov A S,Davies B,et al.Synthesis,evaluation and application of novel bifunctional N,N-diisopropylbenzylamine-boronic acid catalysts for direct amide formation between carboxylic acids and amines[J].Green Chem,2008,10(1):124-134.
[26]Arnold K,Davies B,Herault D,et al.Asymmetric direct amide synthesis by kinetic amine resolution:A chiral bifunctional aminoboronic acid catalyzed reaction between a racemic amine and an achiral carboxylic acid[J].Angew Chem Int Ed,2008,47(14):2673-2676.
[27]Al-Zoubi R M,Marion O,Hall D G.Direct and waste-free amidations and cycloadditions by organocatalytic activation of carboxylic acids at room temperature[J].Angew Chem Int Ed,2008,47(15):2876-2879.
[28]Gernigon N,Al-Zoubi R M,Hall D G.Direct amidation of carboxylic acids catalyzed by ortho-iodo arylboronic acids:Catalyst optimization,scope,and preliminary mechanistic study supporting apeculiar halogen acceleration effect[J].J Org Chem,2012,77(19):8386-8400.
[29]Marcelli T.Mechanistic insights into direct amide bond formation catalyzed by boronic acids:Halogens as Lewis bases[J].Angew Chem Int Ed,2010,49(38):6840-6843.
[30]Kondaiah G C M,Reddy L A,Babu K S,et al.Boric acid:An efficient and environmentally benign catalyst for transesterification of ethyl acetoacetate[J].Tetrahedron Lett,2008,49(1):106-109.
[31]Nguyen T B,Sorres J,Tran M Q,et al.Boric acid:A highly efficient catalyst for transamidation of carboxamides with amines[J].Org Lett,2012,14(12):3202-3205.
[32]Tang P.Boric acid catalyzed amide formation from carboxylic acids and amines:N-Benzyl-4-phenylbutyramide[J].Org Synth,2005,81:262-272.
[33]Mylavarapu R K,Kondaiah G C M,Kolla N,et al.Boric acid catalyzed amidation in the synthesis of active pharmaceutical ingredients[J].Org Proc Res Dev,2007,11(6):1065-1068.
[34]MaraN,Kocevar M.Boric acid-catalyzed direct condensation of carboxylic acids with benzene-1,2-diamine into benzimidazoles[J].Helv Chim Acta,2011,94(10):1860-1874.
[35]Maki T,Ishihara K,Yamamoto H.4,5,6,7-Tetrachlorobenzo[d][1,3,2]dioxaborol-2-ol as an effective catalyst for the amide condensation of sterically demanding carboxylic acids[J].Org Lett,2006,8(7):1431-1434.
