粘质沙雷氏菌G1利用玉米浆干粉和磷酸氢二铵生产2,3-丁二醇的研究
2013-08-14郝英利张燎原孙建安魏东芝周文瑜沈亚领朱家文
郝英利,张燎原,孙建安,魏东芝,周文瑜,沈亚领,朱家文
(1.华东理工大学 生物反应器工程国家重点实验室 鲁华生物技术研究所,上海200237;2.华东理工大学化工分离研究所,上海200237)
随着储量有限的传统能源的日益匮乏,新兴的可再生生物能源引起人们越来越多的重视。2,3-丁二醇(2,3-Butanediol,BD)具 有 高 燃 烧 值 (27 200kJ·kg-1)和低冰点,是一种优良的低温环境下的燃料添加剂[1,2]。2,3-丁二醇用途十分广泛:可以制备多种衍生物,脱水可生成甲乙酮,是广泛应用于电子元件清洗、涂料、染料、印刷油墨、炼油等多个领域的工业溶剂[3-5];脱水转化生成1,3-丁二烯,是合成橡胶的重要前体[6,7];脱氢转化生成3-羟基-2-丁酮(乙偶姻,AC),是具有多种用途的天然食用香料[8];和乙酸可催化合成2,3-丁二醇二乙酸酯,广泛应用于奶制品行业中,用于改善风味[9,10];通过 Diels-Alder反应可转化为苯乙烯[11];合成聚氨酯泡沫材料,广泛应用于洗涤剂、药品、化妆品等多个领域[12];是一种优良的白酒风味添加剂,适当添加可大大提高酒类的口感[1]。
由于2,3-丁二醇具有2个手性碳原子、3种同分异构体,生物法制备2,3-丁二醇极具优势,因而得到了广泛的研究,高产2,3-丁二醇的报道[13]也比较多。然而,多数研究利用的是昂贵的实验级有机氮源[14],价格较高、不利于工业化生产。
作者在此利用基因改造过的粘质沙雷氏菌G1,以玉米浆干粉(CSLP)和磷酸氢二铵[(NH4)2HPO4]为氮源发酵生产2,3-丁二醇,降低了培养基的成本,为工业化生产奠定了基础。
1 实验
1.1 菌种和培养基
出发菌株:粘质沙雷氏菌(Serratia marcescens)G1,实验室保藏,保存于-80℃甘油管中。
斜面培养基(g·L-1):葡萄糖20,酵母粉10,蛋白胨5,琼脂20,以NaOH调pH 值7.2。
种子培养基(g·L-1):葡萄糖10,酵母粉1,蛋白胨2,(NH4)2SO46,KH2PO410,NaCl 0.5,MgSO40.5,以 NaOH 调pH 值7.2,115℃灭菌20min。
发酵基础培养基(g·L-1):蔗糖90,酵母粉30,(NH4)2HPO43,NaAc 4,柠檬酸钠14,MgSO40.5,FeSO40.02,MnSO40.01。
1.2 培养方法
1.2.1 种子培养
在250mL摇瓶中装入30mL种子培养基,接一甘油管种子至种子培养基中,于30℃、200r·min-1下摇床培养12h。
1.2.2 摇瓶发酵培养
按5%(体积比)的接种量转接种子至装有50mL发酵培养基的250mL摇瓶中,于30℃、200r·min-1下摇床培养。
1.2.3 分批补料发酵培养
取100mL种子液接种于3.7L比欧发酵罐(KL F2000),起始装液量为2L,转速为300r·min-1,通气量为0.8VVm,初始糖浓度为90g·L-1,当残糖(RG)浓度低于5g·L-1时,用蠕动泵补料补入800g·L-1蔗糖溶液,控制蔗糖浓度5~10g·L-1。
1.3 实验设计
工业氮源的初筛:分别以价格低廉的工业氮源复合氨基酸、黄豆饼粉、可溶性氮源、玉米浆干粉替代酵母粉配制发酵培养基,4种氮源的浓度均为30g·L-1。
培养基的优化:配制不同浓度玉米浆干粉发酵培养基进行单因素实验;应用Minitab软件系统设计Plackett-Burman(PB)实 验 优 化 玉 米 浆 干 粉、(NH4)2HPO4及无机盐的配比;根据PB实验结果确定爬坡步长,设计爬坡实验;根据爬坡实验结果,应用Minitab软件系统,进行中心组合设计和响应面设计,进行2因子5水平的组合实验。
发酵罐验证:采用恒底物浓度策略[14]进行实验。
1.4 分析方法
菌体浓度测定:采用UV22008H 型分光光度计(Unic)在波长600nm处测定OD600。
发酵液中残糖[14,15]测定:将样品离心,取上清液用2mol·L-1H2SO4溶液水解,再用4mol·L-1NaOH溶液中和,用葡萄糖液体试剂盒(上海捷门生物技术公司)测定葡萄糖的浓度,再换算成残糖浓度。
产物[14,15]测定:用 Aglient GC9860型气相色谱仪测定AC和BD的浓度。色谱柱采用毛细管柱DB-5,FID氢火焰检测器,氮气作为载气,流速为1mL·min-1,柱温为50℃保留115min、然后25℃·min-1程序升温到180℃保留10min,进样口温度为215℃,检测器温度为245℃。发酵液离心后用乙酸乙酯萃取,再用气相色谱仪测定浓度,最后根据标准曲线计算产物浓度。
2 结果与讨论
2.1 工业氮源的筛选(图1)

图1 不同工业氮源对产物的影响Fig.1 Effect of different industrial nitrogen sources on product
由图1可知,复合氨基酸作为氮源时,生物量较低;黄豆饼粉和可溶性氮源作为氮源时,产物浓度较低,杂质较多;玉米浆干粉作为氮源时,不仅能够满足菌体的生长,而且利于2,3-丁二醇的积累。因此,后续实验选择玉米浆干粉作为培养基氮源。
2.2 单因素实验(图2)

图2 玉米浆干粉浓度对产物的影响Fig.2 Effect of CSLP concentration on product
由图2可知,玉米浆干粉浓度在20g·L-1左右时已经可以满足菌体生长、产物合成的需要。
2.3 Plackett-Burman实验筛选培养基中显著因素
应用Minitab软件系统设计PB实验筛选发酵培养基显著因素,实验因素与水平见表1,实验设计与结果见表2。

表1 PB实验因素与水平/g·L-1Tab.1The factors and levels of PB experiment/g·L-1

表2 PB实验设计与结果Tab.2 The design and results of PB experiment
PB实验数据经Minitab 15.0软件分析得到拟合方程如下:
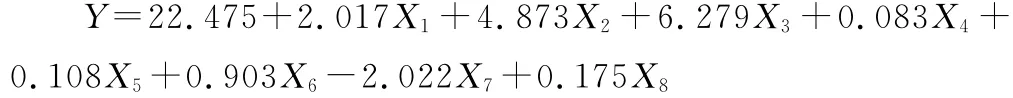
式中:Y 为2,3-丁二醇浓度,g·L-1。
PB 实 验 的 R-Sq为 99.03%、R-Sq(adj.)为96.44%,说明模型对产物水平的变化有良好拟合度。其中玉米浆干粉、(NH4)2HPO4的P值分别为0.014与0.007,说明玉米浆干粉与(NH4)2HPO4对2,3-丁二醇浓度的影响最显著。
2.4 爬坡实验
爬坡实验中玉米浆干粉与(NH4)2HPO4的浓度变化按照PB实验结果逐步增加。步长(4.873,6.279)近似为(1,1.25),即玉米浆干粉浓度每增加1个单位(4g·L-1),(NH4)2HPO4增加1.25g·L-1,结果如图3所示。

图3 爬坡实验结果Fig.3 Results of the steepest ascent experiment
由图3可知,随着玉米浆干粉浓度的增大,蔗糖的消耗速率逐渐加快,2,3-丁二醇的浓度不断提高;当玉米浆干粉浓度大于20g·L-1、(NH4)2HPO4浓度大于7g·L-1时,菌体的生长和代谢逐渐受到抑制。这是因为,高浓度的(NH4)2HPO4会产生游离的氨,对细胞有毒性,造成了对生长和代谢的抑制。
2.5 中心组合和响应面实验
玉米浆干粉(X1)和(NH4)2HPO4(X2)的中心点分别取20g·L-1和7g·L-1,其它培养基组分(g·L-1)如下:蔗糖90、NaAc 4、柠檬酸钠14、MgSO40.5、FeSO40.02、MnSO40.01,进行中心组合实验,其设计和结果见表3。

表3 中心组合实验设计与结果Tab.3 The design and results of the central composition experiment
中心组合实验数据分析经 Minitab 15.0软件分析得到拟合方程如下:
Y=42.7406+0.9245 X1+0.2210 X2-1.52 X21-1.0502 X+0.0313 X1X2
式中:Y 为2,3-丁二醇浓度,g·L-1。
中心组合实验的R-Sq为96.43%、R-Sq(adj.)为93.88%,表明模型可以解释93.88%的发酵水平的变化。根据回归方程,利用Minitab 15.0软件绘制响应面立体图,见图4。

图4 响应面立体图Fig.4 The three-dimensional graph for the response surface
由图4可以看出,两个因素之间交互作用不显著,最佳点落在实验考察的区域内。为了进一步求证最佳点的值,对回归方程求一阶偏导,通过回归方程计算得到最优的培养基组分浓度为:玉米浆干粉20.32g·L-1、(NH4)2HPO47.21g·L-1,2,3-丁二醇浓度预测值为42.74g·L-1。由此确定的优化培养基(g·L-1)为:蔗糖90,玉米浆干粉20.32,(NH4)2HPO47.21,NaAc 4,柠檬酸钠14,MgSO40.5,FeSO40.02,MnSO40.01。
为验证响应的最优值的可信度,共进行了3批验证实验,18h时的2,3-丁二醇浓度分别为43.72g·L-1、42.45g·L-1和43.02g·L-1,平均值为43.06 g·L-1,与预测值42.74g·L-1基本吻合。
2.6 发酵罐验证实验
在3.7L发酵罐中采用上述优化培养基进行验证实验,结果见图5。

图5 粘质沙雷氏菌G1的分批补料发酵结果Fig.5 The fed-batch fermentation result of Serratia marcescens G1
由图5可以看出,AC浓度为8.35g·L-1、2,3-丁二醇浓度为128.28g·L-1,2,3-丁二醇的产率为2.67g·L-1·h-1、转化率为0.48g·g-1蔗糖。表明以玉米浆干粉、(NH4)2HPO4为氮源,能够大大降低2,3-丁二醇工业化生产中培养基原料的成本,提高了工业化的经济可行性。
2.7 讨论
为了提高工业化生产2,3-丁二醇的经济可行性,可以采取多种方法,如传统的筛选高产菌株、基因改造高产菌株[16]、设计优化便宜有效的培养基等。本研究采用的粘质沙雷氏菌G1菌株为基因工程菌,具有副产物浓度低、发酵过程气泡少、无红色素等特点。副产物浓度低,从发酵原理上简化了发酵控制难度;发酵过程气泡少,从实际操作上降低了发酵控制的难度;菌体不产红色素,有利于发酵液的后续处理。上述特点使得该菌株非常适于工业化生产。
在之前的基础研究中[14],实验采用较为昂贵的实验级有机氮源,不利于工业化生产,本研究从2,3-丁二醇工业化生产的角度出发,筛选了多种工业氮源,最终确定玉米浆干粉和(NH4)2HPO4为氮源。
玉米浆干粉是玉米深加工行业的主要副产品,来源丰富、价格便宜[17],其中含有47%的粗蛋白,实验表明玉米浆干粉能够满足菌体生产和转化的需要,有利于积累较高的产物浓度。(NH4)2HPO4作为农用肥具有价格低、供应大、含氮量高等特点,可作为有机氮源的有力补充,满足菌体的生长,且磷酸根能够刺激2,3-丁二醇的合成[18]。
优化后的培养基配方除糖外,只有少量的玉米浆干粉和便宜的无机盐,降低了培养基的成本,为2,3-丁二醇的规模化、工业化生产奠定了坚实的基础。
3 结论
筛选玉米浆干粉和(NH4)2HPO4作为粘质沙雷氏菌G1发酵产2,3-丁二醇的氮源,通过PB实验、中心组合和响应面实验确定最优培养基组成(g·L-1)为:蔗糖90,玉米浆干粉20.32,(NH4)2HPO47.21,NaAc 4,柠檬酸钠 14,MgSO40.5,FeSO40.02,MnSO40.01。摇瓶发酵和分批补料发酵结果表明以玉米浆干粉和(NH4)2HPO4作氮源,2,3-丁二醇浓度较高,培养基的成本大幅降低,为工业化生产奠定了基础。
[1]Garg S K,Jain A.Fermentative production of 2,3-butanediol:A review[J].Bioresource Technology,1995,51(2-3):103-109.
[2]Yu E K C,Levitin N,Saddler J N.Production of 2,3-butanediol by Klebsiella pneumoniae grown on acid hydrolyzed wood hemicellulose[J].Biotechnology Letters,1982,4(11):741-746.
[3]朱青芳.甲乙酮的合成方法及生产消费情况[J].医药化工,2007,(3):33-37.
[4]司航.化工产品——有机化工原料[M].北京:化学工业出版社,1999:35-39.
[5]程能林.溶剂手册[M].北京:化学工业出版社,1994:123-125.
[6]王迪,王凡强,王建华.发酵法生产2,3-丁二醇[J].精细与专用化学品,2000,(7):20-21.
[7]Long S K,Patrick R.The present status of the 2,3-butylene glycol fermentation[J].Advances in Applied Microbiology,1963,5:135-155.
[8]李卫凡,邓铎杰,徐少华,等.聚氨酯的研究进展[J].江西化工,2007,(3):46-48.
[9]Yang C H,Li Y J,Wen T C.Mixture design approach to PEGPPG-PTMG ternary polyol-based waterborne polyurethanes[J].Industrial & Engineering Chemistry Research,1997,36(5):1614-1621.
[10]陕西省化工研究院,聚氨酯弹性体手册 [M].北京:化学工业出版社,2001:99-101.
[11]Alam S,Capit F,Weigand W A,et al.Kinetics of 2,3-butanediol fermentation by Bacillus amyloliquefaciens:Effect of initial substrate concentration and aeration[J].Journal of Chemical Technology & Biotechnology,1990,47(1):71-84.
[12]Petrini P,Ponti S,Fare S,et al.Polyurethane-maleamides for cardiovascular applications:Synthesis and properties[J].Journal of Materials Science:Materials in Medicine,1999,10(12):711-714.
[13]Syu M J.Biological production of 2,3-butanediol[J].Applied Microbiology Biotechnology,2001,55(1):10-18.
[14]Zhang L Y,Yang Y L,Sun J A,et al.Microbial production of 2,3-butanediol by a mutagenized strain of Serratia marcescens H30[J].Bioresource Technology,2010,101(6):1961-1967.
[15]杨云龙,张燎原,孙建安,等.粘质沙雷氏菌利用蔗糖和柠檬酸铵生产2,3-丁二醇的研究[J].化学与生物工程,2009,26(9):41-44.
[16]Zhang L Y,Sun J A,Hao Y L,et al.Microbial production of 2,3-butanediol by a surfactant(serrawettin)-deficient mutant of Serratia marcescens H30[J].Journal of Industrial Mcirobiology and Biotechnology,2010,37(8):857-862.
[17]Parekh M,Formanek J,Blaschek H P.Pilot-scale production of butanol by Clostridium beijerinckii BA101using a low-cost fermentation medium based on corn steep water[J].Applied Microbiology and Biotechnology,1999,51(2):152-157.
[18]Berbert-Molina M A,Sato S,Silverira M M.Ammonium phosphate as a sole nutritional supplement for the fermentative production of 2,3-butanediol from sugar cane juice[J].Z Naturforsch,2001,56(9-10):787-791.
