犬肺静脉的组织学与HCN通道的表达研究
2013-08-14胡明艳陈尚超陈曼华
胡明艳,陈尚超,陈曼华
(1.湖北省武汉市中心医院心内科 430014;2.湖北省武钢二医院神经内科 430085)
近年来,许多研究证实来源于肺静脉的快速局灶性冲动在心房颤动(以下简称房颤)的诱发及维持上起着重要的作用[1-2]。超搏电流(funny current,If)离子流是心脏起搏电流的重要组成部分,其活动增加,会导致自律性增加,容易引起快速心律失常。亚单位超极化激活的环核苷酸门控通道(hyperpolarization-activated cyclic nucleotide-gated cation channel,HCN)是可以产生类似心脏If或神经元Ih电流的一类通道基因家族,每一亚单位形成的离子通道均具有内在If的主要特征[3-4],肺静脉存在自发活动,就很可能有该通道的存在。本实验观察了犬肺静脉肌袖的基本组织结构,采用组织化学染色及分子生物学技术,从多个角度证实肺静脉中有传导细胞的存在,并探讨犬快速心房起搏后急性房颤时HCN的变化,为揭示肺静脉引发房颤的机制提供客观的依据。
1 材料与方法
1.1 动物模型建立及分组 14只健康成年犬,雌雄不限,体质量10~20kg,7只快速心房起搏作房颤组,其余7只未经快速心房起搏处理为对照组。3%戊巴比妥钠30mg/kg静脉麻醉,气管插管,必要时呼吸机辅助呼吸。沿胸骨正中切口,逐层开胸,切开心包暴露心脏。用心脏电生理刺激仪(SEN-7103型,日本产)经右心房电极给予600次/分、脉宽2ms、4倍阈值的高速心房起搏脉冲直至诱发房颤;动态记录犬肢体6导联心电图。一旦房颤自行终止则继续心房起搏诱发房颤。维持高速心房起搏/房颤8h。7只犬均诱发出房颤。处死动物,留取部分肺静脉及左心房组织,置入液氮速冻后,-80℃存放。
1.2 苏木素-伊红(HE)及高碘酸-希夫反应(PAS)染色 将对照组犬麻醉后迅速开胸,剪取左心房与肺静脉交接处向上延伸约1cm的肺静脉肌袖组织,剪去肺静脉肌袖内外膜,将组织块固定于10%中性甲醛溶液中24h后,常规脱水、透明、浸蜡、包埋,沿血管走行作纵向连续切片,厚5μm,每隔5张取1张做HE染色,其间隔的5张做PAS染色。

表1 引物序列与反应条件
1.3 逆转录-PCR(RT-PCR)测两组犬肺静脉及左心房心肌HCN1、2、4的mRNA表达 取100mg冷冻组织,用Trizol试剂一步法提取肺静脉及左心房心肌细胞的总RNA。在紫外分光光度计上测定总RNA的浓度及纯度,采用TaKaRa一步法RT-PCR试剂盒(购至大连宝生物工程有限公司),进行逆转录和PCR。总反应体系为25μL,分别依次加入总RNA1μL(≤1μg),10×缓冲液2.5μL,dNTP2.5μL,MgCl2(25mmol/L)5μL,RNA 酶抑制剂(40μ/μL)0.5μL,AVM 逆转录酶(5μ/μL)0.5μL,Taq酶(5μ/μL)0.5μL,上下游特异性引物(由上海生物工程有限公司合成)各0.5μL,加无RNA酶水至25μL。50℃30min逆转录,94℃2min预变性,开始循环:94℃变性30s,退火(温度见表1)30s,40个循环后延伸于72℃,45s;最后4℃保存10min。PCR产物经1.5%琼脂糖凝胶电泳,并采用凝胶图像分析系统,对电泳条带进行灰度计算,以βactin为参照,求出其相对值。
1.4 统计学处理 采用SPSS13.0统计软件分析,计量资料用表示,不同组间的参数比较采用t检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 HE染色检测肺静脉纤维的走行方向 肺静脉肌袖组织分为内膜层、中层和外膜层,中层较厚,心肌细胞集合成束,呈纵行、环形和斜行排列。肺静脉、尤其是肺静脉左心房交界处肌纤维的排列方向复杂,走向紊乱(图1A、B)。
2.2 PAS染色观察传导细胞 肺静脉肌袖的心内膜面可见大量PAS染色阳性的细胞(即传导细胞)。左心房与肺静脉交界处也可见PAS染色阳性的细胞,这些细胞的胞浆染色较淡,且一般比周围PAS染色阴性的细胞大(图2A~C)。
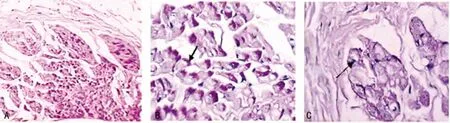
图2 PAS染色观察传导细胞
2.3 RT-PCR扩增结果 以100bp DNA Ladder的分子标记物为标志,两组犬的肺静脉与左心房组织中分别于393、313、392bp处可见扩增产物,320bp处无扩增产物,电泳带的位置分别与 HCN2、HCN4、β-actin理论值相符(图3~6)。
2.4 两组犬肺静脉及左心房中HCN1、2、4mRNA表达变化两组犬肺静脉的HCN4mRNA表达水平均明显高于左心房(P<0.05),房颤组肺静脉与左心房的 HCN2、HCN4mRNA表达水平较对照组均明显升高(P<0.05),且房颤组肺静脉中HCN2的mRNA表达水平明显高于房颤组左心房,但对照组肺静脉与左心房的HCN2mRNA表达水平差异无统计学意义(P>0.05)。见表2。
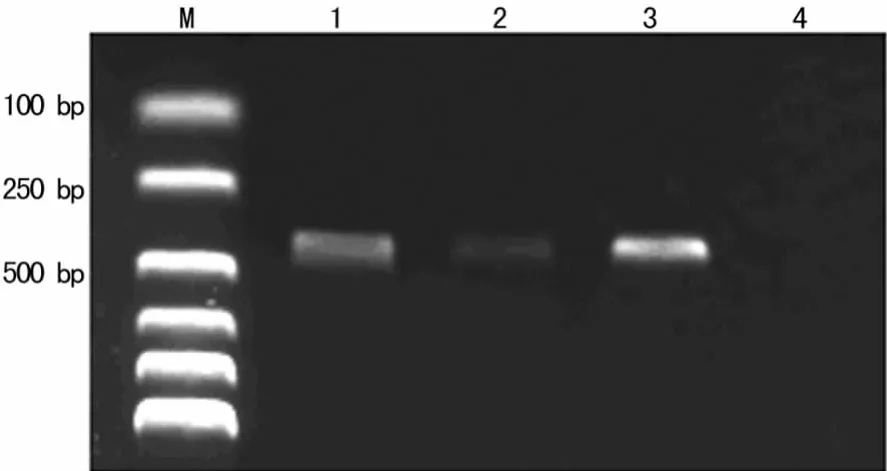
图3 对照组肺静脉各目的基因及内参的RT-PCR电泳图
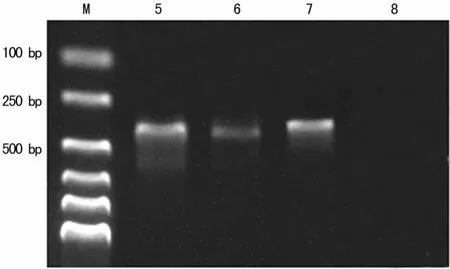
图4 对照组左心房心肌各目的基因及内参的RT-PCR电泳图
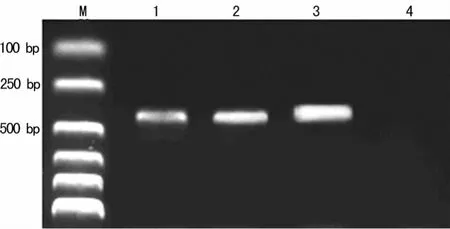
图5 房颤组肺静脉各目的基因及内参的RT-PCR电泳图
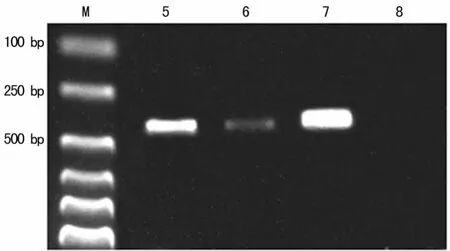
图6 房颤组左心房心肌各目的基因及内参的RT-PCR电泳图
表2 两组犬肺静脉与左心房心肌HCN1、HCN2、HCN4mRNA表达的比较(,n=7)

表2 两组犬肺静脉与左心房心肌HCN1、HCN2、HCN4mRNA表达的比较(,n=7)
-:未测到mRNA表达量;a:P<0.05,与同组左心房比较;b:P<0.05,与对照组相同部位比较。
组别 部位HCN1 HCN2 HCN4对照组 左心房 - 0.646±0.082 1.066±0.404肺静脉 - 0.562±0.081 1.567±0.042a房颤组 左心房 - 0.850±0.107b 1.795±0.032b肺静脉 - 1.230±0.088ab 2.113±0.151ab
3 讨 论
肺静脉的解剖结构与阵发性房颤的关系密切,既往有研究发现肺静脉中存在由左心房延伸到肺静脉的心肌袖,并且具有电活动[5-6]。本研究采用HE染色观察到犬肺静脉肌袖心肌纤维呈各种方向排列,但多数呈交错缠绕的非均一性排列,心肌纤维集合成束,呈环形、纵形和斜形排列。有学者认为肺静脉肌袖的心肌细胞排列混乱,可能是导致该部位电活性不均一的基础,进而易于诱发折返[7],导致房颤的发生。
起搏细胞是心脏产生起搏的基础,有研究发现,在传导组织以外的不同部位还散在、无规律地分布着单个P细胞或P细胞团[8-9]。大量动物研究已证实[10-11],肺静脉肌袖组织中存在单个或聚集分布的P样细胞,神经内分泌机制可以调节其电活动,使其易于产生自律性增高的电活动,成为异位兴奋灶,导致局灶性房颤的发生。当窦房结和心房的功能正常时,P样细胞的起搏功能被心脏正常节律所抑制。当机体神经内分泌等因素发生变化时,肺静脉肌袖组织中的P样细胞以触发或驱动机制导致房颤的发生。而肺静脉肌袖肌纤维的环形、斜行和纵行分布,使P样细胞产生的激动在肺静脉内传导方向和速度不同,产生传导延迟或阻滞,为微折返环形成创造条件,这些因素均可协同促进房颤的发生与维持。PAS染色常用于检测蒲肯野纤维及其他心肌传导细胞中的糖原[12],本实验就采用此方法在肺静脉中发现了染色阳性的细胞,初步说明肺静脉中有传导细胞的存在。这些细胞可以产生自律性的电活动,从而构成了肺静脉源性房颤的组织细胞学基础。
HCN通道有4种亚型,在哺乳动物心脏中目前发现只有HCN1、HCN2及 HCN43种亚型表达[3],它们所产生的电流均具有典型的If电流特征,然而其在肺静脉的表达及该电流在房颤中所起的作用还不是很清楚。本实验对犬肺静脉中HCN通道的mRAN表达水平进行了研究,证实了肺静脉中有该通道的存在。HCN4是产生起搏电流的主要离子通道,与传导组织的自律性细胞密切相关[13],是正常起搏电流产生的重要因素,这与本实验的结果是一致的,两组的肺静脉与左心房中都是以HCN4为主,肺静脉更高,这可能也是其If电流增高的原因之一。以往的研究表明在病理情况下If的表达是增加的。If通道mRNA在充血性心力衰竭左心房充盈压升高时表达增加,而房颤患者升高更明显,提示房颤的发生可能与If过度活动有关[14]。本实验发现房颤组肺静脉与左心房的HCN4、HCN2的mRNA表达水平均明显高于对照组,并且两组肺静脉中HCN4的mRNA表达均明显高于左心房,这种差异性可能是其离子流差异的分子基础,从而导致复极异质性,利与房颤的发生。
HCN2通道主要与非自律性的心肌相关,并与舒张期膜电位的维持有关[15],本实验发现对照组肺静脉与左心房组织中HCN2的浓度无明显差异,说明其在肺静脉心肌自发活动中可能不起关键作用。肺静脉肌袖能够产生舒张期自动除极可能并不是由单一的If电流引起,而是由于多种离子流综合作用形成的微弱内向离子流所致。但房颤组肺静脉与左心房HCN2有明显差异,这说明肺静脉的潜在起搏活性,病理状态时HCN2可能起着重要作用。当然这与取材部位的不同可能也有一定关系。HCN1通道并非心室肌和心房肌组织的主要通道亚型,其浓度很少,本实验对照组及房颤组肺静脉与左心房组织中均无HCN1的mRNA表达,这也可能是其表达量很少,本实验未能检测出。从此可以推断,房颤患者心房电重构或If增高可能不是源于HCN1转录水平的异常。本研究发现HCN通道在房颤的发生机制中可能起着重要的作用,从而为房颤的临床药物治疗提供了新靶点。
[1]Haïssaguerre M,Jaïs P,Shah DC,et al.Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins[J].N Engl J Med,1998,339(10):659-666.
[2]Barbuti A,Baruscotti M,Difrancesco D.The pacemaker current:from basics to the clinics[J].J Cardiovasc Electrophysiol,2007,18(3):342-347.
[3]Ishii TM,Takano M,Xie LH,et al.Molecular characterization of the hyperpolarization-activated cation Channel in rabbit heart sinoatrial node[J].J Biol Chem,1999,274(18):12835-12839.
[4]Robinson RB,Siegelbaum SA.Hyperpolarization-activated cation currents:from molecules to physiological function[J].Annu Rev Physiol,2003,65:453-480.
[5]DeBakker JM,Ho SY,Hocini M.Basic and clinical electrophysiology of pulmonary vein ectopy[J].Cardiovasc Res,2002,54(2):287-294.
[6]Nakajima Y,Yoshimura K,Nomura M,et al.Expression of HNK1epitope by the cardiomyocytes of the early embryonic chick:in situ and in vitro studies[J].Anat Rec,2001,263(3):326-333.
[7]Hocini M,Ho SY,Kawara T,et al.Electrical conduction in canine pulmonary veins:electrophysiological and anatomic correlation[J].Circulation,2002,105(20):2442-2448.
[8]Deruiter MC,Gittenberger-De Groot AC,Wenink AC,et al.In normal development pulmonary veins are connected to the sinus venosus segment in the left atrium[J].Anat Rec,1995,243(1):84-92.
[9]Masani F.Node-like cells in the myocardial layer of the pulmonary vein of rats:an ultrastructural study[J].J Anat,1986,145:133-142.
[10]Cheung DW.Electrical activity of the pulmonary vein and its interaction with the right atrium in the guinea-pig[J].J Physiol,1981,314:445-456.
[11]Wang B,Du RY,Zheng QS,et al.P-like cells in myocardial sleeves of pulmonary veins in dogs[J].J Fourth Milit Med Univ,2001,22(12):12-15.
[12]Block MI,Said JW,Siegel RJ,et al.Myocardial myoglobin following coronary artery occlusion.an immunohistochemical study[J].Am J Pathol,1983,111(3):374-379.
[13]Ludwig A,Zong X,Hofmann F,et al.Structure and function of cardiac pacemaker channels[J].Cell Physiol and Biochem,1999,9(4/5):179-186.
[14]Lai LP,Su MJ,Lin JL,et al.Measurement of funny current(I(f))Channel mRNA in human atrial tissue:correlation with left atrial filling pressure and atrial fibrillation[J].J Cardiovasc Electrophysiol,1999,10(7):947-953.
[15]Qu J,Kryukova Y,Potapova IA,et al.MiRP1modulates HCN2Channel expression and gating in cardiac myocytes[J].J Biol Chem,2004,279(42):43497-43502.
