HPV18E7重组质粒的构建及在大肠杆菌中的表达优化*
2013-08-14胡仁建蔡家利涂漫语杜翠容
胡仁建,蔡家利△,刘 利,涂漫语,徐 涛,杜翠容,罗 佳,丁 森
(1.重庆理工大学药学与生物工程学院 400054;2.南京大学生命科学学院 210093)
高危型人乳头状瘤病毒(human papilloma virus,HPV)持续感染宫颈是引起宫颈癌及癌前病变的直接病因[1]。HPVE7蛋白为宫颈癌发展的潜在标志物,可以用新型双抗夹心酶联免疫吸附试验(ELISA)法检测到各型HPV的重组E7蛋白以及宫颈涂片和宫颈癌细胞裂解物中的HPVE7蛋白[2]。HPV很难在体外培养成功[3-5],HPV18整合在 HeLa细胞株的染色体[3,6],本研究利用基因重组技术,构建 HPV18E7基因的重组质粒,并探索HPV18E7基因的优化表达,为探索新的简单有效的检测宫颈涂片中的HPV18E7蛋白的诊断方法奠定基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂和材料 大肠杆菌DH5α和BL21-DE3-pLysS由重庆市富进生物技术有限公司惠赠,组织/细胞DNA小量抽提试剂盒购于上海华舜生物技术有限公司,质粒抽提试剂盒和胶回收试剂盒购于OMEGA公司,质粒载体pET-32a(+)购于Novagen公司,HPV18E7引物委托上海博尚生物技术有限公司合成,工具酶PrimeSTARRHS DNA Polymerase、NcoⅠ、XhoⅠ、T4DNA Ligase等购于大连宝生物技术有限公司。
1.1.2 主要仪器 Thermo Hybaid公司的2×P梯度PCR仪,BIO-RAD电泳仪及电泳槽等。
1.2 方法
1.2.1 pET-32a(+)-HPV18E7重组质粒的构建 利用软件分析HPV18E7全基因的序列后设计一对特异性引物。以提取的HeLa细胞株的DNA为模板PCR扩增HPV18E7基因。将HPV18E7基因和载体pET-32a(+)进行酶切及连接。
1.2.2 感受态细胞的制备与重组质粒的转化 用氯化钙法制备DH5的感受态细胞,将连接后的重组质粒pET-32a(+)-HPV18E7转化感受态的大肠杆菌DH5α,同时设置阴性对照和阳性对照。
1.2.3 重组质粒的鉴定 挑选3个单菌落,提取质粒,进行了PCR鉴定、双酶切鉴定和DNA测序。
1.2.4 HPV18E7基因在大肠杆菌中的优化表达 在LB培养基中,诱导起始A600为0.6~0.8,用异丙基-β-D-硫代吡唃半乳糖苷(IPTG)和乳糖两种诱导剂,IPTG诱导浓度分别为0.1、0.2、0.5、1.0mmol/L,乳糖浓度0.10、0.25、0.50、1.00g/L,4个诱导温度:20、24、30、37℃,以空载体为空白对照,诱导前和诱导后2、4、6h取样,所有的十二烷基硫酸钠-聚丙烯酶胺凝胶(SDS-PAGE)电泳结果显示目的蛋白的表达量不高。据F.William Studier的自诱导策略的成功[7],尝试用为自诱导培养基ZYM-5052时,结果显示有大量的目的蛋白表达。
2 结 果
2.1 HPV18E7基因的PCR扩增结果 梯度PCR结果显示除64.2℃的退火温度不能扩增出目的基因以外,退火温度分别为:64.5、65.1、65.7、66.5、67.3、68.1、69.0、69.6、69.9、70.1℃均能扩增出与目标基因HPV18E7(大小为318bp)大小一致的片段,且特异性较好,无其他杂带的出现。见图1。选择69℃为退火温度大量PCR扩增目标基因HPV18E7。
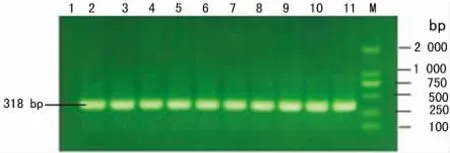
图1 HPV18E7基因的梯度PCR扩增核酸电泳图
2.2 重组质粒pET-32a(+)-HPV18E7的PCR鉴定 以3个克隆的重组质粒pET-32a(+)-HPV18E7为模板,用HPV18E7特异性引物PCR扩增HPV18E7基因,有3个克隆的重组质粒能够扩增出相对分子质量大小与HPV18E7基因一致的条带,见图2。

图2 重组质粒pET-32a(+)-HPV18E7的PCR鉴定图
2.3 重组质粒pET-32a(+)-HPV18E7的双酶切鉴定 用NcoⅠ和XhoⅠ双酶切3个经PCR鉴定有目标基因的重组质粒pET-32a(+)-HPV18E7,核酸电泳显示有与质粒pET-32a(+)和目标基因HPV18E7的相对分子质量大小一致的条带出现。见图3。
2.4 重组质粒pET-32a(+)-HPV18E7的DNA测序 先将3个经PCR鉴定和双酶切鉴定有目的基因的重组质粒pET-32a(+)-HPV18E7送大连宝生物公司测序,有2个质粒中HPV18E7序列与HeLa细胞中的HPV18E7序列一致,有1个质粒有1个碱基变异。另外提取3个质粒,DNA测序,经比对后发现这3个质粒中的目标基因HPV18E7的序列与模板HeLa细胞中的HPV18E7序列一致。选择其中任何一个质粒转化感受态的大肠杆菌BL21-DE3-pLysS制备成工程菌用于表达HPV18E7致癌蛋白。
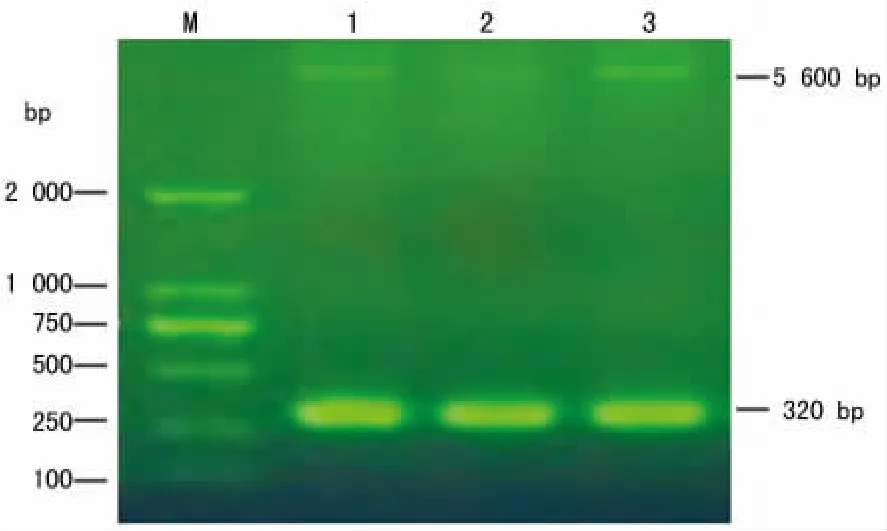
图3 重组质粒pET-32a(+)-HPV18E7的双酶切鉴定
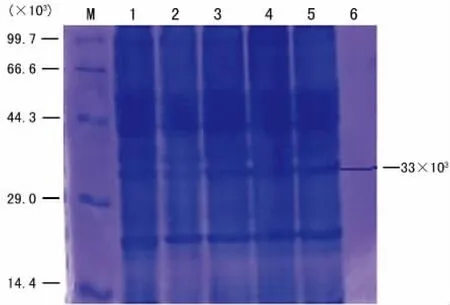
图4 用IPTG和乳糖诱导表达时无明显的HPV18E7融合蛋白出现的SDS-PAGE图
2.5 重组质粒pET-32a(+)-HPV18E7在大肠杆菌中的优化表达 在LB培养基中,用IPTG和乳糖,在不同温度、不同诱导剂浓度、不同时间等任何一个条件诱导,然后经SDS-PAGE电泳,结果显示均无明显的目的蛋白出现。见图4。在自诱导培养基ZYM-5052中,选择4个诱导温度20℃、24℃、30℃、37℃,任何一个温度的SDS-PAGE蛋白电泳显示:与空载体pET-32a(+)-BL21-DE3-pLysS相比,pET-32a(+)-HPV18E7-BL21-DE3-pLysS诱导前即0h、诱导2h未见与目标蛋白相对分子质量大小一致的条带,4h均开始出现新的相对分子质量约33×103的条带,诱导18h的量明显多于诱导4h的量,HPV18E7融合蛋白出现在上清中,显示HPV18E7基因表达的融合蛋白为可溶性表达,见图5。空载体pET-32a(+)表达的蛋白相对分子质量约为20×103,HPV18E7蛋白的相对分子质量约为13×103,重组质粒pET-32a(+)-HPV18E7表达的融合蛋白的相对分子质量大约33×103,正好与新出现的条带相对分子质量一致。
经硫酸镍亲和层析初步纯化HPV18E7融合蛋白(因为载体pET-32a(+)本身带有6个组氨酸标签,可以与硫酸镍结合),SDS-PAGE蛋白电泳显示用含50mmol/L咪唑和75 mmol/L咪唑的洗脱液不能洗脱表达的融合蛋白,用含200 mmol/L咪唑和500mmol/L咪唑的洗脱液可以洗脱,加上相对分子质量与目标蛋白的相对分子质量一致,说明500 mmol/L咪唑洗脱的蛋白为目标融合蛋白。见图6。
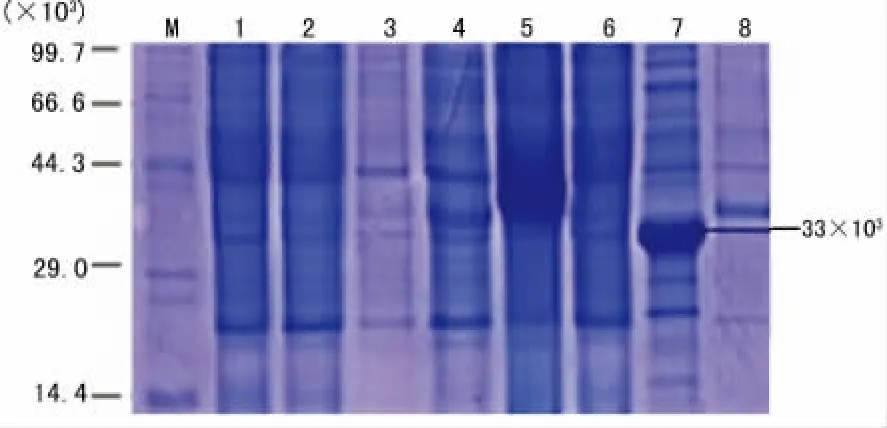
图5 ZYM-5052诱导 pET-32a(+)-HPV18 E7-BL21-DE3-pLysS表达图
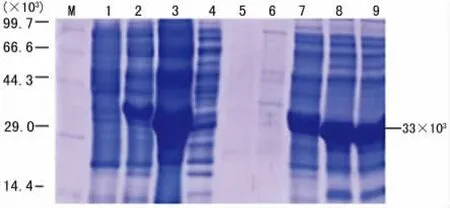
图6 硫酸镍亲和层析初步纯化HPV18E7融合蛋白的电泳图
3 讨 论
3.1 重组质粒pET-32a(+)-HPV18E7的构建构建HPV18E7基因时,设计针对HPV18E7全长基因的特异引物,目的是希望获得HPV18E7全长天然蛋白,以此天然蛋白筛选的单抗能更好特异结合宫颈涂片中表达的天然的HPV18E7蛋白。选择载体pET-32a(+)是因为它带有T7强启动子、带有融合标签(Trx.Tag、His.Tag、S.Tag等)可使目的HPV18E7蛋白可溶性的持续性表达,而且在设计引物时使表达的初始2个氨基酸(蛋氨酸和缬氨酸)为非极性氨基酸时会提高表达量。采用梯度PCR探索出最佳的退火温度并大量扩增特异HPV18E7基因,为后续的酶切、连接、鉴定等奠定基础。特别强调的是在回收PCR产物、酶切后的产物时一定要迅速,避免在紫外线下暴露时间过长会引起的点突变。
3.2 重组质粒pET-32a(+)-HPV18E7的优化表达探索pET表达系统为T7诱导系统,用IPTG诱导存在不足[8]。本研究实验证明,在LB培养中,用IPTG诱导HPV18E7基因,无论选用哪种温度、何种诱导浓度、何种起始量,以及诱导时间长短都未见有HPV18E7融合蛋白的明显表达;用传统的乳糖诱导方法无论在哪种条件下,都未见有HPV18E7基因的明显表达。美国布鲁克黑文实验室的Studier提出了自诱导表达策略这一理论并实践成功[7]。彭淑英等[9]启用自诱导表达系统提高了表达的效率。本研究采用了Studier的自诱导不固定型组分培养基ZYM-5052,的确获得大量的呈可溶性表达的HPV18E7融合蛋白,大大超过用IPTG和乳糖诱导的结果,再次证明了自诱导表达策略的确可以提高外源基因在原核系统的表达效率。
培养基ZYM-5052包含细菌生长的各种营养成分和自诱导因素,包括葡萄糖和乳糖,葡萄糖消耗完毕后乳糖诱导作用开始。使用自诱导培养基ZYM-5052操作简单,表达效率高,价格便宜,易于推广。
后续的纯化实验表明表达的融合蛋白可以用硫酸镍亲和层析纯化得到,且相对分子质量的大小与HPV18E7融合的相对分子质量大小一致,证实了表达的融合蛋白确实是目标蛋白。初次纯化的HPV18E7蛋白的纯度虽然远远不够,但可以通过提高硫酸镍亲和层析柱的柱效以得到纯度高的融合蛋白,为后续的肠激酶酶切HPV18E7融合蛋白奠定基础。
[1]Burd EM.Human papilomavirus and cervical Cancer[J].Clin Microbiol Rev,2003,16(1):1-175.
[2]Ehehalt D,Lener B,Pircher H,et al.Detection of human papillomavirus type 18E7oncoprotein in cervical smears:a feasibility study[J].J Clin Microbiol,2012,50(2):246-257.
[3]李忠明,张延龄,徐德启,等.当代新疫苗[M].北京:高等教育出版社,2001:509-514.
[4]Yan J,Harris K,Khan AS,et al.Cellular immunity induced by a novel HPV18DNA vaccine encoding an E6/E7fusion consensus protein in mice and rhesus macaques[J].Vaccine,2008,26(40):5210-5215.
[5]金奇.医学分子病毒学[M].北京:科学出版社,2001:812-831.
[6]Masters JR.HeLa cells 50years on:the good,the bad and the ugly[J].Nat Rev Cancer,2002,2(4):315-319.
[7]Studier FW.Protein production by auto-induction in high density shaking cultures[J].Protein expression and purification,2005,41(1):207-234.
[8]冯彬.T7表达系统及自诱导蛋白产出策略[J].教育学院管理学报自然科学版,2009,4(3):10-15.
[9]彭树英,吕宁,贾淑玲,等.应用自动诱导表达体系提高原核表达效率[J].农业生物技术学报,2009,17(1):138-143.
