甲状旁腺素对大鼠正畸牙根吸收后修复期破骨细胞的影响*
2013-08-14王生瑜袁小平
王生瑜,袁小平
(1.甘肃中医学院附属医院口腔科,兰州 730020;2.泸州医学院附属口腔医院正畸科/泸州医学院口腔修复和再生实验室,四川泸州 646000)
研究认为正畸炎性牙根吸收可以达3%~100%,但其可以部分自行修复[1]。牙根修复是骨吸收与重建的平衡过程,机制相对复杂:牙骨质吸收及重新沉积,牙周组织的修复均参与其中[2]。甲状旁腺素(PTH)是重要的骨代谢调节剂,研究证明间断应用少量PTH(1-34)利于骨组织的修复[3],但它能否对牙根修复期持续进行的牙根吸收产生影响鲜有报道。因此本实验以正畸诱导牙根吸收后的大鼠为研究对象,不同时间段皮下间断注射少量PTH(1-34)后,免疫组织化学测定牙根修复期压力侧牙周组织中核因子κB受体活化因子配体(RANKL)表达变化规律,特殊染色计数牙根吸收面破骨细胞的变化。
1 材料与方法
1.1 实验动物 选用6~8周雄性,体质量200~250g SD大鼠63只(属清洁级I级合格动物,由重庆滕鑫生物技术有限公司实验动物中心提供)。
1.2 方法
1.2.1 实验大鼠正畸牙根吸收模型的建立 随机选取大鼠一侧上颌第一磨牙为实验牙。在大鼠上颌前牙与第一磨牙之间安装一个0.012英寸的镍钛拉簧,加载0.6N的力,使上颌第一磨牙向近中移动10d,建立牙根吸收模型。实验牙移动10d后拆除移动装置,对大鼠重新称体质量,应用随机数字表按体质量随机分为空白对照组、阴性对照组、实验组,每组21只。体质量采用方差分析进行多个样本均数比较,结果表明3组动物的体质量比较差异无统计学意义(P>0.05)。
1.2.2 PTH(1-34)注射实验 拆除装置后做如下的实验处理:空白对照组不注射任何药品;阴性对照组自拆除装置当日起在皮下注射6mL/kg生理盐水,以后隔日注射;实验组拆除装置自当日起在皮下注射6mL/kg PTH(1-34)和生理盐水,以后隔日注射[5]。3组均在07、10、14、17、21、25d分别处死3只取材。
1.2.3 标本制备和染色 取实验侧上颌骨包括3个完整的磨牙及牙根、牙槽骨的组织。固定,脱钙,石蜡包埋,沿牙体长轴,按施力方向的近远作3~5mm厚的连续切片。免疫组织化学检测RANKL的表达。本实验采用山羊RANKL多克隆抗体(美国Santa Cruz公司),SP免疫组织化学试剂盒和DAB显色盒(北京中山生物技术有限公司)按说明书步骤进行免疫组织化学染色。阳性标准:胞浆为特异性棕黄色,阳性细胞着色水平明显高于背景水平。
1.2.4 RANKL免疫组织化学表达测定 光镜下在实验牙显示中央根及远中根吸收面压力侧牙周组织15个高倍镜视野(×200),经摄像后,Image-pro-plus图像分析系统的计算机中编辑处理,测得牙根吸收陷窝及临近牙周组织RANKL表达阳性染色区域的平均光密度值。
1.2.5 抗酒石酸酸性磷酸酶(TRAP)染色破骨细胞检测 采用Nikon ECLIPES TE2000-S多功能全自动显微镜对大鼠TRAP染色切片进行观察,并用Nikon DXM 1200C数码相机在第一磨牙中央根与远中根牙根吸收面随机选取采集各时像点15个高倍镜视野(×200),计数TRAP阳性染色的破骨细胞数,计算均数。以红色颗粒代表TRAP阳性的信号,TRAP阳性染色胞核在3个或3个以上的且位于第一磨牙中央根与远中根根中区及附近根尖区牙根吸收面的细胞计数为阳性破骨细胞。
1.3 统计学处理 采用SPSS13.0统计软件进行数据分析,计量资料以表示,各组间比较采用单因素方差分析,两两比较采用q检验;同组不同时间比较采用单因素方差分析,两两比较采用q检验,检验水准α=0.05,以P<0.05为差异有统计学意义。
2 结 果
2.1 组织学楞个木素-伊红(HE)染色后光镜下观察结果 中断加10d牙根吸收陷窝均未见修复性牙骨质沉积。10d时牙根吸收陷窝边缘开始出现一层紫染的修复性牙骨质沉积线。见图1。
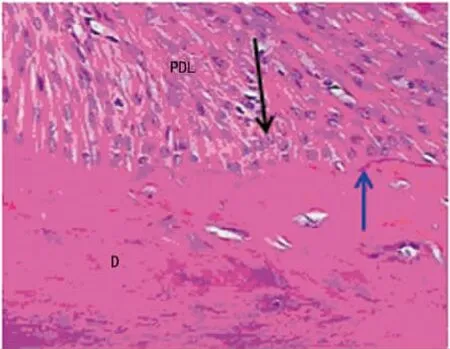
图1 10d牙根面牙骨质修复情况光镜检查(HE×200)
2.2 RANKL免疫组织化学表达测定结果 实验组相对于空白对照组、阴性对照组7、10dRANKL表达显著增强,21d起表达显著减弱。见图2、3。比较3组0、7、10、14、17、21、25d牙根面吸收陷窝及临近牙周组织中RANKL表达光密度值发现,在实验组与空白对照组,实验组与阴性对照组组间比较7、10、21、25d差异有统计学意义(P<0.01)。见表1。

图2 实验组RANKL表达7d(×200)
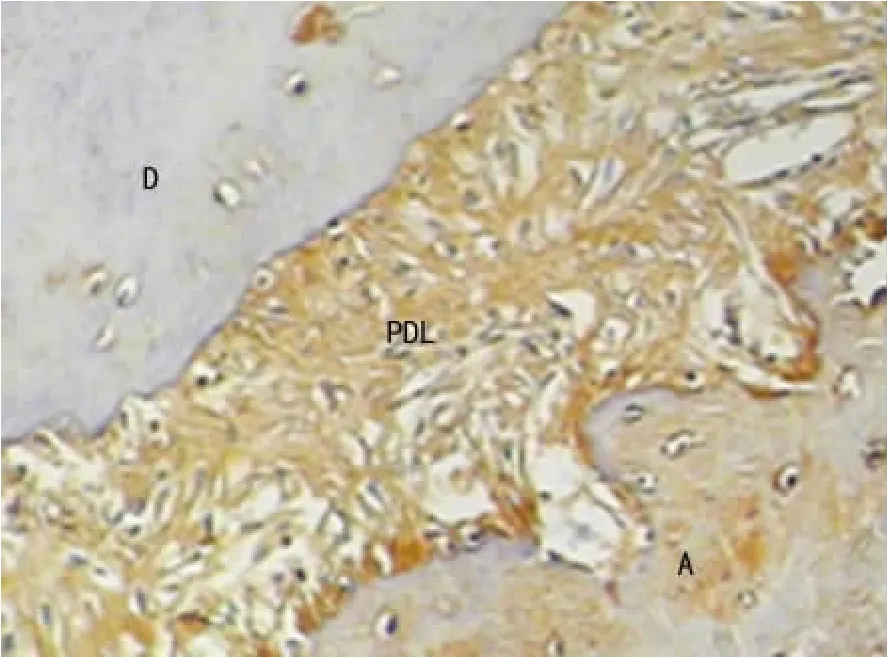
图3 实验组RANKL表达21d(×200)
表1 牙根压力侧RANKL表达平均光密度值()
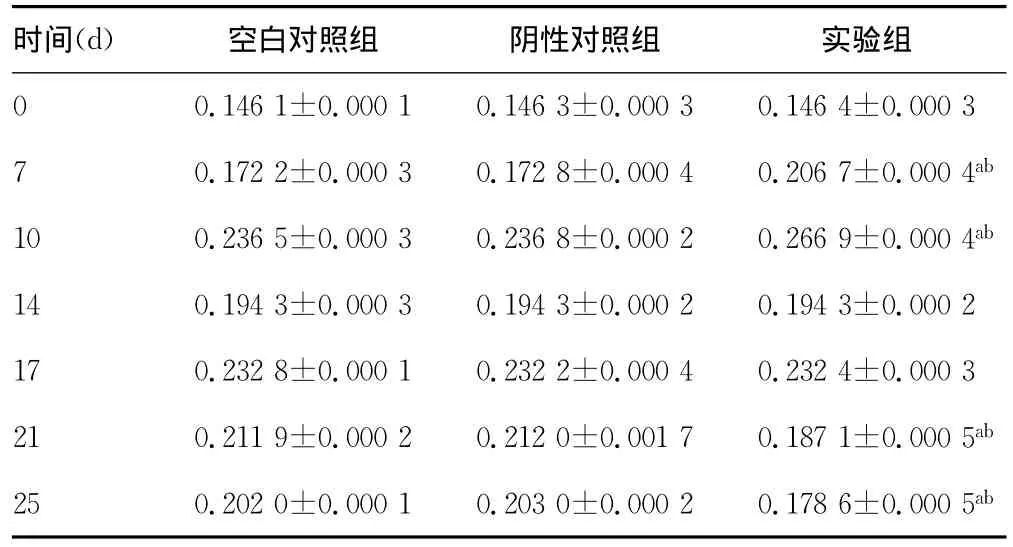
表1 牙根压力侧RANKL表达平均光密度值()
a:P<0.01,与空白对照组比较;b:P<0.01,与阴性对照组组比较。
空白对照组 阴性对照组 实验组0 0.1461±0.00010.1463±0.00030.1464±0.0003时间(d)7 0.1722±0.00030.1728±0.00040.2067±0.0004ab 10 0.2365±0.00030.2368±0.00020.2669±0.0004ab 14 0.1943±0.00030.1943±0.00020.1943±0.000217 0.2328±0.00010.2322±0.00040.2324±0.000321 0.2119±0.00020.2120±0.00170.1871±0.0005ab 25 0.2020±0.00010.2030±0.00020.1786±0.0005ab
2.3 TRAP染色破骨细胞检测结果 TRAP染色0d,压力侧根面及牙周组织中可见大量阳性染色破骨细胞定位于破牙或破骨细胞的胞浆内,见图4。0、7、10、14、17、21、25d牙根面吸收陷窝及临近牙周组织中破骨细胞数发现,各时间点空白对照组、阴性对照组、实验组组间对比差异无统计学意义(P>0.05)。见表2。
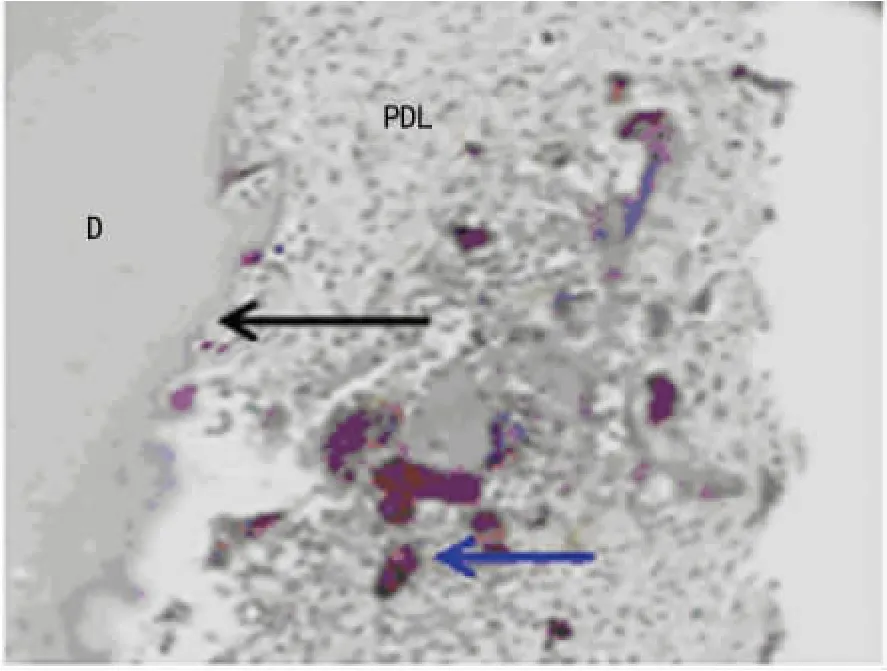
图4 TRAP染色0d破骨细胞(×200)
表2 牙根面吸收陷窝及临近牙周组织中破骨细胞数()
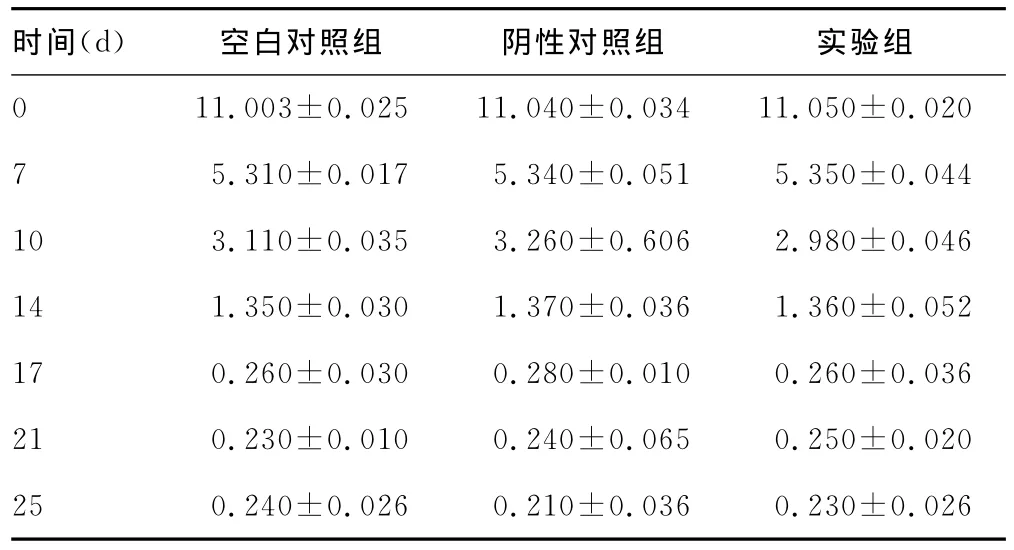
表2 牙根面吸收陷窝及临近牙周组织中破骨细胞数()
时间(d) 空白对照组 阴性对照组 实验组0 11.003±0.02511.040±0.03411.050±0.0207 5.310±0.017 5.340±0.051 5.350±0.04410 3.110±0.035 3.260±0.606 2.980±0.04614 1.350±0.030 1.370±0.036 1.360±0.05217 0.260±0.030 0.280±0.010 0.260±0.03621 0.230±0.010 0.240±0.065 0.250±0.02025 0.240±0.026 0.210±0.036 0.230±0.026
3 讨 论
正畸过程中常见的牙根吸收是由牙齿移动引起的医源性并发症,怎样减少牙根吸收是近年来正畸医生比较关注的焦点。PTH是重要的钙、磷调节因子,间歇给药有促进骨形成作用[3]。据此,本实验选择皮下小剂量间断注射给药途径,以观察在大鼠牙根修复期是否通过成骨作用抑制修复期仍持续的牙根吸收。
本实验选用0.5N的力持续移动实验牙齿10d复制牙根吸收模型。结果在实验的早期(即0~14d),3组均可见牙根面有破骨细胞出现且都呈现递减趋势,说明牙根吸收模型复制成功;去除加力装置后牙根吸收均未停止,这与文献[6-7]的研究结果相似,是因为正畸性压力停止后,透明样化组织区仍存在持续吸收,以达到根吸收范围与透明样化区的最大范围一致,证明随着中断加力时间的延长,牙根吸收是逐渐向修复转变的。RANKL是破骨细胞活性标志物。实验结果发现全身间断运用PTH后大鼠压力侧牙周组织中RANKL的表达相对于未注射PTH组的实验大鼠牙周组织中变化显著,呈现早期升高晚期降低,证明小剂量间断应用PTH(1-34)对牙周组织中RANKL表达产生了影响。早期升高是因为PTH发挥成骨作用需要破骨细胞的参与,刺激了破骨及破牙骨质细胞的成熟和活性[8-9];后期RANKL表达减弱是因为PTH发挥了成骨作用,这与Lossdörfer等[10]观点一致,其细胞实验证明间断应用PTH可以抑制牙周组织中破骨细胞的分化;本实验发现PTH对破骨细胞及破牙骨质细胞数目变化没能产生有效影响,分析原因可能是体外细胞实验与体内实验有区别:牙周组织对外源性PTH(1-34)有清除作用[11],体内实验时皮下注射进入体内的PTH(1-34)量很少导致早期PTH(1-34)在牙周组织中的剂量有限,作用较微弱,不能对吸收陷窝中破牙骨质细胞及临近牙周组织中破骨细胞数量产生有效影响,因此对于修复早期仍持续存在的牙根吸收未产生明显抑制作用;可是随着时间的延长晚期PTH(1-34)的量在牙周组织中大量积聚对RANKL的表达产生了抑制作用,这可能利于打破骨平衡使得其向成骨转化,有待后续研究。
本实验研究结果说明通过皮下间断少量运用PTH对修复早期仍持续的牙根吸收不能产生抑制作用。
[1]Edward FH.Root resorption during orthodontic therapy[J].Sem Othop,2000,6(3):183-194.
[2]Götz W,Kunert D,Zhang D,et al.Insulin-like growth factor system components in the periodontium during tooth root resorption and early repair processes in the rat[J].Eur J Oral Sci,2006,114(4):318-327.
[3]刘娟,王斌,张杰.骨质疏松症治疗新药-甲状旁腺激素的研究进展[J].药物生物技术,2004,11(3):203-206.
[4]李新桂,刘月华,张寅.正畸力对大鼠正畸牙根吸收后早期修复的影响[J].临床口腔医学杂志,2010,26(2):86-89.
[5]邢小平,山本逸雄,森田陆司.间歇皮下注射人甲状旁腺激素不同片段(hPTH1-34及hPTH1-84)对去卵巢大鼠股骨及腰椎骨量的影响[J].中国骨质疏松杂志,2002,8(2):128-131.
[6]Brudvik P,Rygh P.Transition and determinants of orthodontic root resorption-repair sequence[J].Eur J Orthod,1995,17(3):177-188.
[7]Brudvik P,Rygh P.The repair of orthodontic root resorption:an ultrastructural study [J].Eur J Orthod,1995,17(3):189-198.
[8]Koh AJ,Demiralp B,Neiva KG,et al.Cells of the osteoclast lineage as mediators of the anabolic actions of parathyroid hormone in bone[J].Endocrinology,2005,146(11):4584-4596.
[9]Karsdal MA,Henriksen K,Sørensen MG,et al.Acidification of the osteoclastic resorption compartment provides insight into the coupling of bone formation to bone resorption[J].Am J Pathol,2005,166(2):467-476.
[10]Lossdörfer S,Götz W,Jager A.PTH (1-34)-induced changes in RANKL and OPG expression by human PDL cells modify osteoclast biology in a co-culture model with RAW 264.7cells[J].Clin Oral Investig,2011,15(6):941-952.
[11]Dobnig H,Turner RT.The effects of programmed administration of human parathyroid hormone fragment(1-34)on bone histomorphometry and serum chemistry in rats[J].Endocrinology,1997,138(11):4607-4612.
