大鼠供肝保存时TET对HCA液的优化作用及与UW液的保存效果比较
2013-08-14陈保华
陈保华,毛 英,黄 荣,高 毅
(本文编辑:张仲书; 英文编辑:王建东)
目前,世界上广泛采用的组织器官灌注保存液为UW(University of Wisconsin)液,它可有效地保存肝脏24~30 h,然而UW液也存在着不足,如价格昂贵等。我国上海研制并已广泛运用于国内肾移植灌洗保存的高渗枸橼酸盐嘌呤(HCA)液,虽具有配方简便,价格合理的优点,但用于移植肝的灌洗保存效果与UW液仍有较大差距。本实验旨在通过用汉防己甲素(TET)乳酸林格液、TET-HCA液、HCA液和UW液低温灌洗保存供肝2 h的实验,比较TETHCA液与UW液对供肝的保护作用,并分析TET对HCA液的优化效果。
1 材料与方法
1.1 材料 采用成年健康SD大鼠80只,雌雄不拘,体重(250±10)g,由中科院实验动物中心提供,等级SPF〔合格证号 NO:0034376,许可证号 SCXK(沪)2009-0006〕,随机分成4组。试剂有TET(江西银涛药业有限公司生产)、HCA液(上海输血技术有限公司生产)、UW液(南方医科大学珠江医院提供)、乳酸林格液、ATP、ADP、AMP标准品(南京华东医药公司提供),丙氨酸氨基转移酶(ALT)试剂、乳酸脱氢酶(LDH)试剂(上海长征试剂公司产品)。主要仪器有Waters1275型高效液相色谱仪(美国沃斯特公司)、HITACHI7150型全自动生化分析仪(日本日立公司)、常规配制TET/乳酸林格液(60 mg/L)、TET/HCA液(60 mg/L)等。
1.2 方法
1.2.1 分组 将80只SD大鼠随机分成4组。A组(TET乳酸林格液组)以4℃ TET乳酸林格液(70 mg/L)进行供肝灌洗再以该液保存。B组(HCA液组)以4℃ HCA液进行供肝灌洗再以该液保存。C组(TET-HCA液组)以4℃ TET-HCA液(60 mg/L)进行供肝灌洗再以该液保存。D组(UW液组)以4℃UW液进行供肝灌洗再以该液保存。每组灌洗液均为40 ml,低温保存时间均为2 h。
1.2.2 处理方法 实验前12 h动物禁食,自由进水,乙醚麻醉后取仰卧位,腹部弧形切口,顺时针分离肝下腔静脉、右肾静脉、右三角韧带及镰状韧带,结扎左膈静脉,肝动脉结扎离断,游离出门静脉远端并予结扎,然后经门静脉插管并以持续滴注法将4℃的各保存液行供肝原位低压重力灌洗。同时剪开肝下腔静脉,边灌注边放血,至肝颜色变淡呈均匀土黄色,即于4℃的各保存液中保存2 h。
1.3 标本收集及测试方法
1.3.1 ALT及LDH检测 分别取各组的保存液2 ml进行检测。取保存液前,用注射器抽取5 ml保存液,缓慢冲洗肝脏,然后将保存液摇匀取样。应用全自动生化分析仪检测ALT与LDH。
1.3.2 肝组织中ATP、ADP、AMP含量测定 标本处理:各组大鼠均取肝组织约1 g液氮中保存。标本从液氮中取出后,迅速称取500 mg,置于1 ml 0.4 mol/L HClO4溶液中研磨5~8 min(冰溶),低温离心(离心半径8 cm,10000 r/min)15 min,取上清液;用0.6 mol/L KOH中和使pH值为7.0,再次低温离心(离心半径8 cm,10000 r/min)15 min,取上清液于-30℃下保存,2周内检测。采用waters1275型高效液相色谱检测高能磷酸化合物,应用C18分析柱,磷酸盐缓冲液为流动相(pH=6.0),检测波长254 nm,流速 1.0 ml/min,进样 10μl,柱温 23 ℃。本实验采用Athinson能量价(energy charge,EC)公式[EC=(ATP+1/2ADP)/(ATP+ADP+AMP)]评价各组组织的能量消耗。
1.4 统计学处理 所有结果均采用SPSS 11.0统计软件进行统计学分析,计量数据采用均数±标准差()表示,组间比较采用配对t检验,P<0.05为差异有统计学意义。
2 结果
A组与B组ATP及EC值无明显差异(P>0.05),提示用TET乳酸林格液低温灌洗并保存鼠肝2 h,在减少供肝低温灌注保存中肝细胞能量的消耗,保持供肝细胞的活性方面具有与HCA液相当的效果。C组肝细胞的ATP及EC值显著比B组高,具有显著性差异(P<0.05),提示用TET-HCA液低温灌洗保存供肝2 h比以HCA液灌洗保存供肝2 h,在减少供肝低温灌注保存中肝细胞能量的消耗,保持供肝细胞的活性方面具有更好的效果。C组与D组中ATP及EC值无明显差异(P>0.05),提示用TET+HCA液低温灌洗保存鼠肝2 h,在减少供肝低温灌注保存中肝细胞能量的消耗,保持供肝细胞的活性方面具有与UW液相当的效果(表1)。A、B两组保存液中ALT、LDH比较无显著差异(P>0.05),说明用TET乳酸林格液低温灌洗并保存鼠肝2h,在供肝低温灌注保存减少肝细胞损害方面具有与HCA液类似的效果。C组肝细胞ALT及LDH检测值显著较B组低,具有显著性差异(P<0.05),提示用TET-HCA液低温灌洗保存供肝2 h比以HCA液灌洗保存供肝2 h,在供肝低温灌注保存减轻肝细胞损害方面具有更好的效果。C、D两组ALT、LDH比较无显著差异(P>0.05),表明用TETHCA液低温灌洗保存鼠肝2 h,在供肝低温灌注保存减少肝细胞损害方面具有与UW液相同的效果(表2)。
3 讨论
供肝保存是肝移植成功的先决条件,目前常用供肝保存液中,UW液使肝脏保存由原来的6~8 h延长至24~30 h,成为目前应用最广的肝、肾、胰脏的“金标准”保存液[1],该保存液基本可防止细胞的水肿、细胞内的酸中毒、间质水肿及氧自由基的损伤,促进了高能化合物的再生。但它也有诸如黏度高、价格昂贵、处理与检测不便等缺点。
本研究表明,TET在低温灌洗保存条件下减轻肝细胞的损害,直接用于供肝低温灌注保存对大鼠肝脏具有良好的保护作用。推测TET应用于配制供肝保存液可能有较好的效果。
本实验表明,用自行配制的TET乳酸林格液低温灌洗并保存鼠肝2 h,在供肝低温灌注保存中可减少肝细胞能量的消耗,保持供肝细胞的活性,在减轻肝细胞损害方面具有与HCA液相当的效果。HCA液是一不含Ca2+拮抗剂的仿细胞内保存液,其主要作用为溶液的高渗性防止了细胞的水肿;而TET主要是通过细胞内Ca2+拮抗作用而保护供肝[2-4]。本研究中两者均具有相同的保存效果,推测供肝在低温灌注保存中的损伤原因及保护机制可能亦具有多样性。注:与B组比较,*P<0.05
表1 各组肝组织中高能磷酸化合物含量比较(nmol/g,)
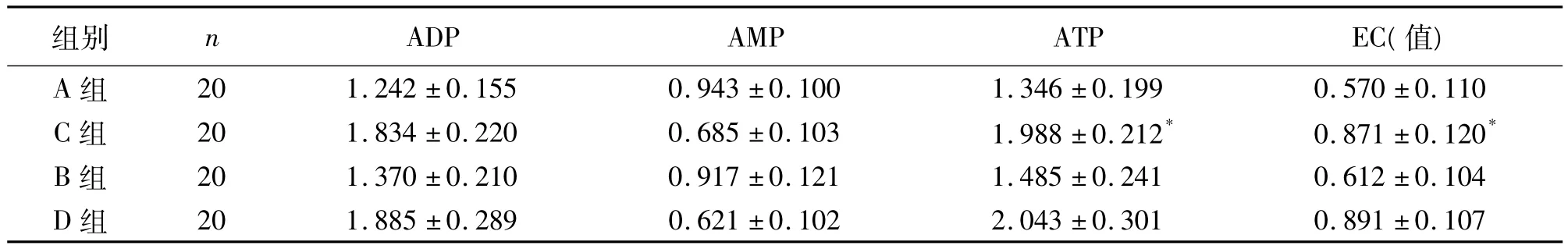
表1 各组肝组织中高能磷酸化合物含量比较(nmol/g,)
组别 n ADP AMP ATP EC(值)A组 20 1.242±0.155 0.943±0.100 1.346±0.199 0.571±0.1070±0.110 C组 20 1.834±0.220 0.685±0.103 1.988±0.212* 0.871±0.120*B组 20 1.370±0.210 0.917±0.121 1.485±0.241 0.612±0.104 D组 20 1.885±0.289 0.621±0.102 2.043±0.301 0.89
表2 各组保存液中ALT、LDH的含量比较(U/L,)

表2 各组保存液中ALT、LDH的含量比较(U/L,)
注:与B组比较,*P<0.05
组别 n ALT LDH A组20 10.6±5.01 150.1±70.4020 23.5±6.11 242.4±75.20 B组 20 24.1±5.24 239.8±71.91 C组 20 11.5±4.98* 148.3±69.70*D组
本实验C组肝细胞的ALT及LDH含量显著较B组低,ATP及EC值显著较B组较高,均具有显著差异(P<0.05);提示用TET-HCA液低温灌洗并保存鼠肝2h,在减少肝细胞的能量消耗,保持供肝细胞的活性,减轻肝细胞损害方面具有比HCA液更好的效果,表明在低温灌洗保存条件下保存大鼠供肝时,TET对HCA液具有积极的优化作用。其原因可能与TET具有钙离子拮抗及氧自由基清除双重作用,弥补了HCA液不含钙拮抗剂的不足,两者产生了互补和(或)协同作用。
在冷保存期间影响器官活力的主要因素为灌注损伤、溶酶体酶释放、线粒体功能障碍、细胞水肿及氧自由基形成等[5]。本实验用TET-HCA液低温灌洗并保存鼠肝2 h,对供肝的保护作用具有与UW液类似的较好效果。推测可能与下列因素有关[6-9]:①TET能稳定细胞内Ca2+浓度,保护细胞膜通透性,可明显抑制LDH的释放和保护高能磷酸化合物,使肝细胞损害减轻,提高肝细胞活性;②能降低炎症反应减轻组织水肿,可能与其降低炎症组织细胞内的Ca2+水平有关,因为在炎症反应时,内皮细胞内的Ca2+升高可引起内皮细胞收缩,引起毛细血管通透性增加;③TET可减少自由基的产生和纠正超氧化物歧化酶(SOD)的生成不足。自由基是生物体内代谢过程中产生的具有强氧化活性的物质,自由基的大量产生,超过抗氧化系统的承受能力,可引起细胞脂质过氧化、蛋白质变性、DNA分解等病理变化[10]。同样,亦有文章提出[11-12],在移植肾缺血再灌注损伤的病理生理过程中,活性氧对肾组织的损伤作用是肾组织病变机制之一,甚至是许多因素损伤肾组织的最终递质。总之,实验结果的差异和机制值得进一步探讨。
[1]Scotte M,Eschwege P,Cherruau C,et al.Liver preservation below 0 degrees C with UW solution and 2,3-butanediol[J].Cryobiology,1996,33(1):54-61.
[2]陈保华,黄 荣,车河龙,等.汉防已甲素不同给药方式对大鼠供肝能量代谢的影响[J].中国医院用药评价与分析,2011,11(8):717-718.
[3]陈保华,黄 荣,姚 斌,等.汉防已甲素对低温灌洗保存大鼠供肝的肝脏功能影响的实验研究[J].中国医院用药评价与分析,2011,11(9):814-816.
[4]赵建生,佟波涛,段加方,等.肝移植术中心跳骤停4例临床初探[J].东南国防医药,2009,11(4):326-328.
[5]Jamieson NV,Sundberg R,Landell S,et al.Preservation of the canine liver for 24-28 hours using simple cold storage with UW solutin[J].Transplantation,1988,46(6):517-519.
[6]Chen XH,Hu YM,Liao YQ.Protective effect of tetrandrine on CCl4atocytes[J].Acta Pharmacologica Sinica,1996,17(6):348-350.
[7]刘玉兰,李定国,陆汉明.汉防己甲素对肝细胞生长增殖的影响[J].上海第二医科大学学报,1995,15(3):212-215.
[8]范列英,孔宪涛.汉防己甲素对成纤维细胞及胶原合成的影[J].临床肝胆杂志,1995,11(8):25-26.
[9]阳文新,钟正江,申 红,等.肝移植术后早期并发症的诊治(附44 例报告)[J].东南国防医药,2005,7(3):169-207.
[10]王春战.姜黄素抗类抗氧化作用的研究进展[J].医学研究生学报,2012,25(6):658-660.
[11]Maiese K,Boniece I,DeMeo D,et al.Peptide grewth factors protect against ischemia in culture by prewvnting nitricoxide toxicity[J].Meurosci,1993,13(7):3034-3040.
[12]丁国永,郭 丽,杜忠君,等.骨髓间充质干细胞对肾缺血再灌注损伤后肾功能及氧化应激水平的改善作用[J].吉林大学学报:医学版,2009,35(4):587-590.
