赣南池塘养殖黑尾近红鲌胚胎发育的研究
2013-08-12张爱芳曹义虎徐先栋张建铭曾柳根张桂芳
张爱芳 曹义虎 徐先栋 张建铭 曾柳根 张桂芳
(1.江西省水产科学研究所,江西南昌 330039 ;2.赣州市水产研究所,江西赣县 341100;3.南昌市农业科学院,江西南昌 330039)
黑尾近红鲌(Ancherythroculter nigrocauda Yihet Woo)隶属于鲤科、鲌亚科、近红属,是长江上游各支流中一种特有性鱼类,与广泛分布于各大水系的翘嘴鲌(culter alburuns Basilewsky)相比,其性情温顺,更易驯化养殖和捕捞,为我国目前规模化养殖的鲌类新品种。然而国内学者对黑尾近红鲌的研究起步比较晚,仅从1997 起才开始进行研究,2000年以后才陆续报道黑尾近红鲌的生物学、人工繁殖、生化成分、年龄与生长的关系等相关的研究[1~5]。目前,国内学者已就胚胎发育[6~7]以及池塘养殖试验[8]等方面开展了相关研究。赣州市水产研究所2008年从武汉市水产科学研究所引进黑尾近红鲌,并展开了人工繁殖[9]及人工养殖[10]的研究。本课题组已对池塘养殖条件下黑尾近红鲌的可数可量性状[11]、冬片培育技术[12]及黑尾近红鲌幼鱼的营养需求等展开了研究[13]。本研究中,作者对江西赣南地区人工引种黑尾近红鲌胚胎时序和特征的观察研究,为其苗种繁育技术的完善提供科学依据,以期为这一特有资源在江西地区的开发利用和保护种群数量提供基础资料。
1 材料与方法
1.1 实验时间与地点
实验于2012年6月28日-7月4日,在赣州市水产研究所进行。
1.2 亲鱼的来源与选择
1.2.1 亲鱼的来源
本研究中所用黑尾近红鲌亲本,均来自赣州市水产研究所,共计190尾,雌雄各半,全长247.7±38.9mm,体重568 ±43g。
1.2.2 亲鱼的选择
人工催产亲鱼参照张建铭[9]等介绍,选择体质健壮,无伤病,各鳍完整的鲌鱼。雌鱼挑选腹部膨大,前后腹部丰满圆润,富弹性,腹部外突。腹部朝上时,可见明显卵巢轮廓。生殖孔呈粉红色,圆形外翻,用手轻轻挤压有黄色卵子排出的亲本。雄鱼挑选鳃盖、吻部、胸鳍条等部位珠星明显,腹部较柔软,生殖孔狭长,凹陷,呈粉红色,挤压腹部,有乳白色浓稠精液流出的亲本。雌雄配比为1:1。
1.3 人工繁殖及受精卵的获得
参照张建铭[9]等研究,雌性亲本使用10μg/kg LHRH-A2,1000IU/ kg HCG 及5.0mg/kg DOM 三种激素混合使用,雄性亲本剂量减半。采用一次注射的方法,注射方法为腹部注射法,注射部位为胸鳍基部。催产时间为17:00-19:00,11h后激素产生效应,此时雌鱼开始排卵,雄鱼排精,6~7h 后结束。待发情后,将亲鱼取出,人工湿法授精,使流出的卵粒和精液混合滴在准备好的装满水的瓷盘内,盘内已铺满干净的载玻片(25mm×25mm),用手拍打水面使卵均匀地粘着于玻片上,并将沾满胚胎的载玻片放置孵化槽中进行流水孵化,水温为26.3~28.5℃。根据不同时期及发育的情况进行,观察间隔的时间有所不同。参考殷海成[7]等的报道对早期胚胎发育的观察,每隔10~30min 取一次材料;中期胚胎时每隔0.5~1.0 h取材观察;晚期胚胎时期每隔1.0~1.5h 取材观察一次,每次随机不少于5 片沾满受精卵的载玻片,固定于4%的多聚甲醛液中。
1.4 胚胎发育的观察
将固定好的粘有受精卵的载玻片放置于含有0.001mg 胰蛋白酶的PBS 缓冲液中,进行消化处理,根据不同的发育时期,处理的时间分别为早期胚胎5~10mins,中期胚胎15~10mins;晚期胚胎25~35mins。取出胚胎并固定,在Olympus 显微镜下观察并用数码摄像系统拍照[6]。详细记录发育时间及各个发育时期的主要形态特征,按75%以上胚胎发育达到该期的时间,确定发育期。
2 结果
2.1 黑尾近红鲌成熟卵特征
成熟的黑尾近红鲌卵呈圆形,比重大于水,强粘性。颜色为淡红色,透明性卵膜,卵黄呈端粒状,成熟卵的直接为0.91 ±0.04mm(图1)。
2.2 黑尾近红鲌受精卵特征
精子与卵子结合后,受精卵吸水后稍稍膨胀,饱满而富有弹性,受精卵的直径为1.20 ±0.03mm(图2)。受精后30min,胚胎原生质向卵的一端流动集中,隆起并逐渐形成凸起的胚盘,帽状胚盘、约占卵球的1/3。受精后25 min 后,在卵黄和卵膜之间形成富含透明液体的较宽的卵周隙,卵周隙为0.3 ±0.02mm(图3)。
2.3 卵裂期
此时期包括从2 细胞到多细胞,7个发育阶段。胚胎第一次卵裂为受精后1h20min,胚盘顶端中部下陷并逐渐加深形成分裂沟,继而将胚盘分成大小相似的两个分裂球,此时胚胎进入2 细胞期(图4),分裂方式为经裂。1h45min 后,发生第二次卵裂,形成4个大小相等的分裂球,卵裂沟与第一次卵裂垂,此时胚胎进入4 细胞期(图5),分裂方式为经裂。第三次卵裂发生在距离受精2h05min 后,形成8个细胞,整齐排列成两行,分裂沟平行于第一次,垂直于第二次,细胞等大(图6),分裂方式为经裂,胚胎进入8 细胞期。此后胚胎分别在受精后2h25min,2h45min,3h10min 进行第四次、第五次和第六次分裂,形成16 细胞期,32细胞期和64 细胞期。16 细胞期,分裂方式为纬裂,分裂沟与第一次垂直,有两个分裂面,形成2层细胞,膨大呈盘状,分裂球大小及形状不同,周边较大,中间较小(图7)。32 细胞期,有4个分裂面,分裂成4 排,2 层,每层16个细胞排列,分裂球的排列开始不规则,边缘分裂沟清晰(图8)。64细胞期,此时分裂沟不明显,分裂球大小不一,且无规则排列(图9)。受精3h 30min 后,出现了水平分裂和切线分裂,分裂球越分越小,但界线尚清楚,分裂球大小不一,形状不规则,排列不整齐,多层细胞叠加如同桑椹多细胞期即桑椹期(图10)。
2.4 囊胚期
此阶段可以分为早中晚三个时期。
囊胚早期:受精后3h50 min,分裂球进一步分裂,细胞越分越小,数目不断增加,分裂球细胞界限模糊,表面显得平滑,胚胎细胞团隆起而形成高胚胎,此期称为囊胚早期(图11)。
囊胚中期:受精后4h10 min,囊胚细胞向植物极移动,卵裂继续进行。囊胚层开始变薄向扁平发展,胚盘高度有所下降较囊胚早期低,界限难以分辨(图12)。
囊胚晚期:受精后4h30 min,囊胚表面细胞进一步的扩散,并向卵黄囊部分下包,胎盘明显变薄,胚胎进入囊胚晚期(图版13)。
2.5 原肠期
此阶段包括三个时期,原肠早期、原肠中期及原肠后期。
原肠早期:受精后4h50 min,囊胚向卵黄四周扩展下延,进一步的外包,细胞积累在囊胚的外周边缘形成胚芽环(图14)。
原肠中期:受精后5 h 20 min,胚环下包约1/2,胚环增厚(图15)。
原肠晚期:受精后6 h 30 min,胚盘下包约3/4。(图16)。
2.6 神经胚期
受精后10h 50 min,胚盘继续下包,胚体背面中间加厚形成神经板,两侧形成神经褶,进一步愈合形成神经管。随着胚层进一步下包,卵黄栓消失,胚孔逐渐变小直至封闭(图版17)。
2.7 器官形成期
肌节出现期:受精后13h20 min,胚体中部模糊的出现3~4 对肌节,并逐渐向前、后依次增多,胚体头部膨大,卵黄囊为规则圆球形(图18)。
眼基出现期:受精后13h40min,胚体头部两侧向外开始隆起,发育成为前脑、中脑和后脑原基;后端薄而宽,为尾部的发育原基。在头部中央两侧,有一对椭圆形的突起,即眼的原基(图19)。
眼囊期:受精后14h50 min,已见清晰的眼囊,性状为椭圆形,出现于胚胎的前端,同时前端隆起更多,可初步的分为前脑泡、中脑泡和后脑泡。肌节数量增多,已出现7~8 对(图20)。
尾芽期:受精后15h30 min,胚体逐渐展长,胚体末端增厚,边缘出现皮皱,在末端出现锥状尾牙,游离出卵黄囊,尾芽部有一层膜状结构把胚体与卵黄囊隔开,眼囊轮廓清晰,且眼囊逐渐变圆。肌节数量进一步的增多,已达12~14 对(图版21)。
耳囊期:受精17h30min 后,在后脑两侧出现耳囊,呈小泡状。眼囊开始内陷成胚杯,体节15~16 对,尾芽与卵黄囊开始分离,为耳囊期(图22)。
尾鳍出现期:受精后19h30min,胚体继续延长,胚体尾部的边缘出现皮褶,尾部离开卵黄囊,出现尾鳍,此时还可见胚体呈微弱的间歇性(图23)。
晶体形成期:受精后20h30min,脊索非常清晰,眼囊随着胚胎发育而不断扩大并向外伸展,通过此处外胚层的诱导作用,使眼囊内陷而成双层壁的眼杯。此后又通过一定的诱导作用形成眼的水晶体原基,直到形成晶体。此时还可见胚体呈微弱的间歇性颤动,肌节已达17~18 对(图24)。
肌肉效应期:受精21h20min 后,胚体开始出现间断性微弱的肌肉收缩,收缩时从背部肌节开始向尾部传递,继而尾部开始摆动(图25)。
心脏出现期:受精后22 h 55 min,耳囊中出现一对耳石。在脊索前,卵黄囊前上方,有一串细胞,即为心脏原基,且开始跳动,胚胎出现血液循环,血液无色。肌节已达22 对(图26)。
出膜期:受精后36h30 min,开始出膜,1h50 min 出膜完毕。刚出膜的仔鱼无色透明,全长为3.98 ±0.37mm,卵黄囊在鱼体下方呈现前粗后细的锥体(图27)。
3 讨论
鱼类胚胎发育速率和出膜率受外界因子影响较大,主要因子有水温、溶解氧、光照、水质以及敌害生物等[14]。鱼类的胚胎发育都需要一个适合的水温范围,如果超过或是低于这个范围,胚胎发育将停滞、异常或是死亡。在合适的水温范围内,卵的发育时间与温度呈正相关[15]。鱼卵发育对溶解氧要求随种类,卵的类型和特点而不同,鱼卵所需氧气是通过扩散得到的,受精卵在不同阶段对需氧量要求也不一样[16]。薛正楷[17]提出黑尾近红鲌繁殖产卵最低水温17℃,最适水温19~24℃,但没有提出产卵繁殖的最高温度。本研究中胚胎发育的温度为26.3~28.5℃,说明黑尾近红鲌胚胎能够在28.5℃水温中存活,与张建铭[9]报道的结果一致。采用流水孵化的方法给氧,胚胎能正常发育,说明流水能够满足黑尾近红鲌的胚胎发育耗氧量的需求,这与方耀林[18]等报道的团头鲂胚胎发育耗氧量的研究一致。
在人工养殖环境下,水体的理化因子、饵料来源和营养配比的不同对亲鱼产生影响,从而进一步对成熟卵的颜色及卵径的大小产生影响[19]。刘丹阳[20]等曾报道兴凯湖翘嘴红鲌、太湖翘嘴红鲌、巢湖翘嘴红鲌和海南红鲌的成熟卵的颜色、吸收后卵径的大小、吸收后卵周隙及受精卵类型非粘性卵存在着差异性,并指出这种差异性是由于生态差异及生境差异而导致的。本研究中赣南地区人工养殖黑尾近红鲌的卵的颜色及卵径的大小与殷海成等[7]报道的一致,成熟的黑尾近红鲌卵呈圆形,比重大于水,强粘性。颜色为淡红色,透明性卵膜,卵黄呈端粒状,成熟卵的直接为0.91 ±0.04mm,并没有出现因为环境因素的改变而带来成熟卵子生理生化的改变。这也表示着赣南地区人工养殖的黑尾近红鲌的性腺发育良好,从而进一步佐证了赣南地区适合黑尾近红鲌的人工养殖,这与本项目组先前的报道一致。
温度是影响一个物种胚胎发育速率的主要环境因素,一般情况下,同种鱼类的受精卵在不同温度条件下,胚胎发育所需的时间存在一定的差异,通常温度越高孵化时间越短[21]。殷海成[7]等报道黑尾近红鲌从受精到出膜在24.5℃时需要约50h;Xiong 等[6]报道在水温为25.7~27℃(平均水温26.5℃)条件下,整个发育过程需要43 h 15 min;而本研究发现赣南地区人工养殖黑尾近红鲌的胚胎在水温为26.3~28.5℃(平均水温27.5℃)条件下,整个胚胎发育过程需要36h30min,这表明温度是影响黑尾近红鲌胚胎发育一个重要的环境因素,温度越高所需要的发育时间越短,这也与鲤科鱼类发育特征一致[22]。赣南地区人工养殖黑尾近红鲌胚胎发育的特征与之前报道的结果类似,主要区别在于胚胎各个时期发育时间的差异性。由不同温度下黑尾近红鲌发育时期所需要的时间(表1)可知:在卵裂期,胚胎在平均水温27.5℃所需要的时间与平均水温24.5℃[7]所需要的时间基本一致,而在平均水温26.5℃所需要的时间比前2个温度要短,卵裂期胚胎并没有随着温度的升高呈下降趋势。这与梁正其[23]报道的普安银鲫的胚胎随着温度的升高,发育时间逐渐缩短的结果不一致。这也表明黑尾近红鲌的胚胎在发育早期存在最佳发育温度;在胚胎发育的中晚期,三种温度下黑尾近红鲌的发育的时间基本上一致;出膜期,平均水温为24.5℃时需要25h 才能完成出膜,平均水温26.5℃时需要20h 才能完成出膜,平均水温为27.5℃时近需14h 就能完成出膜,由此可见温度对黑尾近红鲌出膜期影响非常明显。据此可以推测温度对黑尾近红鲌胚胎发育的影响主要是在胚胎发育的早期与出膜期,这可为黑尾近红鲌的人工繁殖提供指导。

表1 不同温度下黑尾近红鲌胚胎发育时间
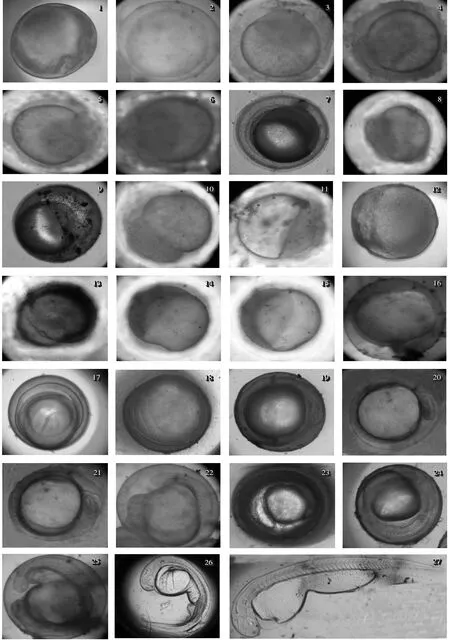
图1-27 不同发育时期黑尾近红鲌的主要形态特征
[1]薛正楷,何学福.黑尾近红鱼白的年龄和生长研究[J].西南师范大学学报(自然科学版),2001,26(6):712-717.
[2]薛正楷,何学福.黑尾近红鲌的个体繁殖力的研究[J].西南师范大学学报,2001,26(1):90-94.
[3]谭德清,王剑伟,但胜国.黑尾近红鲌含肉率及肌肉营养成分分析[J].水生生物学报,2004,28(2):68-74.
[4]谭德清,王剑伟,严太明,等.黑尾近红鲌人工繁殖研究[J].长江流域资源与环境,2004,13(2):193-196.
[5]白晓慧,王贵英,熊传喜.不同年龄黑尾近红鲌消化酶活性比较[J].淡水渔业,2007,37(3):30-33.
[6]M.Xiong,Y.Qiao,H.Rosenthal et al.,Early ontogeny of Ancherythroculter nigrocauda and effects of delayed first feeding on larvae J.Appl.Ichthyol.22 (2006),502–509.
[7]殷海成,吕海英.黑尾近红鲌人工繁殖及胚胎发育的研究[J].大连水产学院学报,2010,25(3):265~269.
[8]王贵英,张训蒲,李清.黑尾近红鲌在人工养殖条件下的生长[J].福建水产,2009,3:77~83.
[9]张建铭,曾庆祥,张家海,等.黑尾近红鲌人工繁殖技术研究[J].水产科技情报,2011,38(2):74~76.
[10]曾庆祥,朱恩华,张家海,等.黑尾近红鲌池塘养殖试验[J].中国水产,2010(3):37~38.
[11]曹义虎,马保新,邓勇辉,等.池塘养殖条件下黑尾近红鲌(0 +~2龄)的可量性状研究[J].安徽农业科学,2011,39 (33):20498~20500.
[12]曹义虎,陈蓉,邓勇辉,等.黑尾近红鮊冬片鱼种池塘培育技术试验[J].江西水产科技,2011(2):30~33.
[13]丁立云,曹义虎,周秋白,等.黑尾近红鲌幼鱼对蛋白质营养需求的初步研究[J].江苏农业科学,2012,40(10):216~218.
[14]王国恩.鱼类早期胚胎发生及环境影响[J].东北师大学报(自然科学版),1988,3:115~131.
[15]Hokanson KEF.Temperature requirements of some percids and adaptations to the seasonal temperature cycle[J].Journal of the Fisheries Board of Canada,1977,34(10):1524~1550.
[16]Heath D D,Devlin R H,Heath J W,Iwama G K.Genetic environmental and interaction effects on the incidence of jacking in Oncorhynchus tshawytscha (chinook salmon)[J].Heredity,1994,72(2):146~154.
[17]薛正楷.濑溪河黑尾近红鲌生物学的初步研究.西南师范大学硕士学位论文,2001.
[18]方耀林,余来宁.团头妨及其胚胎耗氧率的研究[J].淡水渔业,1991,(003):21~23.
[19]Balon E K.Types of feeding in the ontogeny of fishes and the life-history model[J].Environmental Biology of Fishes,1986,16(1):11-24.
[20]刘丹阳,司力娜,张晓光,等.兴凯湖翘嘴鲌胚胎和仔鱼发育的研究[J].东北农业大学学报,2012,43(3):110~116.
[21]Rombough P J.The effects of temperature on embryonic and larval development[J].Cambridge University Press,1997,61:177~224.
[22]刘筠.中国养殖鱼类繁殖生理学[M].北京:农业出版社,1993:20~101.
[23]梁正其,马珊,姚俊杰,等.普安银鲫胚胎发育的初步研究[J].水产科学,2012,31(6):316~320.
