悬滴培养法促进鸡胚胎干细胞形成类胚体
2015-03-22王宵燕左其生路镇宇纪艳芹王颖洁张亚妮李碧春
张 蕾,王宵燕,左其生,路镇宇,王 飞,纪艳芹,王颖洁,张亚妮*,李碧春*
(1.扬州大学动物科学与技术学院 江苏省动物遗传繁育与分子设计重点实验室,扬州 225009; 2.江苏农牧科技职业学院,泰州 225300)
悬滴培养法促进鸡胚胎干细胞形成类胚体
张 蕾1,2,王宵燕1,左其生1,路镇宇1,王 飞1,纪艳芹1,王颖洁1,张亚妮1*,李碧春1*
(1.扬州大学动物科学与技术学院 江苏省动物遗传繁育与分子设计重点实验室,扬州 225009; 2.江苏农牧科技职业学院,泰州 225300)
本研究旨在通过悬浮培养法培养鸡胚胎干细胞(Embryonic stem cells,ESCs),摸索鸡胚胎干细胞形成类胚体(Embryoid body,EB)的最佳方案,以期提高鸡胚胎干细胞体外诱导效率。 将鸡ESCs培养传代至第3代,采用1×104、3×104和6×104mL-13个细胞浓度,使用悬滴培养后,观察类胚体的形成效率。对悬滴培养形成的类胚体进行形态学观察,qRT-PCR检测干细胞标记基因的表达,免疫细胞化学检测相关蛋白的表达,并进行类胚体自分化检测和核型分析。3×104mL-1细胞浓度生成的类胚体数量最高,单个视野下可观察到约267个类胚体,且形成的类胚体大小均一,呈圆球状。qRT-PCR检测结果表明,在类胚体形成48 h内,干细胞标记基因Nanog、Sox2、Oct4和C-kit仍维持表达。免疫细胞化学检测显示,该方法形成的类胚体表面抗原检测Nanog和SSEA-1呈阳性。自分化检测三胚层分化标记基因SOX17、SMA和TUJ-1呈阳性。核型分析显示,悬滴培养形成的类胚体具有并保持正常的核型。鸡ESCs悬滴培养形成类胚体的适宜细胞浓度为3×104mL-1,且形成的类胚体可分化成3个胚层,用于体外定向诱导过程。本研究建立了鸡ESCs体外悬滴培养形成类胚体的培养体系,为后期信号通路的体外验证提供试验基础。
类胚体;悬滴培养;鸡;胚胎干细胞
胚胎干细胞(Embryonic stem cells,ESCs)具有多向分化的潜能,能够分化成包括内胚层、中胚层和外胚层3个胚层在内的各种类型细胞,因此ESCs不仅仅可应用于早期胚胎发育的研究,还可作为细胞替代治疗和药物筛选等的细胞来源。胚胎干细胞的诱导分化是指在体外将胚胎干细胞定向诱导分化成具有功能的其他类型细胞,纯化的ESCs在非细胞因子体外培养条件下(无白血病抑制因子等细胞分化抑制因子)可自发形成类胚体(Embryoid body,EB)[1-4]。EB由分化细胞和未分化细胞组成,在形成阶段具有较强的分化潜能,故在EB早期形成阶段常被用于生产不同细胞系[5]。EB还被广泛用于特定组织细胞的诱导分化,有助于提高定向诱导的分化效率[6-7]。因此,EB的制备已经成为干细胞研究不可或缺的工具[8-10]。
家禽是发育生物学中重要的动物模型,且从鸡胚中可以获得能够满足研究需要的鸡ESCs,克服了取材和伦理上的限制。本课题组一直致力于家鸡ESCs的体外定向诱导分化研究[11-13],通过特定的诱导体系诱导鸡ESCs形成雄性生殖细胞,然而诱导效率较低。本研究以家鸡为研究对象,采用悬滴培养方法,用不同细胞浓度的ESCs形成类胚体,并通过形态学、qRT-PCR和免疫细胞化学检测形成的类胚体中全能性基因的表达。摸索鸡ESCs悬滴培养形成类胚体的最佳条件,通过类胚体进行体外诱导,从而进一步提高鸡雄性生殖细胞的诱导效率。该研究为进一步优化鸡ESCs向生殖细胞定向分化提供理论和试验基础。
1 材料与方法
1.1 试验材料
新鲜受精蛋来自中国农业科学院家禽研究所实验禽场如皋黄鸡鸡群。按H.Eyal-Giladi等[14]方法分为Ⅸ~Ⅺ期,采用产蛋后5 h以内的鸡蛋进行鸡胚盘细胞的分离。
主要试剂:高糖DMEM(Gibco,美国);胎牛血清(Hyclone,美国);β-巯基乙醇(BBI,加拿大); 胚胎阶段特异抗原1(SSEA-1)、Sox2和IgG-FITC(Genetimes)(博奥森,北京);鸡血清、L-谷氨酰胺、碱性成纤维生长因子(bFGF)、人干细胞因子(hSCF)、鼠白血病抑制因子(mLIF)(Sigma,美国)。反转录试剂盒、荧光定量试剂盒(天根,北京)。
1.2 方法
1.2.1 鸡ESCs的分离培养及鉴定 参照孙敏等[13]ESCs分离培养及传代步骤进行。
1.2.2 悬滴培养鸡ESCs 将鸡ESCs培养传代至第3代,待ESCs克隆开始形成,大小相差不大时,加入1 mg·mL-1Collage Ⅳ,37 ℃消化10 min,加入含5% FBS的DMEM终止消化,收集ESCs克隆并制成细胞悬液。将细胞悬液进行细胞计数,设立3个细胞浓度:1×104、3×104和6×104mL-1,每组3个重复。将10 cm的培养皿上盖打开,内表面朝上,25 μL细胞悬液,逐滴整齐地滴加在皿盖上;在皿内加上3 mL PBS后,小心将皿盖扣至皿底上,再将培养皿放入培养箱中。采用倒置显微镜每隔24 h观察各组细胞的形态变化情况。
1.2.3 qRT-PCR检测 各组细胞悬滴培养后,分别提取0、24和48 h的细胞总RNA。每个时期均有3个重复。将获取的总RNA反转录试剂盒合成cDNA,以β-actin为内参基因,进行qRT-PCR检测。qRT-PCR所需引物信息见表1。
1.2.4 免疫细胞化学检测 悬滴培养48 h后,用微量移液器将各组悬滴培养后形成的EB吸出,分别接种到多聚赖氨酸处理过的24孔板内。待细胞贴壁后,用4%多聚甲醛固定30 min。PBS漂洗3次后,用10% BSA-PBS封闭液37 ℃孵育1 h。分别滴加1∶200倍稀释的一抗anti-Nanog和anti-SSEA-1,37 ℃孵育45 min后, PBST漂洗3次。再以1∶100倍稀释的FITC标记的二抗于37 ℃避光孵育45 min。PBST漂洗3次后,甘油封片,倒置显微镜下观察、拍照。
表1 qRT-PCR鉴定所需基因引物及片段大小
Table 1 Primer information for qRT-PCR

基因名称Genename碱基序列(5′→3′)Primersequence上游引物Forwardprimer下游引物Reverseprimer片段大小/bpSizeNanogF:TGGTTTCAGAACCAACGAATGAAGR:TGCACTGGTCACAGCCTGAAG180Sox2F:GAAGATGCACAACTCGGAGATCAGR:GAGCCGTTTGGCTTCGTCA100Oct4F:ACCAGCATCGAGACCAACGTGAR:TTGCAGAACCAGACCCGGACA117β⁃actinF:CAGCCATCTTTCTTGGGTATR:CTGTGATCTCCTTCTGCATCC164
1.2.5 核型分析 悬滴培养48 h后,用含有0.1 μg·mL-1秋水仙素的高糖DMEM培养基培养2~3 h。微量移液器将各组悬滴培养后形成的EB吸出,用0.25%胰酶消化细胞。参照徐琪等[15]方法进行核型分析。
1.2.6 数据处理 所有数据均采用Office2010 Excel进行统计处理,以“平均值±标准误”表示,采用SPSS19.0进行双因素方差分析。
2 结 果
2.1 鸡ESCs的特异性鉴定
培养至第3代的ESCs可形成明显的细胞克隆,且克隆边界清晰,呈鸟巢状。对这些克隆进行多能性鉴定,结果显示:经AKP染色后,ESCs克隆呈现棕红色(图1A);SSEA-1染色后,可在荧光显微镜下观察到ESCs表面的绿色荧光(图1B)。该结果表明第3代的ESCs克隆保持有干性,还处于未分化状态。
2.2 悬滴培养制备类胚体
将培养至第3代鸡ESCs细胞消化成单细胞,用普通培养液分别重悬细胞至1×104、3×104和6×104mL-13个细胞浓度,进行悬滴培养。采用倒置显微镜在0 、24和48 h观察各组细胞的形态变化情况(图2)。单个视野内对形成的类胚体计数,统计24 和48 h类胚体的形成数量,每组3个重复。结果发现:1×104mL-1细胞浓度悬滴培养24 h出现少量有10~15个细胞构成的圆球状类胚体,48 h类胚体数量增多,体积增大,隐约可见中心有囊腔形成(图2A);3×104mL-1细胞浓度悬滴培养24 h出现较多圆球状类胚体,48 h类胚体体积增大,且数量增加,开始形成囊腔(图2B);6×104mL-1细胞浓度悬滴培养24 h细胞开始增殖,并开始出现细胞聚集,有单个类胚体形成,且类胚体体积较小,约由3~8个细胞构成,48 h出现少量圆球状类胚体,此时类胚体体积小于其他两组,未观察到囊腔形成(图2C)。对单个视野下类配体形成数量统计发现,悬滴培养24 h后,1×104mL-1细胞浓度单个视野下约有22个类胚体形成;3×104mL-1细胞浓度约有53个类胚体形成,显著高于其他两个试验组;6×104mL-1细胞浓度下细胞开始增殖并形成细胞集落,仅有约3个类胚体形成。悬滴培养48 h后,各组类胚体体积增大,且数量有不同程度的增加,对1×104、3×104和6×104mL-13个细胞浓度形成的类胚体统计数分别为57、267和37。3×104mL-1细胞浓度悬滴培养48 h后,类胚体数量极显著高于其他两个试验组(表2)。

A.ESCs的AKP染色结果;B.ESCs的SSEA-1染色结果(暗场);C.ESCs的SSEA-1染色结果(明场)。→.ESCs克隆A.Stained ESCs by AKP;B.Stained ESCs by SSEA-1(dark field);C.Stained ESCs by SSEA-1(light field).→.ESCs clone图1 第3代鸡ESCs的特异性鉴定400×Fig.1 Identification of the 3rd generation chicken ESCs 400×
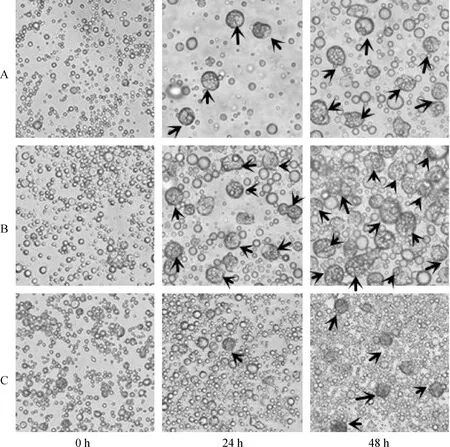
A.1×104 mL-1细胞浓度悬滴培养24 h出现少量圆球状类胚体,48 h类胚体数量增多,体积增大,隐约可见中心有囊腔形成;B.3×104 mL-1细胞浓度悬滴培养24 h出现较多圆球状类胚体,48 h类胚体体积增大,且数量大量增加;C.6×104 mL-1细胞浓度悬滴培养24 h细胞开始增殖,并出现少量集落,48 h出现少量圆球状类胚体。→.类胚体A.1×104 mL-1 cell concentration group started to form EB after 24 h,the volumn and number of EB both increased with 48 h; B.3×104 mL-1 cell concentration group formed more EB than the other groups within 24 h,and the EB’s number kept increasing within 48 h;C.6×104 mL-1 cell concentration goup only had a little EB after 24 h,and no sign for significant increase of EB within 48 h.→.EB图2 不同细胞浓度不同时间点ESCs细胞形态变化400×Fig.2 The cell morphologic change at different time spots under different cell concentrations 400×
表2 不同细胞浓度不同时间点EBs形成数量
Table 2 The number of EB at different time spot under different cell concentrations

细胞浓度/(×104mL-1)Cellconcentration0h24h48h1022±357±23053±3∗267±10∗∗603±137±3
*.P<0.05;**.P<0.01
2.3 悬滴培养过程中相关全能性基因的qRT-PCR检测
以β-actin为内参基因,将0 h的ESCs细胞表达量设为空白对照,应用qRT-PCR技术对干细胞相关基因Nanog、Sox2、C-kit和Oct4的表达情况进行检测,采用2-ΔΔCt法分析相对定量结果,SPSS16.0统计软件进行单因素方差分析。结果显示,1×104、3×104和6×104mL-13个细胞浓度48 h悬滴培养期间,干细胞相关基因Nanog、Sox2、C-kit和Oct4持续表达(图3)。各组基因相对表达量如表3所示,1×104mL-1细胞浓度48 h悬滴培养后,Nanog、Sox2、C-kit和Oct4相对表达量分别为1.68、1.13、1.48和1.01;3×104mL-1细胞浓度48 h悬滴培养后,Nanog、Sox2、C-kit和Oct4相对表达量分别为1.76、1.10、1.52和1.05;6×104mL-1细胞浓度48 h悬滴培养后,Nanog、Sox2、C-kit和Oct4相对表达量分别为1.80、1.15、1.32和1.02,各组基因表达量无显著性差异。

A.1×104 mL-1细胞浓度;B.3×104 mL-1细胞浓度;C.6×104 mL-1细胞浓度。图4同A.1×104 mL-1 cell concentration;B.3×104 mL-1 cell concentration;C.6×104 mL-1 cell concentration.The same as Fig.4图3 悬滴培养48 h ESCs的干性基因Nanog、Sox2、C-kit和Oct4的表达变化Fig.3 Relative expression levels of Nanog,Sox2,Oct4 and C-kit after 48 h hanging-drop culture
2.4 免疫细胞化学检测特异性标记物的表达
对各细胞浓度悬滴培养48 h后的类胚体进行表面抗原SSEA-1和Nanog检测。结果显示,悬滴培养所形成的类胚体SSEA-1和Nanog检测呈阳性反应,荧光下分别呈黄绿色和红色;DAPI染色为蓝色(图4)。表明悬滴培养48 h所获取的类胚体中的细胞处于未分化状态。
2.5 类胚体自发分化验证
获取3×104mL-1细胞浓度悬滴培养获得的类胚体,使用10% FBS的高糖DMEM培养基继续培养。培养过程中隔天换液,定期观察类胚体的自发分化情况。并对自发分化获得的细胞进行SOX17 (内胚层)、SMA(Smooth Mmuscle Actin)(中胚层)和TUJ-1(βIII-tubulin)(外胚层) 免疫荧光鉴定(图5)。间接免疫组化染色结果表明,类胚体自分化后内胚层标记蛋白SOX17,中胚层标记蛋白SMA和外胚层标记蛋白TUJ-1表达呈阳性。结果表明,所获得的类胚体具有分化为3个胚层的能力。
2.6 类胚体细胞核型分析
通过3×104mL-1细胞浓度悬滴培养获得类胚体,对其染色体进行核型分析。选择良好分裂相,在显微镜下计数染色体数目。结果表明,悬滴培养形成的类胚体具有并保持正常的核型,为38条常染色体和2条性染色体(图6)。
3 讨 论
类胚体是由胚胎干细胞体外培养获得的,具有向多个方向分化的潜能。类胚体是ESCs细胞发育的启动,在特定的细胞因子和微环境中可对其进行定向诱导,从而产生特定细胞。EB最早由A.Takeda[16]观察并描述,被认为是一种卵巢肿瘤内发生的现象;此后G.B.Pierce等[17]研究发现,EB可以用来形成畸胎瘤或畸胎癌;G.R.Martin等[18]克隆畸胎癌细胞进行体外培养形成了具有分化功能的EB;M.J.Evans和M.H.Kaufman[19]体外培养老鼠的胚胎干细胞形成EB。近年来,类胚体被广泛应用于体外定向诱导过程,陈明等[6]通过类胚体的体外形成,诱导生成小鼠心肌细胞。陈惠芹等[8]通过添加诱导剂,促进拟胚体中原始造血干细胞发生。而现有研究中,针对家禽类胚体形成的研究较少,尚未见有详细的报道。
本课题组一直致力于家鸡雄性生殖细胞的分化研究,目前已初步建立鸡ESCs向雄性生殖细胞分化的体外诱导体系,但是诱导效率较低,产生的雄性生殖样细胞数量较少。因此,本研究在悬滴培养的基础上,摸索鸡ESCs形成类胚体的最佳体系,以期提高体外诱导鸡ESCs生成雄性生殖细胞的诱导效率。采用1×104、3×104和6×104mL-13个细胞浓度,使用悬滴培养后观察类胚体的形成效率。研究发现,在3×104mL-1的细胞浓度下,通过不含干细胞维持因子的培养液悬滴培养48 h,类胚体数量呈对数上升,表明3×104mL-1为鸡ESCs体外悬滴培养形成类胚体的最适浓度,这与张良等[3]结论相符。
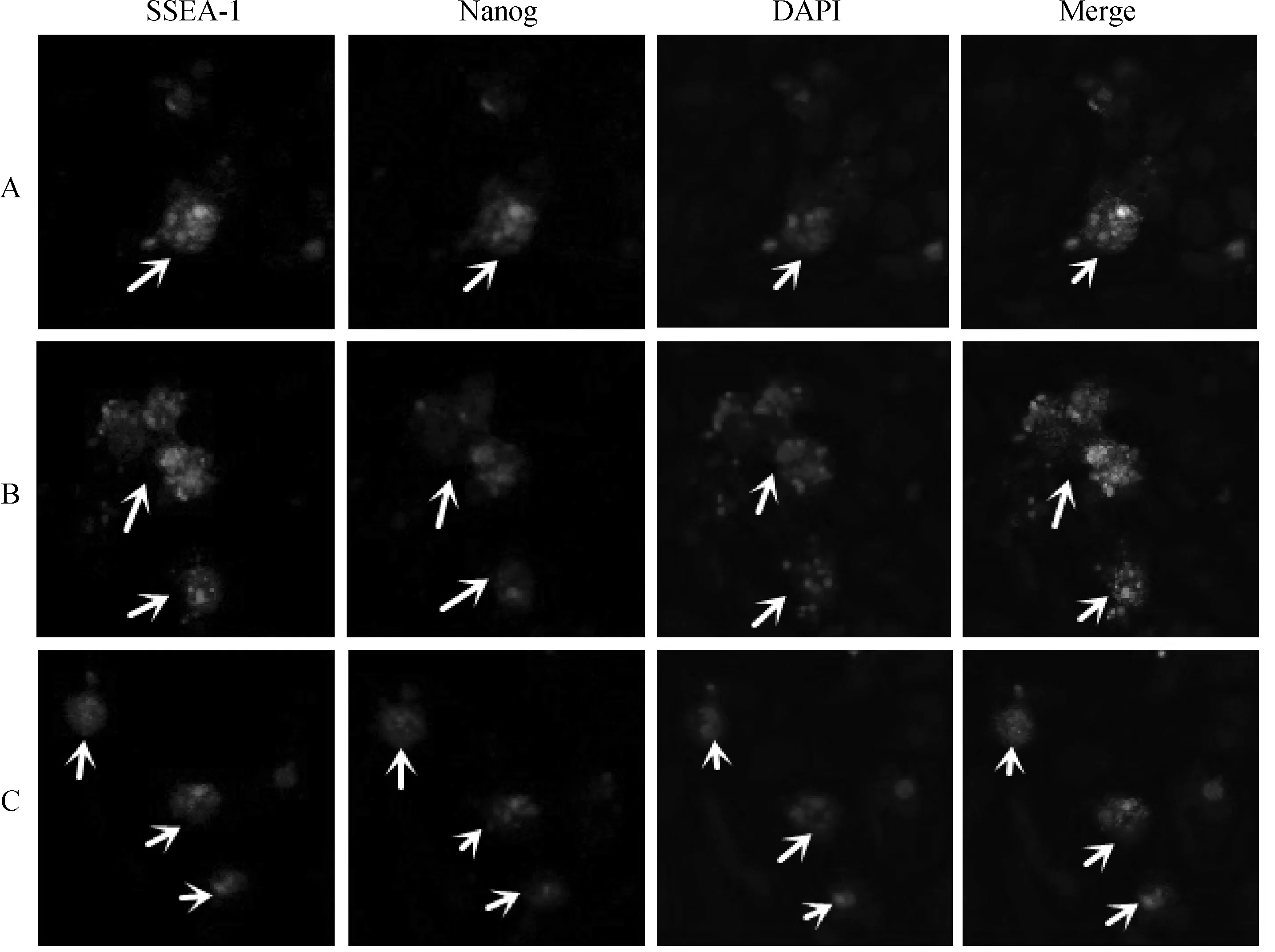
间接免疫荧光法检测各试验组悬滴培养48 h后,类胚体中干性标记蛋白的表达情况:绿色荧光为SSEA-1蛋白,红色荧光为Nanog蛋白,蓝色为DAPI染色,Merge代表合并图。→.EBAfter 48 h hanging-drop culture,immunocytochemistry showed EB was positive for SSEA-1(green),Nanog(red) and DAPI (blue) in all 3 groups,Merge were showed respectively.→.EB图4 类胚体中的蛋白免疫细胞化学检测 400×Fig.4 Expression of proteins in EB detected by immunocytochemistry 400×

类胚体自分化后检测三胚层标记基因:SOX17 (内胚层)、SMA (中胚层)和TUJ-1 (外胚层)的表达,蓝色为DAPI染色,Merge代表合并图After EB differetiated in vitro,the marker genes of 3 layer were detected by immunocytochemistry:SOX17 (endoderm),SMA (mesoderm) and TUJ-1 ( ectoderm).DAPI (blue),Merge were showed respectively图5 类胚体体外自分化免疫荧光检测200×Fig.5 Differentiation of EB in vitro detected by immunocytochemistry 200×

图6 类胚体的染色体核型分析1 000×Fig.6 Karyotype analysis of EB 1 000×
为了克服普通悬滴培养法产生EB数量少,EB大小和分化阶段不一致的问题,本研究对悬滴培养法进行了长时间的摸索和改进,采用第3代鸡ESCs形成的克隆进行类胚体培养,能获得相对较多的EB,且大小基本一致,可重复性高。对形成的类胚体进行qRT-PCR检测发现,其持续表达干性基因Nanog、Sox2、Oct4和C-kit,且免疫细胞化学检测Nanog和SSEA-1呈阳性。另外,对悬滴培养形成的类胚体进行核型分析,发现类胚体在形成过程中具有正常的核型。试验结果表明,本研究采用悬滴培养法形成类胚体具有分化潜能,能够用于体外定向诱导过程。
4 结 论
本研究采用悬滴培养法,成功建立鸡胚胎干细胞类胚体体外快速形成技术,确定3×104mL-1为鸡ESCs体外悬滴培养形成类胚体的最适浓度。所获得的EB数量相对较多,大小均一,持续表达全能性标记基因并具有分化为3个胚层的能力,且染色体核型正常。该研究为进一步优化鸡ESCs向生殖细胞定向分化体系奠定了理论和试验基础。
[1] SHARMA G T,DUBEY P K,VERMA O P,et al.Collagen-IV supported embryoid bodies formation and differentiation from buffalo (Bubalusbubalis) embryonic stem cells[J].BiochemBiophysResCommun,2012,424(3):378-384.
[2] ITSKOVITZ-ELDOR J,SCHULDINER M,KARSENTI D,et al.Differentiation of human embryonic stem cells into embryoid bodies compromising the three embryonic germ layers[J].MolMed,2000,6(2):88.[3] 张 良,黄 冰,唐仕波,等.体外培养拟胚体条件的探讨[J].中国病理生理杂志,2004,20(4):700-702. ZHANG L,HUANG B,TANG S B,et al.The explore of embryoid culture systeminvitro[J].ChineseJournalofPathophysiology,2004,20(4):700-702.(in Chinese)
[4] 赵惠萍,王绮如.胚胎干细胞形成拟胚体的几个影响因素[J].湖南医科大学学报,2003,28(1):85-86. ZHAO H P,WANG Q R.Influence factors of the formation of embryoid bodies[J].BulletinofHunanMedicalUniversity,2003,28(1):85-86.(in Chinese)
[5] RUNGARUNLERT S,TECHAKUMPHU M,PIRITY M K,et al.Embryoid body formation from embryonic and induced pluripotent stem cells:Benefits of bioreactors[J].WorldJStemCells,2009,1(1):11.
[6] 陈 明,毕琳琳,赵 芳,等.拟胚体高密度培养促进小鼠胚胎干细胞向心肌细胞分化[J].天津医药,2013,41(8):782-785. CHEN M,BI L L,ZHAO F,et al.High density culture of embryoid bodies enhanced cardiac differentiation of murine embryonic stem cells[J].TianjinMedicalJournal,2013,41(8):782-785.(in Chinese)
[7] 彭红梅,陈贵安.人类胚胎干细胞体外分化形成包含多种细胞的类胚体[J].北京大学学报:医学版,2005,36(6):605-608. PENG H M,CHEN G A.Human embryonic stem cells forming embryoid bodies comprising multiple types of cells[J].JournalofPekingUniversity(HealthSciences),2005,36(6):605-608.(in Chinese)
[8] 陈惠芹,张绪超,黄绍良,等.BMP-4 与 VEGF 促进拟胚体中原始造血干细胞发生的实验研究[J].中国实验血液学杂志,2008,16(4):855-858. CHEN H Q,ZHANG X C,HUANG S L,et al.BMP-4 and VEGF promote development of hematopoietic stem cells during the embryoid body formation from embryonic stem cells[J].JournalofExperimentalHematology,2008,16(4):855-858.(in Chinese)
[9] 田孝祥,韩雅玲,康 建,等.利用胚胎干细胞建立贴壁制备类胚体的新方法[J].沈阳部队医药,2006,19(2):82-84. TIAN X X,HAN Y L,KANG J,et al.A novel method for preparing embryoid bodies with attached embryonic stem cells[J].ShenyangMilitaryMedicine,2006,19(2):82-84.(in Chinese)
[10] 刘卫生,王英杰,刘 涛,等.模拟微重力条件下小鼠拟胚体形成及分化的初步观察[J].第三军医大学学报,2008,30(17):1594-1597. LIU W S,WANG Y J,LIU T,et al.The formation and differentiation of mouse embryoid bodies under simulating microgravity[J].ActaAcademiaeMedicinaeMilitarisTertiae, 2008,30(17):1594-1597.(in Chinese)
[11] 孙 敏,施青青,傅德智,等.鸡胚 ESC 和 SSCs 特定基因表达差异的研究[J].生物技术,2011,21(3):16-19. SUN M,SHI Q Q,FU D Z,et al.Study of the expression of gene cell differentiation associated genes on chicken ESC and SSCs[J].Biotechnology,2011,21(3):16-19.(in Chinese)
[12] 施青青,张振韬,李鹏程,等.BMP4 诱导鸡胚胎干细胞向雄性生殖细胞分化的研究[J].畜牧兽医学报,2013,44(11):1749-1757. SHI Q Q,ZHANG Z T,LI P C,et al.Study on differentiation of chicken embryonic stem cells to male germ cells by BMP4[J].ActaVeterinariaetZootechnicaSinica,2013,44(11):1749-1757.(in Chinese)
[13] 孙 敏.鸡胚胎干细胞诱导为雄性生殖细胞及转基因鸡的制备[D].扬州:扬州大学,2012. SUN M.Study on male germ cell derived from chicken embryonic stem cell and the generation of transgenic chicken[D].Yangzhou:Yangzhou University,2012.(in Chinese)
[14] EYAL-GILADI H,KAYAK S.From cleavage to primitive streak formation:a complementary normal table and a new look at the first stage of the development of the chick:I.General morphology[J].DevBiol,1976,49:321-337.
[15] 徐 琪,陈国宏,张学余,等.3个地方鸡种的核型及其似近系数分析[J].畜牧兽医学报,2004,35(4):362-366. XU Q,CHEN G H,ZHANG X Y,et al.Comparison on karyotype of three Chinese native chickens and their cluster analysis[J].ActaVeterinariaetZootechnicaSinica,2004,35(4):362-366.(in Chinese)
[16] TAKEDA A,ISHIZUKA T,GOTO T,et al.Polyembryoma of ovary producing alpha-fetoprotein and HCG:Immunoperoxidase and electron microscopic study[J].Cancer,1982,49(9):1878-1889.
[17] PIERCE G B,SPEERS W C.Tumors as caricatures of the process of tissue renewal:prospects for therapy by directing differentiation[J].CancerRes,1988,48(8):1996-2004.
[18] MARTIN G R,EVANS M J.Multiple differentiation of clonal teratocarcinoma stem cells following embryoid body formationinvitro[J].Cell,1975,6(4):467-474.[19] EVANS M J,KAUFMAN M H.Establishment in culture of pluripotential cells from mouse embryos[J].Nature,1981,292(5819):154-156.
(编辑 程金华)
Embryoid Body Formation from Chicken Embryonic Stem Cells through Suspension Culture
ZHANG Lei1,2,WANG Xiao-yan1,ZUO Qi-sheng1,LU Zhen-yu1,WANG Fei1,JI Yan-qin1, WANG Ying-jie1,ZHANG Ya-ni1*,LI Bi-chun1*
(1.KeyLaboratoryofAnimalBreedingReproductionandMolecularDesignforJiangsuProvince,CollegeofAnimalScienceandTechnology,YangzhouUniversity,Yangzhou225009,China; 2.JiangsuAgri-animalHusbandryVocationalCollege,Taizhou225300,China)
This experiment was conducted to explore the best suspension culture system for embryoid body (EB) formation from chicken embryonic stem cells (ESCs),and to improve the induction efficiency of chicken ESCsinvitro.Pure clones from the third generation of chicken ESCs was collected,re-suspensed the cells into 3 cell concentrations:1×104,3×104and 6×104mL-1to make suspension culture.Morphology changes of EB were observed,qRT-PCR and immunofluorescence methods were used to detect the marker genes’s expression,self-differentiation and karyotype analysis were made to make full test of EB.The results showed that,the amount of EB with 3×104mL-1cell concentration was higher than the other groups,and the number of EB reached 267 in one single view with the same spherical shape.The stem cell marker genesNanog,Sox2,Oct4 andC-kitremained expression with 48 h of EB formation,and stem cell surface specific antigen (NanogandSSEA-1) detection was positive.After self-differentiation of EB,3 embryonic germ layers specific antigen (SOX17,SMAandTUJ-1) detection all showed positive.Karyotype analysis showed that the formatted EB maintained normal karyotype.The results indicated that the suitable concentration for chicken ESCs form the EB through suspension culture was 3×104mL-1,and the formatted EB had viability to provide experimental foundation for chicken ESCs induction invitro.
embryoid body;suspension culture;chicken;embryonic stem cells
10.11843/j.issn.0366-6964.2015.08.008
2014-12-11
国家自然科学基金(31272429;31472087);江苏省研究生科研创新基金(CXZZ13_0909)
张 蕾(1987-),女,江苏常州人,博士,主要从事胚胎干细胞体外诱导研究,E-mail:leizhang17@sina.com
*通信作者:张亚妮,讲师,博士,主要从事动物遗传工程研究;李碧春,教授,博士,主要从事动物胚胎工程与遗传工程研究,E-mail:yubcli@yzu.edu.cn
S831.2
A
0366-6964(2015)08-1333-08
