阿尔茨海默病患者局部脑血流量及脑血管反应性研究
2013-08-11高永哲章军建吴光耀
高永哲, 章军建, 吴光耀, 刘 晖, 张 洪, 熊 丽
随着流行病学、神经影像、病理、药物治疗学以及临床研究的进展,越来越多的证据提示血管因素在阿尔茨海默病(Alzheimer’s disease,AD)的发生发展中扮演着重要角色[1],AD发生机制学说中的血管性假说也具备了越来越多的临床和实验研究的证据。
具有血管疾病危险因素的人群如高血压、糖尿病、高血脂、肥胖等已被确证为罹患AD的危险人群[2]。因此有理由推测AD患者相对正常同龄者存在脑局部血流量以及脑血管反应性的病理变化。
动脉自旋标记核磁共振(arterial spin labeling magnetic resonance imaging,ASL-MRI)是一种无创、定量测定脑血流量的技术,现已逐渐在临床广泛使用,它与灌注 CT(perfusion computed tomography,pCT)所测定局部脑血流量(regional cerebral blood flow,rCBF)值成高度线性相关,较传统的经颅多普勒(transcranial Doppler,TCD)技术更能提供精准的量化 rCBF 值[3]。
我们通过应用ASL-MRI技术定量测定AD患者局部脑血流量、吸入CO2后脑血流量变化所代表的血管反应能力,以期描述AD各脑区脑血流量、脑血管反应性(cerebrovascular reactivity,CVR)的变化特征及规律,并探讨是否可作为AD临床诊断的客观参考指标。
1 材料与方法
1.1 一般资料 序贯收录2009年11月 ~2011年11月在武汉大学中南医院神经科住院的AD患者以及非痴呆的对照组。其中AD组55例,男34例,女21例,年龄52~85岁,均值67±2.7岁;对照组58例,男35例,女23例,年龄50~87岁,均值68±2.5岁。所有志愿者或家属(照料着)签署内容详尽的知情同意书,知情同意书以及研究过程均得到武汉大学中南医院医学伦理委员会的批准及监督。
AD的诊断标准采用美国神经病学、语言障碍和卒中-老年痴呆和相关疾病学会工作组(NINCDS/ADRDA)标准[4]。每位志愿者均接受简易智能状态量表(MMSE)检测,确定均未接受过胆碱酯酶抑制剂治疗。同时收集所有志愿者的相关基础疾病史及其他信息如高血压、糖尿病、教育年限等资料。
1.2 ASL-MRI扫描 应用德国西门子公司生产的3T核磁扫描每位志愿者的脑血流量,脑血流量的测定采用脉冲式动脉自旋标记(pulsed arterial spin labelling,PASL)技术,扫描参数:QUIPSS II(定量灌注成像,使用一个单一的减法,第2版),TI1=700毫秒(时间位于反相脉冲与周期性饱和脉冲的起始之间),TI1s=1600毫秒(时间位于反相脉冲与周期饱和脉冲的末端之间),TI2=1800毫秒(时间位于反相脉冲与采集的近端图像之间),通过一个梯度回波单次激发的EPI来显示读数,采集的参数:TR/TE=2500/11毫秒,FOV=240mm,矩阵=64×64。
每位志愿者第一次扫描后,立即面罩吸入预备的5%的CO2(混合有21% 的O2及74% 的N2),面罩在常规临床应用面罩的基础上加有活瓣,确保吸气时吸入预备的气体,而呼气时将气体呼出面罩。吸入2min后,立即进行第二次ASL扫描。比较两次局部脑血流量的前后变化率,可以反映该区域脑血管反应性的能力。
在得到每位志愿者的两次脑血流量扫描图谱后,由一名经验丰富的放射科医生,对图像进行兴趣区(region of interest,ROIs)的徒手划定,界定的区域包括双侧的额、颞、顶皮质及白皮质下,双侧基底节区共14个兴趣区。划定兴趣区同时,屏幕会自动生成该区域的脑血流量(ml/100g/min)。我们采取的公式CVR=ΔrCBF=rCBFstim-CBFrest/rCBFrest×100代表脑血管反应能力。
1.3 统计处理 采用 Mann-Whitney test(GraphPad Prism 5.0,San Digeo,California,USA),所有数据以及标准差以均数±标准差()表示,统计显著性差异设定为P<0.05。
2 结果
2.1 一般资料 AD组与对照组在性别、年龄、基础疾病、受教育程度等方面相比较无显著性差异(P>0.05)。AD组与对照组,例数:55例 vs 58例;年龄(岁):67 ±2.7 vs 68 ±2.5;性别:男 34 例vs 35例,女21例 vs 23例;受教育年限(年):8.9±2.5 vs 8.5 ±2.3。
2.2 AD组与对照组在rCBF、CVR的比较。
2.2.1 与对照组相比,AD组在双侧额叶、颞叶、顶叶的皮质及皮质下,rCBF(ml/100g/min)均有明显下降(P﹤0.05):双侧额叶皮质及皮质下52.3±7.1 vs 72.6 ±7.1,52.1 ±6.7 vs 73.1 ±7.4,25.2±3.1 vs 35.7 ±3.4,25.1 ±2.5 vs 30.3 ±2.2;双侧颞叶皮质及皮质下49.7 ±7.0 vs 67.6 ±6.8,48.7 ±7.4 vs 66.4 ±6.3,24.7 ±4.1 vs 34.2 ±4.2,25.8 ±4.3 vs 39.2 ±5.2;双侧顶叶皮质及皮质下 49.2 ±7.1vs 61.7 ±6.4,49.9 ±7.5 vs 61.1 ±6.1,26.2 ±4.1vs 37.4 ±4.2,27.0 ±4.43 vs 6.4 ±4.6。
2.2.2 但在比较两组在吸入 CO2后rCBF增加率(%)时,AD组仅在双侧额叶皮质较对照组有显著性下降:右侧 27.7 ±4.1 vs 34.7 ±4.0,左侧26.8 ±4.0 vs 33.1 ±4.2(见表 1)。
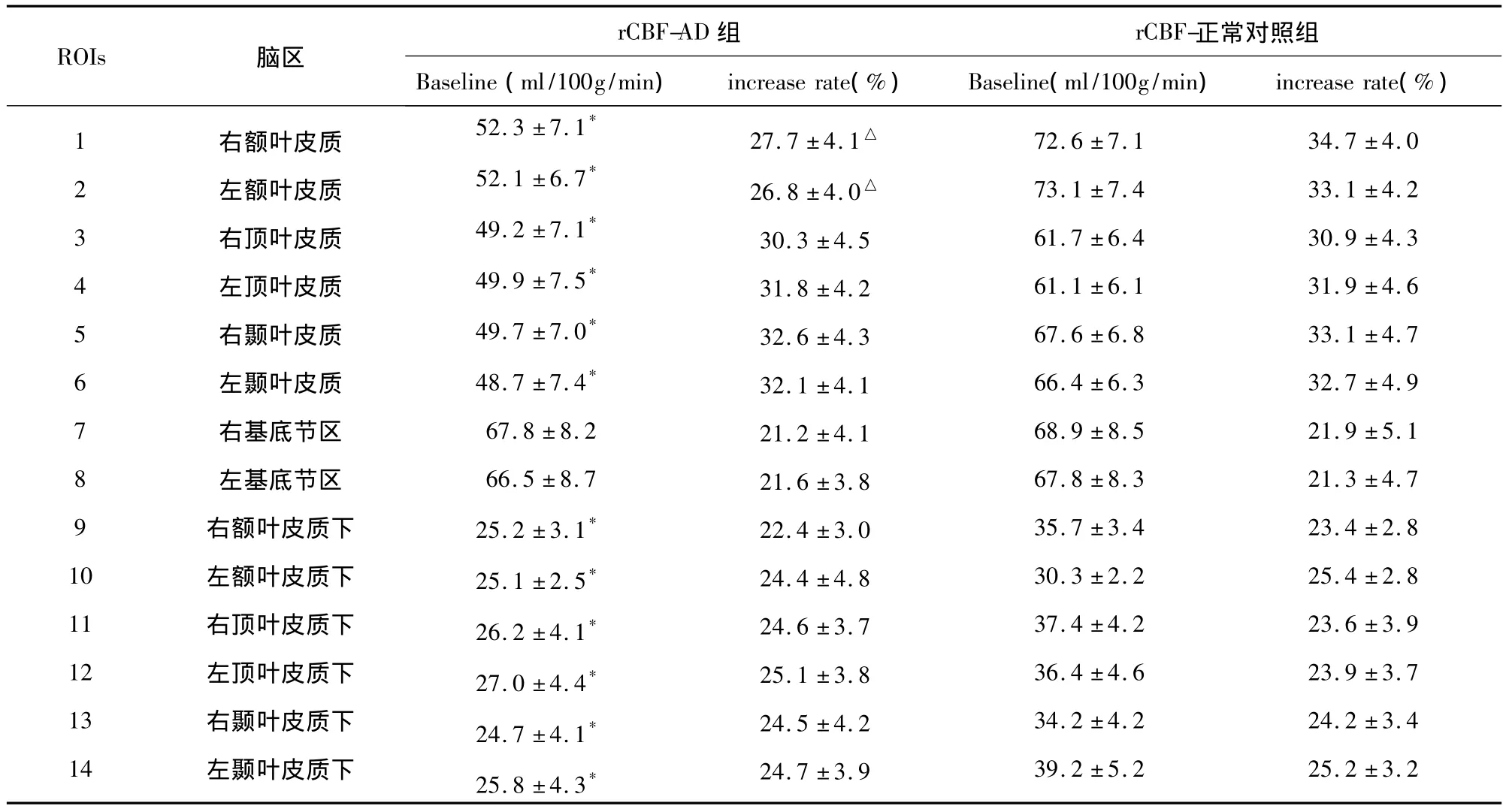
表1 各兴趣区(ROIs)静息状态下rCBF值以及吸入CO2后rCBF增加率(ΔrCBF)
3 讨论
阿尔茨海默病是一种在世界范围内发病率快速增长的疾病,其发病机制中有多个系统、途径及分子机制参与其中并相互作用,如异常的蛋白加工、信号传导、激活的免疫系统、脂质的转运、内皮的吞噬、凋亡、氧化损害及氧化应激、tau蛋白、神经元及突触的丢失、能量代谢异常等[5]。近年来,AD的血管因素越来越受到人们的关注,不仅表现在AD具有血管危险因素如高血压、糖尿病、动脉粥样硬化、高半胱氨酸血症等,甚至如胰岛素抵抗、肥胖、脑外伤也能增加罹患 AD 的风险[6,7]。Allen J最近提出的 AD微卒中学说(Micron Stroke Hypothesis)是AD病因学研究上的全新探索,微卒中学说首先定义的血管直径在8~30μm,此直径造成的卒中灶传统影像学往往不能发现。Allen J列举了AD历史上的各种学说,从1990年的自由基学说到1998年的淀粉样蛋白学说再到2004年的线粒体联级学说,发现微卒中学说可以最大程度地解释融合上述各种学说的核心要件。微卒中学说总结了AD的发生包含首要因素和次要因素,这些因素包括脑基础状态、心房纤颤、高凝状态、低密度脂蛋白、颈动脉狭窄、吸烟、高血压、糖尿病、炎性反应(高C反应蛋白及抗凝血因子Ⅲ)等,加强处理这些危险因素甚至可以在神经影像和神经心理测量出现异常前预测发生AD发生概率[8]。有学者提出AD血管性假说的两条基本路径。脑微循环障碍作为两条路径的共同始动因素,一个方向为微循环障碍致血脑屏障功能下降,致毒性物质聚集以及清除Aβ能力下降所致的Aβ沉积;另一个方向为微循环障碍导致APP表达及合成增加最终致Aβ沉积,同时微循环障碍所致的脑低灌注致p-tau增加,两条路径的结果最终影响认知功能[9]。
根据上述研究现状,我们推测AD存在血流动力学改变,首次应用ASL-MRI技术定量测定AD各脑区rCBF值。结果表明,较正常对照组,AD患者存在广泛的皮质及皮质下区域(双侧额、颞、顶叶)的rCBF下降。已有的有关AD脑血流量的研究较少,但基本支持AD患者存在不同区域、不同程度的脑血流量下降。较早的研究已发现在海马、扣带回后部灰质、颞叶皮层在临床早期即表现出CBF的下降,随着症状的加重,双侧额叶也受累及[10]。较近的一个纵向研究则进一步提示在左侧颞叶、扣带回后部、双侧额叶出现CBF下降的AD患者,将会有更快的认知下降病程、进一步更恶化的脑局部血流量紊乱病理生理过程[11]。有趣的是,如果将CBF的下降与临床特征关联起来看,可能会有更多的发现,比如那些表现为异常运动行为(aberrant motor behaviour,AMB)的AD患者,特征性地表现双侧额叶CBF 的下降[12]。
CVR是指脑动脉对血管活性物质慢性刺激的代偿性反应,包括血管的收缩舒张、口径改变而影响血流动力学,此功能对维持脑循环血量的稳定性至关重要。CVR功能损害会导致脑血管疾病,使卒中的风险增加。导致CVR损害的危险因素包括糖尿病、高血压、抑郁等。测定CVR是评价脑血管功能、脑血管病风险和预后的重要指标。临床上使用吸入CO2或注射乙酰唑胺(acetazolamide,ATZ)作为刺激源,应用 TCD、PCT、PMRI、Blood-Oxygenation-Level-Dependent(BOLD)-fMRI等技术来测定脑血流变化,从而反映 CVR 是否受损[13,14]。经典使用的TCD技术仅能作为反映脑血流量变化的间接指标,近年已逐步被ASL、BOLD等功能核磁所取代。本研究应用CO2作为刺激物,通过ASL测定吸入CO2前后rCBF的变化评估反应脑血管反应能力,结果发现,相对广泛的rCBF下降,AD患者仅在双侧额叶皮质存在明显的CVR损害。
目前有关AD患者CVR变化的研究更少见,仅Uma S应用BOLD技术的研究比较了AD患者与正常对照各脑区VCR的变化,结果发现,在前脑(包括额叶、扣带回前部、岛叶皮质)出现了明显的CVR下降,而且CVR受损的区域与CBF下降的区域(更明显的是在颞叶和顶叶)在空间分布上并不一致,原因作者并未作更多的解释,不过,他赞同如下观点:CBF的下降更多反映的是组织代谢的紊乱,而CVR更能反映血管的健康状态[15]。我们的结果与此研究结果类似,均突出了AD在前脑区域CVR能力的明显下降。同时我们推测,双侧额叶皮质无论是rCBF还是CVR的下降均可能是作为AD发生发展的前期因素而非脑萎缩后对能量代谢需求下降的结果,这也与Norbert Schuff的研究结果印证,他发现rCBF的下降与脑体积(萎缩程度)并不成相关性[16]。
4 结论
AD脑存在广泛的皮质及皮质下区域的局部脑血流量下降,同时,特征性地在前脑特别是额叶皮质表现为脑血管反应能力的下降,这可能是继脑脊液查淀粉样蛋白-β(Aβ)、载脂蛋白E基因测定等之后在AD临床诊断上又一可行的、可供参考的客观指标。
[1]Anouk GW,van Norden,Ewoud J,et al.Dementia:Alzheimer pathology and vascular factors:from mutually exclusive to interaction[J].Biochimica et Biophysica Acta,2012,1822(3):340-349.
[2]Alzheimer’s Association.Alzheimer’s Association Report:2012 Alzheimer’s disease facts and figures[J].Alzheimer’s and Dementia,2012,8(2):131-168.
[3]Koziak AM,Winter J,Lee TY,et al.Validation study of a pulsed arterial spinl a beling technique by comparison to perfusion computed to mography[J].Magn Reson Imaging,2008,26(4):543-553 .
[4]Blacker D,Albert MS,Bassett SS,et al.Reliability and validity of NINCDS-ADRDA criteria for Alzheimer’s disease.The National Institute of Mental Health Genetics Initiative[J].Arch Neurol,1994,51(12):1198-1204.
[5]Harald Hampel,David Prvulovi C,Stefan Teipel,et al.The future of Alzheimer’s disease:The next 10 years[J].Progress in Neurobiology,2011,95(4):718-728.
[6]Sivanandam TM,Thakur MK.Traumatic brain injury:A risk factor for Alzheimer’s disease[J].Neuroscience and Biobehavioral Reviews,2012,36(5):1376-1381.
[7]Bosco D,Fava A,Plastino M,et al.Possible implications of insulin resistance and glucose metabolism in Alzheimer’s disease pathogenesis[J].J Cell Mol,2011,15(9):1807-1821.
[8]Allen J,Orehek.The micron stroke hypothesis of Alzheimer’s disease and dementia[J].Medical Hypotheses,2012,78(5):562-570.
[9]Berislav V,Zlokovi C.Neurovascular pathways to neurodegeneration in Alzheimer’s disease and other disorders[J].Nature Reviews Neuroscience,2011,12(12):723-738.
[10]Matsuda H,Kitayama N,Ohnishi T,et al.Longitudinal evaluation of both morphologic and functional changes in the same individuals with Alzheimer’s disease[J].J Nucl Med,2002,43(3):304-311.
[11]Haruo Hanyu,Tomohiko Sato,Kentaro Hirao,et al.The progression of cognitive deterioration and regional cerebral blood flow patterns in Alzheimer’s disease:A longitudinal SPECT study[J].J Neurological Sciences,2010,290(1):96-101.
[12]Thomas J,Reilly R,Roger T,et al.Regional cerebral blood flow and aberant motor behaviour in Alzheimer’s disease[J].Behavioural Brain Research,2011,222(2):375-379.
[13]Schwertfeger N,Neu P,Schlattmann P,et al.Cerebrovascular reactivity over time course in healthy subjects[J].J Neurological Sciences,2006,249(2):135-139.
[14]Emmanuel Carrera,Leslie K,Lee SG,et al.Cerebrovascular reactivity and cerebral autoregulation in normal subjects[J].J Neurological Sciences,2009,285(1):191-194.
[15]Uma S,Yezhuvath JU,Yamei C,et al.Forebrain-dominant deficit in cerebrovascular reactivity in Alzheimer’s disease[J].Neurobiology of Aging,2012,33(1):75-82.
[16]Norbert Schuff,Shinji M,Joseph K,et al.Cerebral blood flow in ischemic vascular dementia and Alzheimer’s disease,measured by arterial spin-labeling magnetic resonance imaging[J].Alzheimer’s and Dementia,2009,5(6):454-462.
