不同L E D光源对小白菜生长及品质的影响
2013-08-09陈祥伟刘世琦成波刘庆马桂芹
陈祥伟,刘世琦,成波,刘庆,马桂芹
(山东农业大学园艺科学与工程学院作物生物学国家重点实验室/农业部黄淮地区园艺作物生物学与种质制作重点实验室,泰安,271018)
光质即不同波长的光谱,是植物生长发育重要的环境因子之一,对植物的形态建成、生理代谢、光周期反应、生长发育及品质有广泛的调节作用。在20世纪初期,已有学者对光周期对作物生长发育的影响进行了研究[1]。20世纪80年代研究表明,蓝光可降低植物体内IAA水平而抑制生长,红光可促进植物子叶伸长,抑制茎的过度生长;蓝光可促进烟草叶片中叶绿体发育基因的合成,但可被红光逆转[2]。光对植物的营养物质的含量影响也很大[3,4],研究表明,光强对植物的营养物质的含量有显著的影响[5,6]。但是光质对作物的影响更重要也更复杂,由于不同作物对不同光质具有不同的响应,因而许多研究具有不同的结论,红蓝混合光可以提高韭菜[7]和青蒜苗[8]的营养品质;红光有利于草莓的生长,而蓝光却提高了果实品质;蓝光能增加番茄花青素含量[9]、咖啡树类胡萝卜素含量和生菜、小松菜维生素C含量[10],而紫外线A能增加葡萄[11]和生菜[12]的花青素含量。到目前为止对光质的研究依然是国内外的热点。
与传统人工光源相比,LED精量调制光源具有明显的优势:使用电源电压低、节能高效、体积小、稳定性强、响应速度快、寿命长等[13],另外,采用LED光源能得到单一波长光质,解决了以往研究中光质不纯的问题,增加了试验结果的可靠性。本试验通过LED精量调制光质,研究其对小白菜生长及品质的影响,以期探明光质对小白菜生长形态和营养品质的影响,为LED光源在小白菜设施栽培上的应用提供理论依据。
1 材料与方法
1.1 试验设计
试验于2012年11月至2013年1月在山东农业大学科技创新园及智能人工气候室进行。以华京小白菜为试验材料,试验设5个处理,LED光源处理分别为红光(R)、蓝光(B)、红/蓝=3/1(灯的数量比,3R/1B)、红/蓝=7/1(灯的数量比,7R/1B)、白/红/蓝=3/2/1(灯的数量比,3W/2R/1B),以白色 LED 光为对照(CK),均由淄博曙光科技公司提供(图1)。距离光源 50 cm 处的光强为 200 μmol·m-2·s-1。 待幼苗长至4叶1心时,选择长势一致的幼苗移入智能人工气候室,该气候室可通过计算机对植物生长过程的温度、湿度、CO2浓度进行自动监控和调节,每个处理 6 盆(长×宽×高=60 cm×30 cm×15 cm),每盆12株,3次重复,随机排列。白天温度控制在(22±1)℃,夜间(12±1)℃,光照 13 h/d,每天浇一次营养液 1 L/盆,营养液选用绿叶蔬菜通用配方,其他微量元素参照其通用配方。处理20 d后,随机取样进行相关指标的测定。

图1 LED生长培育光源
1.2 项目测定方法
随机选取 10株小白菜植株,测量茎粗、叶长、叶宽、叶柄长、根系长度,取平均值。按公式计算单叶叶面积,即单叶叶面积=叶长×叶宽×0.700 7[14],同时把以上10株植株称重。用PP-Systems公司生产的CIRAS-I便携式光合仪测定小白菜光合指标,测定时光照强度为 200 μmol·m-2·s-1,叶温为(23±1)℃,CO2气源为室外大气CO2,每处理 3次重复。过氧化物酶(POD)、过氧化氢酶(CAT)及超氧化物歧化酶(SOD)活性分别采用氮蓝四唑法、愈创木酚法和紫外吸收法[15];可溶性糖(鲜质量)、可溶性蛋白(鲜质量)、游离氨基酸(干质量)和维生素C(鲜质量)含量的测定分别采用蒽酮比色法、考马斯亮蓝法、水合茚三酮法、2,6-二氯靛酚比色法[16]。
1.3 数据分析
应用DPS和Excel软件进行数据分析,采用LSD多重比较法进行方差显著性检验。
2 结果与分析
2.1 不同光质对小白菜生长量的影响
由表1可知,不同光质对小白菜的生长发育具有明显的影响,红/蓝(7/1)处理下生物量、茎粗、叶宽、叶面积以及根系长度均高于对照和其他处理,分别比对照增加了23.69%、5.77%、21.02%、58.43%和 11.96%,其次是红/蓝(3/1)和红光(R)处理,而蓝光(B)处理下的最小,与对照相比,分别降低了 58.93%、45.97%、26.14%、87.18%和27.54%。 红/蓝(3/1)处理下叶长最大,但与红/蓝(7/1)处理差异不显著。虽然蓝光不利于小白菜叶长与叶宽的增大,但蓝光却增大了叶长/叶宽值。与对照和其他处理相比,蓝光处理下的叶柄长度最大,比对照增加了14.83%,其次是红/蓝(3/1)和红/蓝(7/1)处理。 由此可见,红/蓝(7/1)处理下生物量、茎粗、叶宽、叶面积以及根系长度均达到最大值,最有利于植株的生长发育。
2.2 不同光质对小白菜光合特性的影响

表1 不同光质对小白菜生长指标的影响
由表2可知,不同光质处理对小白菜的光合特性有显著的影响,对光合速率(Pn)、蒸腾速率(E)和气孔导度(Gs)的影响相似,红光处理下光合速率、蒸腾速率和气孔导度均高于对照及其他处理,分别比对照提高了37.77%、30.73%和23.90%,其次是红/蓝(7/1)和红/蓝(3/1)处理,而蓝光(B)处理下最小,与对照相比分别降低了54.20%、64.15%和28.30%。通过对比看出,不同光质对气孔导度的影响趋势与蒸腾速率一致。由表2还可知,胞间CO2浓度(Ci)以蓝光处理下的最大,其次为白光,红/蓝(7/1)与红/蓝(3/1)处理下的差异较小,红光下的最小,胞间CO2浓度变化趋势与光合速率相反。

表2 不同光质对小白菜光合特性的影响
2.3 不同光质对小白菜抗氧化酶活性的影响
超氧化物歧化酶(SOD)是机体内天然存在的超氧自由基清除因子,它可以把有害的超氧自由基转化为过氧化氢,尽管过氧化氢仍是对机体有害的活性氧,但体内的过氧化氢酶(CAT)和过氧化物酶(POD)会立即将其分解为完全无害的水,这3种酶便组成了一个完整的防氧化链条。由表3可知,白/红/蓝(3/2/1)以及红光(R)处理下,POD 的活性均极显著高于对照和其他处理,分别比对照增加了89.96%和70.45%;蓝光处理下的POD活性最小,比对照降低了35.55%;红/蓝(7/1)处理下的CAT活性最大,比对照高出了17.38%,其他处理均低于对照,红/蓝(3/1)处理下的CAT活性与对照差异很小,蓝光(R)处理下的CAT活性最低,比对照降低了61.86%,CAT活性由大到小依次是红/蓝(7/1)>白光(CK)>红/蓝(3/1)>白/红/蓝(3/2/1)>红光(R)>蓝光(B)。 由表 3 还可知,红/蓝(7/1)和白/红/蓝(3/2/1)处理下的SOD活性较大,分别比对照提高了11.93%和9.58%,蓝光(B)处理下的SOD活性最小,比对照降低了5.06%。综上可知,与对照和其他处理相比,红/蓝(7/1)处理具有较高的CAT和SOD活性,利于植株生长。
2.4 不同光质对小白菜营养品质的影响
由表4可知,红光处理下的可溶性糖含量显著高于对照与其他处理,比对照增加了 37.71%,红/蓝(7/1)和白/红/蓝(3/2/1)处理下可溶性糖含量差异不明显,而蓝光处理下的可溶性糖含量最低,与对照相比降低了18.46%,可溶性糖含量由高到低依次是红光(R)>白/红/蓝(3/2/1)>红/蓝(7/1)>白光(CK)>红/蓝(3/1)>蓝光(B)。白/红/蓝(3/2/1)和蓝光处理下的可溶性蛋白含量较高,分别比对照增加了11.09%和 6.05%,红/蓝(7/1)和红/蓝(3/1)处理可以提高可溶性蛋白含量,但差异不显著,而红光(R)处理下的可溶性蛋白含量最低,比对照降低了19.28%。白光(CK)处理下的维生素C和游离氨基酸的含量最高,红光和蓝光处理下维生素C含量和游离氨基酸含量较低,但2个处理差异不明显,可见红光和蓝光不利于维生素C和游离氨基酸的积累,白光以及混合光更有利于维生素C和游离氨基酸的合成与积累。
3 结论与讨论
不同光质对小白菜的生长发育具有显著的影响,本试验研究表明,红光以及不同比例的红蓝混合光对小白菜的生物量、茎粗、叶面积、根系长度都有一定的促进作用,而蓝光却抑制小白菜的生长发育,研究结论与陈文昊等[17]、唐大为等[18]、陈娴等[7]的一致,而本试验结果还显示高比例的红光与蓝光混合比单纯红光对小白菜的生长更有利,可能原因是单色光之间具有加性效应。
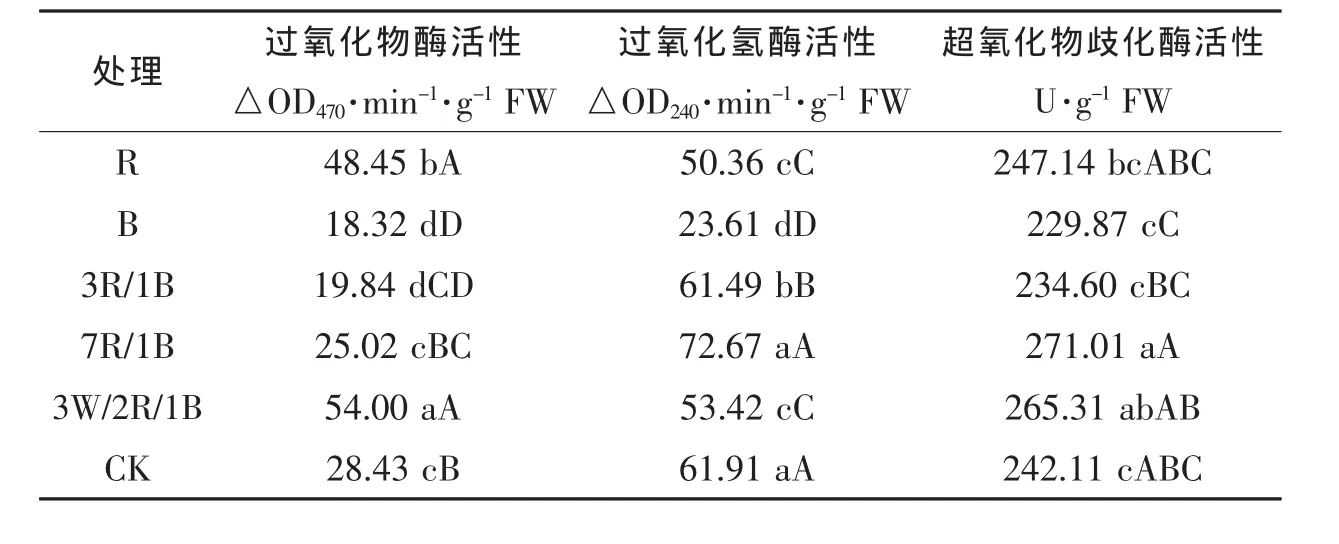
表3 不同光质对小白菜抗氧化酶活性的影响
李韶山等[19]认为红光和远红光可在转录水平上调节光合机构的组装,从而影响植物的光合作用,而不同植物由于生理特性和组织结构不同,其光合机构对适应不同光质的调控机理也有所不同。本研究结果表明,红光处理下的光合速率最大,其次是红蓝混合光,蓝光处理下的最小,这与杨晓建等[8]、陶汉之等[20]、徐凯等[21]的研究结果一致,但与张瑞华等[22]的研究结果不同,可见不同光质对不同作物的光合速率的影响不一致。小白菜的蒸腾速率、气孔导度与光合速率变化趋势类似,都以红光处理下最高,蓝光处理下最低,说明红光有利于小白菜的光合作用,可能的原因是光质影响了光合细胞的结构[23],从而影响了小白菜对光质的吸收和转化。
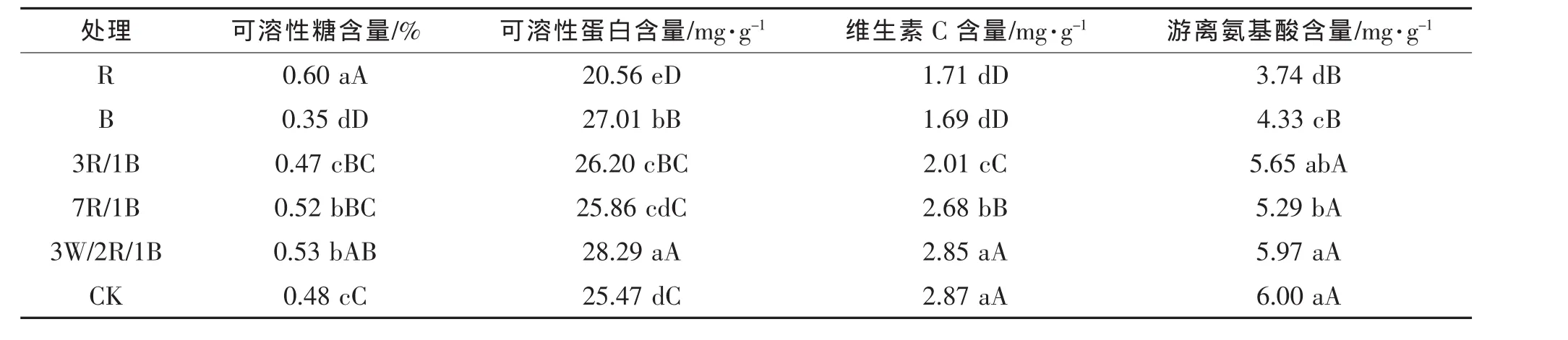
表4 不同光质对小白菜营养品质的影响
关于光质对抗氧化酶活性影响的报道,由于试验材料和方法的不同(光质不同)而得出不同结论,邢泽南等[24]和王虹等[25]分别对油葵芽苗菜和黄瓜研究发现,蓝光处理下具有较高的抗氧化酶活性;蒲高斌等[26]研究表明,红光和蓝光处理均能提高番茄幼苗POD、SOD活性,但不同光质对CAT活性影响不大。文锦芬等[27]对烟草研究发现,黄光可以提高SOD和CAT活性,紫光却降低了SOD、CAT、POD活性。本试验研究表明,不同光质处理对抗氧化酶活性的影响有一定差异,综合分析表明,红/蓝(7/1)处理下CAT和SOD活性最大,白/红/蓝(3/2/1)处理下POD活性最大,这与上述不同学者研究结论有些不同,说明不同作物对不同光质响应机理不同,还可以看出混合光较单色光更有利于提高小白菜植株抗氧化酶活性。
同时光质也能调控小白菜的品质,本研究结果表明,红光处理有利于提高可溶性糖含量,而蓝光处理却能提高可溶性蛋白含量,这与Kowallik[28]和张立伟等[29]研究结果一致。光质影响可溶性糖含量的原因是多方面的,可能是由于不同光质影响着对碳水化合物的吸收,从而改变了可溶性糖的含量[30],也可能光质的改变诱导了光敏色素对蔗糖代谢酶的调控,促进蔗糖代谢相关酶活性的提高,使更多的光合作用产物积累[31,32],其具体原因和机理有待于进一步探究。Kowallik[28]研究还表明,蓝光可显著促进线粒体的暗呼吸,为氨基酸合成提供了碳架。另外,蛋白质是大分子物质,较其他光合产物的合成需要更多能量,而蓝光区光量子能量较高,故蓝光促进蛋白的合成也可能与光质能量有关[33]。但维生素C和游离氨基酸含量均以白光处理最高,这与蒲高斌等[26]和陈强等[33]的研究结论不一致,具体原因尚不明确,需要进一步的研究探索。
[1]Garner W W,Allard H A.Effect of abnormally long and short alternation of light and darkness on growth and development of plants [J].Journal of Agricultural Research,1931,42(10):629-651.
[2]Richter G,Wessel K.Red light inhibits blue light-induced chloroplast development in cultured plant cells at the mRNA level[J].Plant Molecular Biology,1985,5(3):175-182.
[3]Kopsell D A,Kopsell D E.Genetic and environmental factors affecting plant lutein/zeaxanthin[J].Agro Food Ind Hi-Tech,2008,19:44-46.
[4]Perez-Balibrea S,Moreno D A,Garcia-Viguera C.Influence of light on health-promoting phytochemicals of broccoli sprouts[J].J Sci Food Agric,2008,88:904-910.
[5]Vergeer L H T,Aarts T L,Degroot J D.The wasting disease and the effect of abiotic factors (light-intensity,temperature,salinity)and infection with labyrinthula-zosterae on the phenolics content of zostera-marina shoots [J].Aquat Bot,1995,52:35-44.
[6]Keller M,Hrazdina G.Interaction of nitrogen availability during bloom and light intensity during veraison.II.Effects on anthocyanin and phenolic development during grape ripening[J].Am J Enol Vitic,1998,49:341-349.
[7]陈娴,刘世琦,孟凡鲁,等.不同光质对韭菜生长及光合特性的影响[J].中国蔬菜,2012(8)):45-50.
[8]杨晓建,刘世琦,张自坤,等.不同LED光源对青蒜苗生长及叶绿素荧光特性的影响[J].中国蔬菜,2011(6):62-67.
[9]Giliberto L,Perrotta G,Pallara P,et al.Manipulation of the blue light photoreceptor cryptochrome 2 in tomato affects vegetative development,flowering time,and fruit antioxidant content[J].Plant Physiol,2005,137:199-208.
[10]Ramalho J C,Marques N C,Semedo J N,et al.Photosynthetic performance and pigment composition of leaves from two tropical species is determined by light quality[J].Plant Biol,2002(4):112-120.
[11]Kataoka I,Sugiyama A,Beppu K.Role of ultraviolet radiation in accumulation of anthocyanin in berries of'Gros Colman'grapes (Vitis viniferaL.)[J].J Japan Soc Hort Sci,2003,72:1-6.
[12]Tsormpatsidis E,Henbest R G C,Davis F J,et al.UV irradiance as a major influence on growth,development and secondary products of commercial importance in Lollo Rosso lettuce'Revolution'grown under polyethylene films[J].Environ Exp Bot,2008,63:232-239.
[13]谢景,刘厚诚,宋世威,等.光源及光质调控在温室蔬菜生产中的应用研究进展[J].中国蔬菜,2012(2):1-7.
[14]张振贤,王培伦,刘世琦.蔬菜生理[M].北京:中国农业科技出版社,1993:38-39.
[15]王学奎.植物生理生化实验原理和技术[M].2版.北京:高等教育出版社,1995.
[16]赵世杰,史国安,董新纯.植物生理学实验指导[M].北京:中国农业科学技术出版社,2002.
[17]陈文昊,徐志刚,刘晓英,等.LED光源对不同品种生菜生 长 和 品 质 的 影 响[J].西 北 植 物 学 报 ,2011,31(7):1 434-1 440.
[18]唐大为,张国斌,张帆,等.LED光源不同光质对黄瓜幼苗生长及生理生化特性的影响[J].甘肃农业大学学报,2011,46(1):44-48.
[19]李韶山,潘瑞炽.蓝光对水稻幼苗叶绿体发育的影响[J].中国水稻科学,1994,8(3):185-188.
[20]陶汉之,王新长.茶树光合作用与光质的关系[J].植物生理学通讯,1989(1):19-23.
[21]徐凯,郭延平,张上隆.不同光质对草莓叶片光合作用和叶绿素荧光的影响[J].中国农业科学,2005,38(2):369-375.
[22]张瑞华,徐坤,董灿兴.光质对生姜叶片光合特性的影响[J].中国农业科学,2008,41(11):3 722-3 727.
[23]Eskins K,Duysen M,Dybas L.Light quality effects on corn chloroplast development[J].Plant Physiology,1985,77:29-34.
[24]邢泽南,张丹,李薇,等.光质对油葵芽苗菜生长和品质的影响[J].南京农业大学学报,2012,35(3):47-51.
[25]王虹,姜玉萍,师恺,等.光质对黄瓜叶片衰老与抗氧化酶系统的影响[J].中国农业科学,2010,43(3):529-534.
[26]蒲高斌,刘世琦,刘磊,等.不同光质对番茄幼苗生长和生理特性的影响[J].园艺学报,2005,32(3):420-425.
[27]文锦芬,柯学,徐超华,等.光质对烟草叶片生长发育过程中抗氧化系统的影响[J].西北植物学报,2011,31(9):1 799-1 804.
[28]Kowallik W.Blue light effects on respiration [J].Ann Rev Plant Physiol,1982,33:51-72.
[29]张立伟,刘世琦,张自坤,等.光质对萝卜芽苗菜营养品质的影响[J].营养学报,2010,32(4):390-392,396.
[30]林小苹,赖钟熊.光质对植物离体培养的影响[J].亚热带农业研究,2008,2(4):73-80.
[31]刘林,许雪峰,王忆,等.不同反光膜对设施葡萄果实糖分代谢与品质的影响[J].果树学 报,2008,25(2):178-181.
[32]Kasperbauerm J.Strawberry yield over red versus black plastic much[J].Crop Sci,2000,40:171-174.
[33]陈强,刘世琦,张自坤,等.不同 LED光源对番茄果实转色期品质的影响[J].农业工程学报,2009(5):156-161.
