金针菇液体菌种培养基及培养条件的优化
2013-08-09徐学锋沈敏谭明艳陈小燕
徐学锋,沈敏,谭明艳,陈小燕
(华南农业大学食品学院,广州,510642)
金针菇(Flammulina velutipes)是一种优质食用菌,富含蛋白质、氨基酸、维生素、矿质元素等多种营养物质[1],以及朴菇素(Flammutn)、蒜菇素、金针菇原素(Flamn)等功能活性成分,具有抗肿瘤、调节免疫力、促进智力发育、护肝等作用[2],早已成为人们熟知的保健食品。随着技术的革新和国内外市场需求的增长,金针菇生产方式已由传统作坊式、季节性生产,向设施化、工厂化生产方式转变[3]。作为金针菇工厂化栽培的关键技术之一,液体菌种具有生产周期短、接种便利、菌丝分散性好、萌发点多、生长快、成品率高等优点,液体菌种的应用已成为食用菌菌种及规模化、工厂化生产的发展趋势[4]。本研究采用液体摇瓶培养,对金针菇液体菌种的培养基和培养条件进行了优化,以期为金针菇栽培技术的提升提供科学依据。
1 材料与方法
1.1 试验菌株
金针菇21,购自华中农业大学菌种实验中心。
1.2 培养基
①碳源筛选培养基 在基础培养基 (蛋白胨1%,KH2PO40.1%,MgSO40.05%,维生素 B11 mg/L)中,分别加入2%的葡萄糖、蔗糖、可溶性淀粉、玉米粉4种碳源,121~126℃灭菌20 min,冷却备用。
②氮源筛选培养基 在基础培养基 (葡萄糖2%,KH2PO40.1%,MgSO40.05%,维生素 B11 mg/L)中,分别加入2%的蛋白胨、酵母膏、麸皮3种氮源,灭菌,备用。
③培养条件优化培养基 玉米粉2%、麸皮1%、酵母粉0.5%、葡萄糖1%、KH2PO40.1%、MgSO40.05%、CaCO30.2%、维生素 B11 mg/L。
④固体菌种培养基 小麦98%、白糖1%、石膏1%。小麦在清水中浸泡6~8 h,吸足水分,然后煮熟(不开粒),捞出沥干水,加入石膏粉、白糖拌匀,分装瓶中,灭菌,备用。
⑤栽培培养基 棉籽壳培养基(干料):棉籽壳78%、麸皮20%、蔗糖1%、CaCO31%,加水搅拌至含水量60%,装袋(每袋折合干料300 g),灭菌,冷却待用。
1.3 菌种活化
菌种斜面接种到PDA平板,25℃恒温培养8 d,备用。
1.4 碳源、氮源的筛选
每种不同培养基设置3个重复,用直径0.2 cm的打孔器在活化的菌种平板上打孔,摇瓶容量250 mL,装液量70 mL,接活化菌种5块,25℃静置24 h后,150 r/min摇瓶培养5 d,观察菌丝球形态,测定菌丝体生物量。
1.5 菌丝体生物量测定
取50 mL摇匀的培养液,过滤收集菌丝,蒸馏水洗涤至水变清后,将菌丝球置于恒重过的定性滤纸之上,于干燥箱60℃烘至恒重后称量[5]。
1.6 液体菌种培养条件的优化
①一级种子的制备 将PDA活化的菌种经打孔后接种到液体培养基,恒温25℃,150 r/min条件下培养2 d,作为种子备用。
②摇瓶发酵条件的优化 三角瓶容量250 mL,接种上述种子液进行摇瓶发酵,根据已有报道[5~7],以摇床转速、装液量、接种量及培养温度为4个因素,采用 L9(34)正交试验设计,详见表 1,共培养5 d,以菌丝体生物量为考察指标,进行培养条件优化,获得最佳摇瓶发酵培养条件。
1.7 最佳接种菌龄的确定
发酵培养基在最优条件下制备液体菌种,菌龄分别设4、5、6 d三组,经轻微绞碎后,接种到棉籽壳培养基,每组20袋,观察菌丝长满所耗的时间及菌丝的生长状况。
1.8 固体菌种的制备
将活化好的PDA菌种平板接种到麦粒菌种培养基,在25℃、相对湿度75%左右条件下培养至满袋后,继续培养1周,待用。
1.9 出菇试验
分别将固体和液体菌种 (菌龄5 d)接种10 g(或10 mL)到棉籽壳培养基中,各50袋,24℃、相对湿度75%左右条件下培养至满袋,继续1周后转入13~14℃菇房,相对湿度 85%~90%,出菇两茬[8],记录长满、现蕾时间及鲜菇产量,计算生物学效率,生物学效率(%)=子实体鲜质量/培养基干质量×100%。
2 结果与分析
2.1 不同碳源对金针菇菌丝体生长的影响
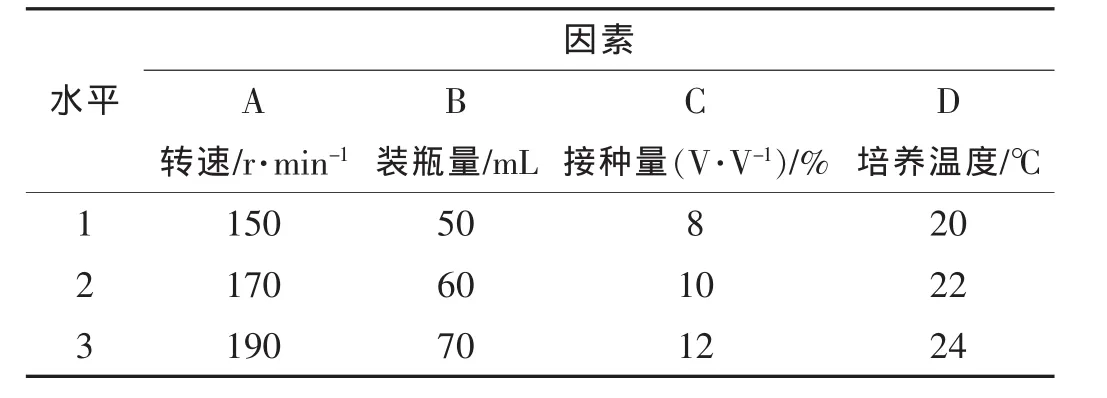
表1 摇瓶培养条件优化L9(34)正交试验设计

表2 不同碳源对金针菇21菌丝体生长的影响
以不同碳源进行金针菇液体培养均能收获菌丝,但所得菌丝干质量差异较大(表2)。葡萄糖和蔗糖产生的菌丝体较少,分别只有1.136 2和1.051 1 g/100 mL,而天然性的碳源玉米粉和可溶性淀粉产生的菌丝体干质量较大,最多达1.630 5 g/100 mL,菌丝球的形态也较优。分析原因可能是天然成分中含有有利于菌丝生长的生长因子,而葡萄糖可能具有碳代谢抑制效应,形成反馈抑制作用,不利于碳源的吸收与利用。
2.2 不同氮源对金针菇菌丝体生长的影响
3种氮源中,NH4NO3组获得的菌丝干质量最少,只有0.631 2 g/100 mL,说明NH4NO3被真菌菌丝利用得很少,在栽培过程中添加NH4NO3的意义也不大;蛋白胨作为一种半人工氮源,促进金针菇生长的作用表现一般;麸皮组中菌丝的得率最高,达1.531 9 g/100 mL,菌丝球的形态也最好,这与现实应用中常以麸皮作为辅助材料是一致的(表3)。
2.3 摇瓶培养条件的优化
①正交试验结果 对转速、装液量、接种量、培养温度4因素3水平的正交设计试验优化结果见表4。极差分析表明,A>D>C>B,说明摇床转速对液体菌种的菌体生长影响最大,其次为培养温度,再次为种子液的接种量,装液量对菌丝得率的影响最小。
理论最优的培养条件为A2B2C3D2,即摇床转速150 r/min、装液量 60 mL、接种量 12%、培养温度22℃。

表3 不同氮源对金针菇21菌丝体生长的影响
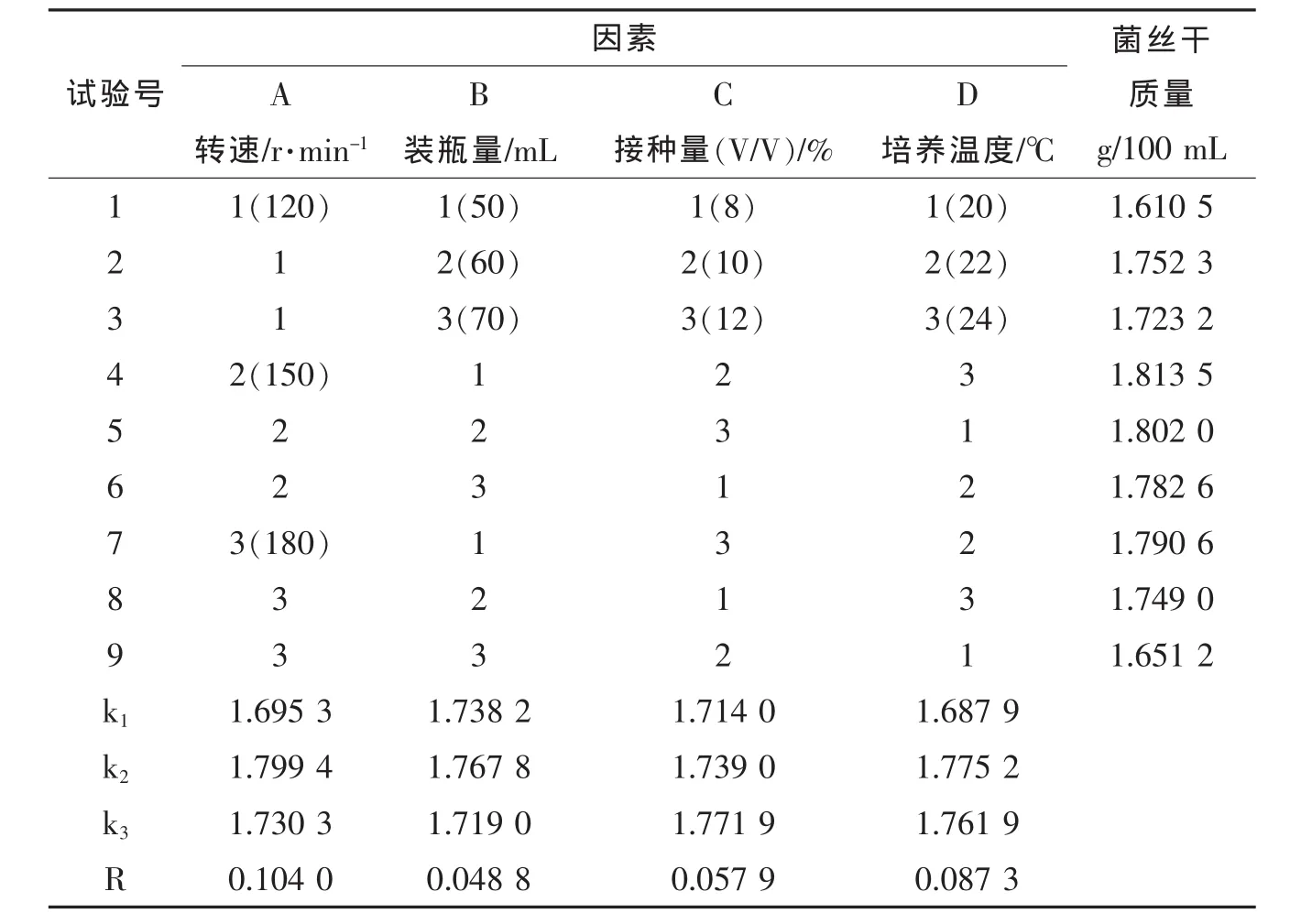
表4 摇瓶培养条件优化L9(34)正交试验结果
②验证性试验 为了进一步检验正交试验结果的可靠性,按上述最优培养条件进行验证试验,3次重复,肉眼观察发现菌丝球大小较均匀,浓度高,密度较大,经测定所得菌丝干质量为1.821 5 g/100 mL。结果表明,在优化后的培养条件下进行菌种液体培养具有较好的重复性,说明正交试验结果是可信的。
2.4 液体菌种的应用
①最佳菌龄的确定 分别将经过4、5、6 d发酵的液体菌种接种到棉籽壳培养基上后,满袋天数分别为27、25、28 d,其中发酵5 d的菌种满袋所需时间最短,菌丝健壮,长势旺。
②出菇试验结果 栽培试验中2种不同菌种接种的菌袋出菇过程的相关记录见表5。液体菌种栽培袋长满时间要比固体菌种提早9 d,头潮菇采收早7 d,二潮菇早9 d,总产量约高出5.8%。
3 小结与讨论
通过对不同碳源和氮源进行筛选,发现以玉米粉为碳源、麸皮为氮源制备金针菇21菌株液态菌种的效果较好。在此基础上进行培养条件的优化,发现当摇床转速150 r/min、装液量60 mL(三角瓶,250 mL容量)、接种量12%、培养温度22℃时所得液体菌种质量最优,菌丝干质量达1.821 5 g/100 mL。该条件下生产的液体菌种在出菇试验后发现菌丝的生长时间、出菇时间都相应提前,有效地缩短了生产周期,并且产量有所提高。
碳源和氮源是食用菌最主要的营养物质,它们几乎参与细胞代谢一切的过程。金针菇能利用的碳源和氮源范围很广[9],通常复合型的优于单一型的,有机态优于无机态。本试验筛选的结果显示,较好的碳氮源分别是玉米粉和麸皮。除了碳、氮源等主要营养元素外,包括无机盐、生长因子等其他营养成分对金针菇的生长发育的影响也十分明显,不少研究者作了很多工作[5,9]。不同菌株特异性不同,所以在营养需求上略有差异,有必要从实验室研究[10]和栽培实践[7,11]两方面协同深入。

表5 液体和固体菌种出菇比较
液体菌种的培养条件中温度是相对较为敏感的因素,有研究者发现25℃是金针菇液体菌种的最适培养温度[6,11],本试验发现最适温度为 22℃,与黄仁术[5]的结果一致。本试验优化后的最优转速与陈力力等[6]和闫长伟等[7]的结果略有差异,极差分析显示,转速对菌种的影响最大,分析原因可能是正交设计的转速差距较大造成的。摇瓶培养过程中,较高转速通常会导致菌丝球过于紧密,限制其生长,从而影响菌丝生物量,相反,转速过低又会影响营养物质的传导和溶氧量,不利于生物量的积累和菌丝活力的保持。目前,生产实践中,多采用发酵罐液体深层发酵,与摇瓶不同的是需要考察螺旋桨[11]对菌丝的剪切力和通气量[10,12]等指标,较摇瓶发酵更为精确。
由于出菇试验是小规模袋式栽培,管理过程中参数波动幅度较大[13],导致两组试验总体的生物转化率都偏低。另外,摇瓶发酵的液体菌种菌丝活力会略逊于液体深层发酵,使得液体菌种的优势发挥也不充分。所以,出菇试验的结果只是在一定程度上说明了液体菌种在栽培上有优势,在生产实践上的应用有待进一步细致深入的分析。
[1]魏华.金针菇的营养保健作用[J].食用菌学报,1995,2(1):59-64.
[2]黄年来.中国最有开发前景的主要药用真菌[J].食用菌,2005,27(1):3-4.
[3]王泽生.国内外食用菌产业现状与发展趋势[A].//中国菌物产业与科技研讨会论文集[C],2005:7-15.
[4]黄毅.食用菌工厂化设施栽培的问题与对策[J].食用菌,2003,25(6):2-4.
[5]黄仁术.金针菇液体培养营养需求及培养条件研究[J].食品工业科技,2006,27(12):89-91.
[6]陈力力,刘红,邹正.金针菇液体菌种的制备及栽培试验[J].食用菌,2011,33(2):13-14.
[7]闫长伟,陈合,陈宜鼎.金针菇液体菌种筛选及培养条件的研究[J].中国食用菌,2003,22(1):35-37.
[8]李国元.金针菇的优质栽培技术[J].长江蔬菜,1999(11):40-41.
[9]杜世彧,党阿丽,王凤云.金针菇菌丝生长的营养需求及液体发酵研究[J].微生物学通报,1997,24(3):134-137.
[10]江玉姬,谢宝贵,黄毅,等.金针菇深层培养条件研究[J]食用菌学报,2000,7(1):32-36.
[11]陈合,赵燕,秦俊哲,等.金针菇液体菌种发酵罐内深层培养条件的研究[J].食用菌,2005,27(6):21-22.
[12]李萍萍,王稳,陈娟.金针菇菌种液体培养环境因子优化研究[J].江苏农业科学,2007,35(1):154-156.
[13]于海龙,郭倩,杨娟,等.环境因子对食用菌生长发育影响的研究进展 [J].上海农业学报,2009,25(3):100-104.
