“卟啉化合物的合成、表征及性质研究”综合化学实验设计
2013-08-08孙二军王彬彬
孙二军,刘 阳,宋 哲,王彬彬
(长春师范学院化学学院,吉林长春 130032)
综合化学实验是把基础化学的理论知识和各种实验技能、实验方法加以归纳、分析并相互渗透的一种有效的实验形式,其宗旨是要培养学生的综合实验技能,最大限度地锻炼学生灵活应用所学知识和独立从事科研的能力,也是在学生完成各基础课之后向毕业论文过渡的一门实验课[1-3]。因此,自20世纪80年代起,越来越多的高校开设了综合化学实验课程。
近年来,长春师范学院在基础化学实验教学改革和实践中不断探索,把培养学生的实践能力和探索精神、激发学生的创造力作为实验教学改革的基点,侧重培养学生基本操作技能、实践能力和创新能力。2010年,长春师范学院化学学院首次开设了综合化学实验课程。课程实施两年间,取得了一定的成果,但同时也存在着一些不足之处。如:没有配套的实验教材和讲义、实验仪器不足、实验场地分散等。但笔者认为目前该课程存在的最大问题是:综合化学实验不够“综合”。以2013年以前开设的8个实验为例,分别由无机、有机、分析、物化教研室各承担2个实验,各教研室教师选择的实验内容多为自己熟悉的领域,无机侧重配合物的合成、分析侧重化学分析、有机侧重有机合成、物化侧重性质研究,造成了综合化学实验只单纯涉及本专业的实验内容,没有强调综合实验特有的综合性和整体性,也没有把各基础学科的基本技能加以揉合升华,学生的基本技能没有得到足够的系统化、综合化训练。因此,笔者结合自己的科研情况,设计出一个新的综合实验“卟啉化合物的合成、表征及性质研究”,该实验综合了有机合成、大环配位化合物的合成、分析表征、物化性质研究等各方面的内容。通过该实验,学生可以练习有机合成、萃取、薄层层析、柱层析分离等基本操作技能,还可以学习紫外-可见光谱仪、红外光谱仪、荧光光谱仪、电导率仪、电化学工作站等仪器的操作使用并学习掌握谱图的分析知识。总之,通过该实验的教学实施,可以训练学生综合运用基础化学实验的技能、查阅文献的能力、设计实验的能力、操作使用现代分析仪器的能力以及谱图解析的能力,是目前较为理想的综合实验题目之一。
1 实验目的
(1)学习卟啉化合物的合成方法;
(2)学习薄层层析、柱层析分离技术;
(3)学习利用紫外可见吸收光谱、红外光谱等测试方法对所合成化合物进行表征;
(4)学习利用荧光光谱、循环伏安法等测试方法对所合成化合物进行性质研究。
2 实验原理
卟啉是一种四卟吩大环化合物,当卟啉配体中心的两个质子氢被金属取代后即成金属卟啉。卟啉化合物与生命科学息息相关,广泛存在于自然界的生命体中,如叶绿素(镁卟啉)、血红素(铁卟啉)、维生素B12(钴卟啉)等,它们在生命过程中,对氧的传递(血红蛋白)、贮存(肌红蛋白)、活化(细胞色素P-450)和光合作用(叶绿素)等起着十分重要的作用[4],因此卟啉类化合物又被称为“生命的燃料(Pigment ofLife)”[5]。
近年来,科研工作者开发出多种卟啉配体的合成方法,如Adler法、Lindsey法、“2+2”法、“3+1”法等等,其中最为常用的就是Adler法,适合于大多数卟啉的合成,特别适用于空间位阻小、稳定性较高的芳醛与吡咯的缩合反应[6]。而且该方法可在开放体系反应,反应容器不需要密封,操作简单,投料量大,产率较高。本实验就是采用Adler法,利用苯甲醛和吡咯在丙酸中加热回流(141℃)条件下反应,反应时间约为1h,合成出四苯基卟啉,反应式见图1:
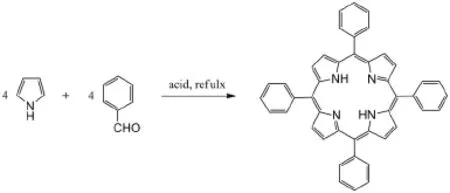
图1 Scheme1四苯基卟啉合成路线
卟啉配体分子(H2P)的四个氮原子,可以与金属配位化合,形成金属卟啉配合物,这一过程称为卟啉的金属化[7];而逆向反应则为去金属化。金属卟啉配合物(MP)的反应可按下式进行:

本实验合成过渡金属卟啉配合物采用三氯甲烷为溶剂,这是因为四苯基卟啉在三氯甲烷中有较好的溶解性。反应结束后,对有机相进行浓缩后柱层析分离,选择合适的洗脱剂,收集主要色带,经减压蒸馏后,干燥可得到金属卟啉配合物。
对于合成出的卟啉配体和金属卟啉配合物,我们需要采用多种研究方法加以表征,确定所合成的化合物是否为目标产物,这些表征手段通常包括电子吸收光谱、红外光谱、质谱、核磁共振谱等。对于合成出的卟啉类化合物,可以通过荧光光谱进行光化学、光物理性质的研究,应用循环伏安法进行电化学性质的研究,确定中心金属和配体的氧化还原状态。
3 药品及仪器
(1)药品
苯甲醛,吡咯,丙酸,氯化钴,氯化铜,氯化锌,氯化锰,氯化亚铁,氯化镍,N,N-二甲基甲酰胺(DMF),二氯甲烷(CH2Cl2),三氯甲烷(CHCl3),薄板层析硅胶,柱层析硅胶等。
(2)仪器
紫外-可见分光光度仪,付里叶变换红外光谱仪,电导率仪,CHI660型电化学工作站,分析天平,电磁加热搅拌器,层析柱,旋转蒸发仪,三用紫外分析仪等。
4 实验步骤
4.1 卟啉化合物的合成与分离
在250ml的三口瓶中加入7.5g(约0.05mol)苯甲醛及150ml丙酸,电磁加热搅拌器中加热至沸腾,再用滴液漏斗滴加新蒸吡咯3.5g(约0.05mol)与10ml丙酸的溶液,在5min内加完,继续加热回流45min,然后改为蒸馏装置,减压蒸出约120ml丙酸后,冷却4h,过滤,粗产物用少量乙醚洗涤,得紫色固体。用层析薄板选择合适的淋洗剂(通常在二氯甲烷、环己烷、无水乙醇、丙酮、乙酸乙酯中选择单一溶剂或混合溶剂),然后进行柱层析,收集紫色带,溶液旋转蒸发至干,真空干燥,计算产率。
4.2 金属卟啉配合物的合成与分离
在100ml的三口瓶中加入0.12~0.15 g四对苯基卟啉和30 ml DMF与CHCl3混合溶剂,在N2保护下,搅拌加热,至回流时加入卟啉量的10倍摩尔量的金属氯化物,并保持回流状态20~30 min。使用薄层层析或紫外-可见光谱监测反应进程。反应结束后,将反应产物倒入50 ml蒸馏水中,萃取分液,收集有机层,浓缩。用薄板层析硅胶板选择合适的洗脱剂(二氯甲烷、乙酸乙酯、石油醚的合适配比),得到较好的分离效果,进行柱层析,收集金属卟啉配合物所在色带,旋转蒸发至干,真空干燥,计算产率。
4.3 卟啉配体与金属卟啉配合物的表征
4.3.1 紫外-可见光谱
准确称取一定量的卟啉配体和卟啉金属配合物,配制1.0×10-5mol·L-1的CHCl3溶液。测定700~350 nm范围内的紫外-可见光谱,并说明光谱的主要特点。
4.3.2 红外光谱
以KBr压片,测定卟啉配体和金属卟啉配合物的红外光谱。参考文献指出配合物的主要特征吸收峰的经验归属。
4.3.3 电导率的测定
称取一定量的卟啉配体和卟啉金属配合物,配制成1.0×10-3mol·L-1的DMF溶液。用电导率仪测定其电导率。
4.4 卟啉配体与金属卟啉配合物的性质研究
4.4.1 荧光光谱
准确称取一定量的卟啉配体和卟啉金属配合物,配制1.0×10-5mol·L-1的CHCl3溶液。以420 nm为激发波长,样品池为1 cm×1 cm×4 cm石英池,狭缝宽度5.0 nm,室温条件下测定卟啉的荧光发射光谱,记录最大发射波长λem。
4.4.2 电化学性质
准确称取一定量的卟啉配体和卟啉金属配合物,配制1.0×10-3mol·L-1的CH2Cl2溶液。以四丁基高氯酸铵(TBAP)为支持电解质,利用电化学工作站测定化合物的循环伏安曲线。
5 结果与分析
5.1 紫外-可见光谱
典型的卟啉化合物的紫外-可见吸收光谱包括一个强的Soret吸收带和若干个弱的Q带。这是由于电子跃迁造成的,电子从基态(S0)可以跃迁到两个最低激发单重态(S1和S2),电子从S0→S1在可见光区域产生四个弱的Q带(500~700 nm),S0→S2在近紫外区(380~450 nm)产生强的Soret吸收带。由图1所示,卟啉配体的Soret带出现在420nm,四个弱的Q带分别为515 nm、550 nm、590 nm、645 nm。金属锌卟啉配合物的Soret带出现在425 nm,Q带出现在555 nm、595 nm,金属锰卟啉配合物峰强度较弱,Soret带红移至480 nm,Q带出现在585 nm、620 nm。化合物吸收光谱的Soret带发生移动且Q带数量减少是形成金属卟啉配合物的特征之一,可以用来判断卟啉金属化是否完成。吸收光谱发生变化的原因是因为卟啉大环中心被金属离子络合后,大环上的4个N原子均与中心金属离子配位,从而使金属卟啉分子的对称性发生变化,由配体的D2h变为配合物的D4h,且能级靠近,分子轨道的分裂程度减少,简并度增加,使得吸收峰数目减少[8]。
5.2 红外光谱
通过红外光谱特征峰的归属可以判断出化合物包含的特征基团,如卟啉配体在3318、968 cm-1处的振动峰归属为卟啉环中心NH伸缩振动和弯曲振动,是卟啉配体典型的特征峰,当金属离子嵌入卟啉环后,这两处特征峰消失,这是卟啉配体生成卟啉配合物的红外光谱的主要证据之一。生成金属配合物后,卟啉化合物的骨架振动也会发生一些移动,如卟啉配体在991 cm-1处的骨架振动峰,生成配合物后会向长波数方向移动且强度增加,如锌卟啉在993 cm-1附近、锰卟啉在1010 cm-1附近会出现一个强吸收峰,这也是卟啉配体生成卟啉配合物的红外光谱的主要证据[9]。
5.3 电导率
通过比较卟啉配体与各金属卟啉配合物的电导率可以判断化合物为何种电解质。研究表明,卟啉配体及锌、镍、铜卟啉配合物为非电解质型化合物,而锰、铁卟啉配合物为1:1电解质型化合物。
5.4 荧光光谱
如图2所示,不同金属卟啉配合物的荧光光谱明显不同,卟啉配体和锌卟啉配合物荧光较强,其他金属卟啉配合物的荧光强度较弱,而且存在这样一个规律:金属原子的原子序数越大,荧光被抑制的程度也越大;而具有顺磁性的金属锰和铁的卟啉配合物未观察到荧光光谱。
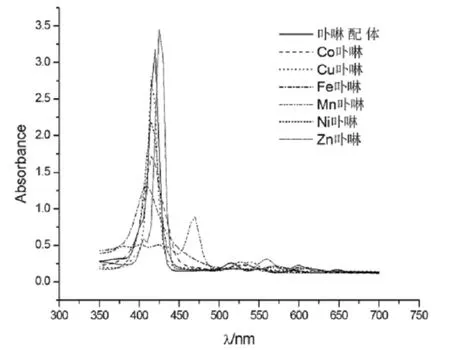
图1 紫外可见光谱图
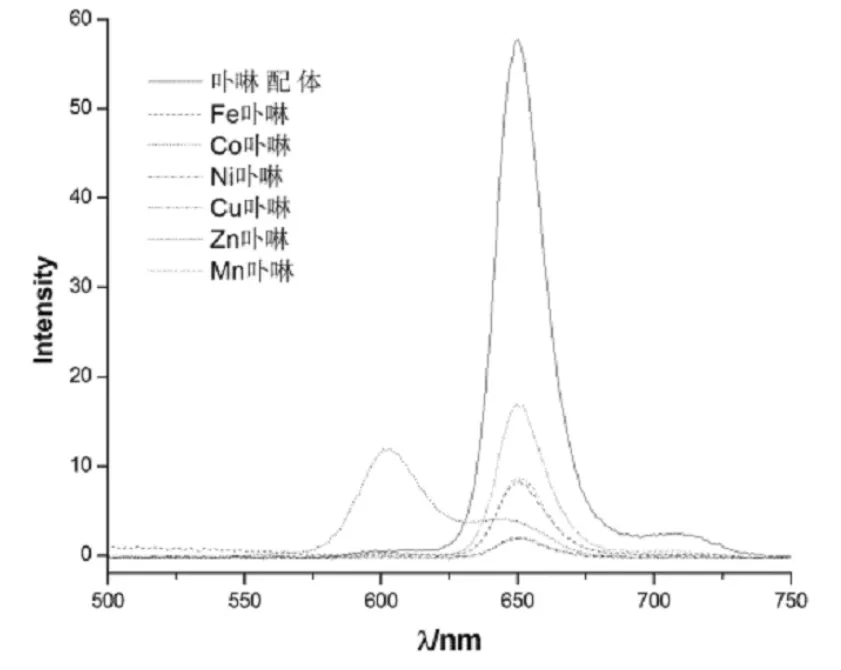
图2 荧光光谱图
5.5 电化学性质
通过循环伏安曲线可以观察到卟啉配体有四对氧化还原峰,分别对应于卟啉环的四步氧化还原反应。当金属离子与卟啉配位后,配合物卟啉环的氧化还原半波电位均负移,其中,Zn负移最大,Ni和Cu次之,Fe稍有正移。这也是因为相比卟啉配体,金属卟啉配合物的对称性发生变化,卟啉大环的共轭效应增强,电子密度降低,使得卟啉配合物相比卟啉配体更容易发生还原反应[10]。锰、铁、钴卟啉配合物的循环伏安曲线除了卟啉环发生氧化还原外,还能观察到金属离子的氧化还原反应。
6 结论
从前面的实验介绍可以看出,“卟啉化合物的合成、表征及性质研究”这一综合实验具有很强的综合性,能够帮助学生掌握多种实验操作,提高学生实验能力。实践证明,该实验是目前一个比较理想的综合实验。
[1]顾云兰,陶建清,吴秀红.综合化学实验教学改革的探索与实践[J].广东化工,2010,37(6):156-160.
[2]吴性良,陆靖.综合化学实验内容及课程体系的设计[J].实验技术与管理,2001,18(2):108-110.
[3]毛宗万,吴京洪,乔正平,等.建设综合与创新化学实验新体系的认识与实践[J].今日化学,2005,20(1):21-24.
[4]Jin R H.Silicapolyoxazoline hybrid with nanosized hollowenclosingporphyrin in hybrid walls[J].J ChemSoc,ChemCommun,2002:198-203.
[5]The Porphyrins Handbook,J.M.Smith Ed.:Elsevier Press,2002,Vols.12.
[6]AdlerAD,LongoFR,FinarelliJD,etal.Asimplified synthesisformeso-tetraphenylporphyrin[J].J.Org.Chem,1967,32:476-482.
[7]孙二军.系列酰胺基苯基卟啉液晶及其金属配合物的合成与性质研究[D].长春:吉林大学,2008.
[8]柳巍,师同顺.低相变温度锌卟啉液晶的合成与表征[J].化学学报,2001,59(4):466-471.
[9]师同顺,柳巍,王银杰.四(对-辛酰氧基)苯基卟啉配合物的红外光声光谱[J].高等学校化学学报,1998,19(11):1794-1798.
[10]孙二军,王栋,程秀利,等.5,10,15,20-四(对-十四酰亚胺基苯基)卟啉及其锰、锌配合物的合成及性质[J].高等学校化学学报,2007,28(7):1208-1213.
