聚酰胺固相萃取法检测动物源食品中全氟辛酸和全氟辛烷磺酸
2013-08-07林钦
林 钦
(福建省产品质量检验研究院,福建 福州 350002)
近年来,全氟化合物(PFCs)因其具有很高的化学稳定性和难以生物降解,被广泛应用于生产涂料、装潢材料、塑料、包装材料等。同时全氟物质的残留问题也日益引起全球的广泛关注。研究表明,全氟辛酸(foods of animal origin; perfluorooctanoic acid,PFOA)和全氟辛烷磺酸(perfluorooctane sulphonic acid,PFOS)具有遗传毒性、雄性生殖毒性、神经毒性、发育毒性和内分泌干扰作用等多种毒性,被认为是一类具有全身多器脏毒性并能引起癌变的环境污染物[1-2]。因此,开展动物源产品中全氟化合物PFOA、PFOS残留的检测方法研究,对于研究全氟化合物PFOA、PFOS的污染状况并制定相关产品的限量指标具有积极的意义。
目前,国内有关全氟化合物的报道主要着重于研究全氟化合物对环境的污染情况及对纺织品、皮革制品中及环境水样和污泥中全氟化合物的检测,测定方法主要有高效液相/四极杆-飞行时间串联质谱法[3]、液相色谱-串联质谱技术[4-11]和气相色谱法[12-14]等。迄今为止,我国已发布了多个针对食品包装材料、食品接触材料和化工产品等的PFOA、PFOS残留检测标准[15-17],但尚未出台食品中全氟化合物测定的标准方法。由于食品普遍存在着全氟化合物的污染,而食品的种类繁多,基体的干扰因素很多且各不相同,这对样品的提取技术和净化技术都提出了很高的要求。目前对食品中全氟化合物的检测方法报道还较少。本实验重点研究动物源产品中全氟化合物PFOA、PFOS残留的样品处理技术、不同基体的干扰及消除,在此基础上建立UPLC-MS/MS测定动物源食品中PFOA、PFOS的方法。
1 材料与方法
1.1 材料与试剂
所用试剂除特别标注外均为分析纯,水为超纯水;甲醇、乙腈(色谱纯) 山东禹王集团;全氟辛酸(CAS 335-67-1,C8HF15O2,纯度98.0%)、全氟辛烷磺酸钾(CAS 2795-39-3,C8HF17O3S.K,纯度98.5%) 德国Dr.Ehrenstorfer GmbH公司。
1.2 仪器与设备
Acquity UPLC系统(配有Quattro Premier XE串联四极杆质谱仪) 美国Waters公司;Avanti J-E冷冻高速离心机 美国贝克曼公司;12管固相萃取装置 美国安捷伦公司。
1.3 方法
1.3.1 标准溶液的配制
分别准确称取30.0mg全氟辛酸和全氟辛烷磺酸钾标准品,加入甲醇溶解、定容到100mL作为混合标准储备液,准确移取适量混合标准储备液,用体积分数50%的甲醇溶液稀释成1~60ng/mL的标准系列。
聚酰胺固相萃取小柱制作:取3mL的固相萃取用空柱,下端放一筛板,将100~200目的聚酰胺粉加入甲醇成浆状,湿法装填,使上筛板用玻璃棒压实后聚酰胺填料的厚度约为2cm,使用前用3mL体积分数5%的氨水-甲醇溶液、3mL甲醇和3mL体积分数为0.5%的甲酸溶液活化。
酸化乙腈:500mL乙腈+2.5mL甲酸。
1.3.2 样品处理
取约200g样品破碎均匀,称取5.00g样品,置于50mL离心管中,加入20.0mL酸化乙腈,旋紧盖子,振摇混匀,置于超声波振荡器中提取30min,取出,再加入2.0g氯化钠,振摇1min,于4℃,15000r/min离心5min,取5.0mL上清液于50mL试管中,再加入10mL 0.5%甲酸混匀,将溶液通过聚酰胺小柱,控制流速1~2mL/min,用3mL水和2mL 30%甲醇淋洗小柱,抽干,用3.0mL 5%氨水-甲醇洗脱并收集,置于40℃水浴中氮吹近干,再用50%甲醇定容到2.0mL,混匀,用0.2μm聚四氟乙烯(PTFE)滤膜过滤后检测。
1.3.3 液相色谱分析条件
色谱柱:Waters BEH C18(100mm×2.1mm,1.7μm);柱温:35℃;进样量:10μL;流速:0.3mL/min;流动相及梯度:A为5mmol/L乙酸铵-甲醇(95:5,V/V)溶液,B为甲醇;0~0.8min,35% A~30% A;0.8~1.5min,30% A;1.5~3.0min,30% A~10% A;3.0~3.5min,10% A;3.5~5.5min,35% A。
1.3.4 质谱分析条件
电离源:大气压电喷雾离子源负离子模式;毛细管电压3.00kV;源温度120℃;脱溶剂气温度350℃;脱溶剂气流量700L/h;锥孔反吹气流量50L/h;碰撞室压力2.7×10-3mbar;电子倍增管电压800V;检测方式:多反应监测(multi reaction monitoring,MRM)模式;特征离子见表1。
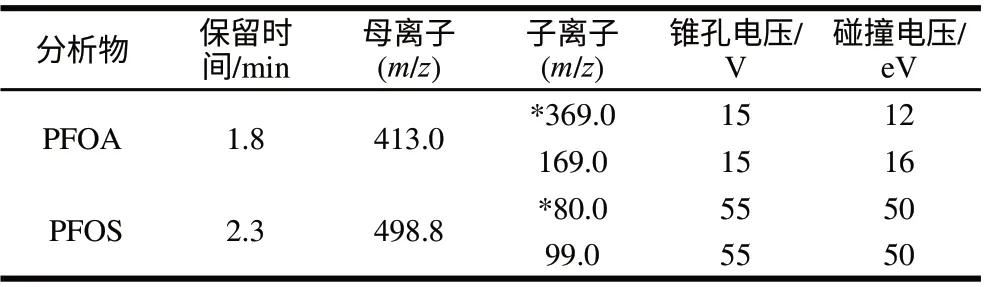
表1 主要质谱参数Table 1 MS/MS parameters for analysis of PFOA and PFOS
2 结果与分析
2.1 质谱条件的选择
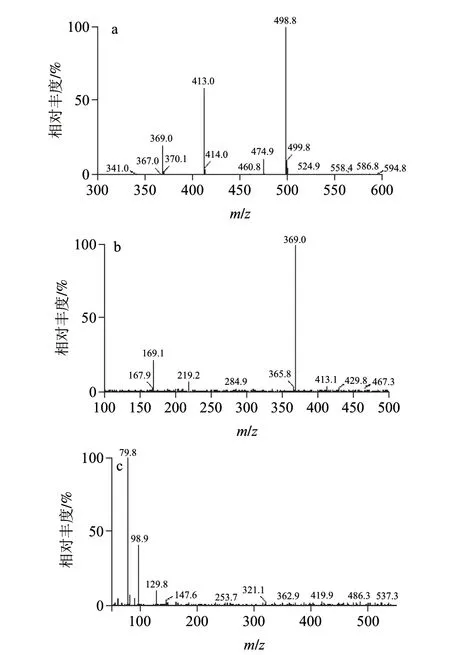
图 1 PFOA和PFOS质谱分析图 Fig.1 Mass spectra of PFOA and PFOS
配制5μg/mL PFOA和PFOS标准溶液,由注射泵直接进样,首先作一级质谱全扫描,扫描结果在ESI模式下,PFOA母离子为m/z 413.0,PFOS母离子为m/z 498.8。再对母离子进行子离子扫描,通过优化碰撞能量等参数得到PFOA和PFOS的子离子扫描质谱图(图1),最终确定PFOA和PFOS的定量和定性子离子及相应的质谱参数如表1所示。
2.2 色谱条件的优化
本方法采用超高效液相色谱技术和1.7μm粒径的C18色谱柱,具有极高的分离效率,在考虑色谱柱的耐酸碱性能基础上,研究纯水-甲醇体系、0.02%氨水-甲醇体系和5mmol/L乙酸铵-甲醇体系作为流动相的分离效果,实验发现5mmol/L乙酸铵-甲醇体系具有最佳的峰形和灵敏度。调整5mmol/L乙酸铵-甲醇洗脱梯度为1.3.3节条件时,全氟辛酸(tR=1.8min)和全氟辛烷磺酸(tR=2.3min)的色谱分离图见图2。
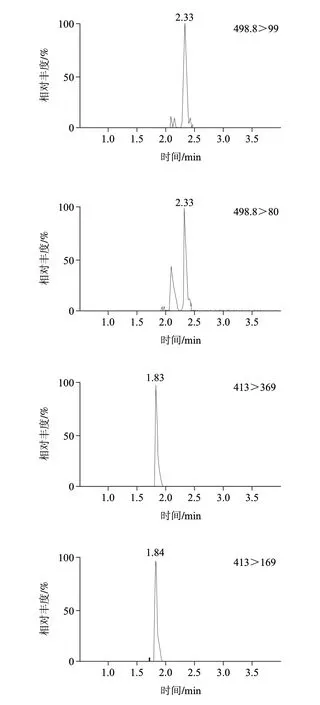
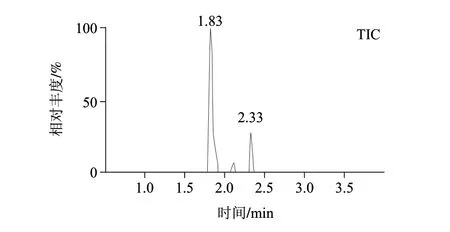
图 2 PFOA(38ng/mL)和PFOS(39ng/mL)的选择离子监测图及总离子流图Fig.2 MRM and TIC chromatograms of PFOA (38 ng/mL) and PFOS (39 ng/mL)
2.3 试样前处理条件的选择
2.3.1 提取液的选择
由于水产品、牛奶等动物源食品的含水量较大,因此,实验中采用乙腈提取样品后加入2g氯化钠盐析分离水和乙腈。采用牡蛎加标样品比较乙腈和酸化乙腈的提取效果,结果表明采用酸化乙腈提取法具有更高、更稳定的回收率(表2)。
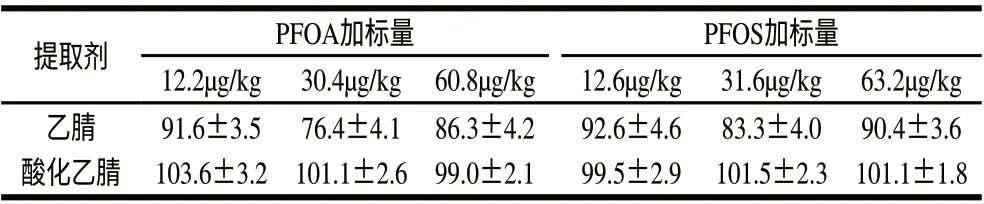
表2 不同提取液对全氟辛酸和全氟辛烷磺酸的回收率比较(n=3) Table 2 Effect of extraction solvent on the recovery rates of PFOA and PFOS (n=3)
2.3.2 固相萃取净化柱的选择
目前,文献报道的全氟辛酸和全氟辛烷磺酸固相萃取柱主要有Oasis HLB柱[3]和Oasis WAX柱[5-7]。由于这两种固相萃取小柱的价格均较昂贵,因此,本实验研究了价格低廉的中性氧化铝和聚酰胺填料对全氟辛酸和全氟辛烷磺酸的吸附效果。实验发现全氟辛酸能被中性氧化铝吸附而全氟辛烷磺酸不被保留;同时,实验发现在酸性条件下,全氟辛酸和全氟辛烷磺酸均能被聚酰胺填料牢固吸附而在碱性条件下脱附。最后,实验针对聚酰胺固相萃取柱的装填、过柱溶液、淋洗液和洗脱液进行了优化。
2.3.2.1 填料厚度的选择
实验使用3mL固相萃取柱,下端放一筛板,将100~200目的聚酰胺粉加入甲醇成浆状,采用湿法装填,上筛板用玻璃棒压实。比较1.0、1.5cm和2.0cm三种厚度的聚酰胺小柱萃取效果,回收率见表3。
由表3可知,1.5cm和2.0cm的聚酰胺小柱对全氟辛酸和全氟辛烷磺酸均有90%以上的回收率,而1.0cm的聚酰胺小柱对全氟辛酸回收率低于70%,因此,为了保证回收结果的稳定性,最后确定采用2.0cm的聚酰胺小柱。
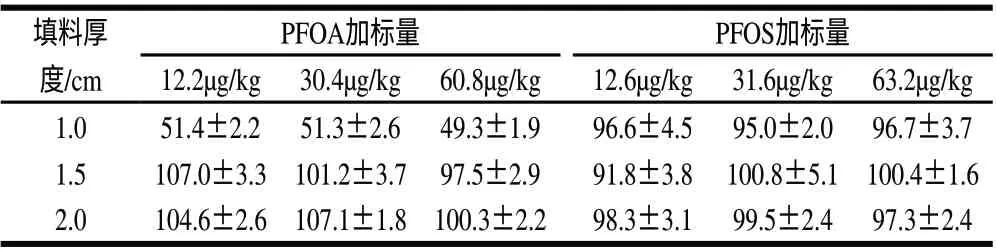
表3 不同填料厚度对全氟辛酸和全氟辛烷磺酸的回收率比较(n=3) Table 3 Effect of packing height of column on the recovery rates of PFOA and PFOS (n=3)
2.3.2.2 提取液加酸化水稀释比例选择
取2.0mL标准溶液,按体积比1:1、1:2和1:3的比例用0.5%甲酸稀释后过聚酰胺柱处理后检测,PFOA的回收率为92.0%、100.5%和100.6%,PFOS的回收率为96.3%、100.0%和100.3%,可见采用1:2的稀释比例过柱,PFOA和PFOS的回收率就可以达到100%,因此,最终采用1:2的稀释比例。
2.3.2.3 淋洗液的选择
为了尽可能去除杂质的干扰,实验比较3mL水淋洗、2mL 30%甲醇淋洗、2mL 50%甲醇淋洗和1mL甲醇淋洗的回收率结果,PFOA的回收率为99.2%、96.9%、88.1%和71.4%,PFOS的回收率为99.1%、95.3%、93.0%和88.0%,为确保PFOA和PFOS的回收率,最终采用3mL水淋洗后再用2mL 30%甲醇淋洗的净化方法。
2.3.2.4 洗脱液体积的选择
实验采用5%氨水-甲醇作为洗脱剂,比较1.0、2.0mL和3.0mL洗脱剂的洗脱效果,PFOA的回收率为90.2%、100.8%和99.1%,PFOS的回收率为32.1%、74.8%和99.2%,可见洗脱剂体积对PFOS的回收率有很大的影响,因此,最终确定使用3.0mL 5%氨水-甲醇洗脱聚酰胺小柱。
2.3.2.5 定容液的选择
实验发现用甲醇或乙腈溶解样品,进样10μL时,PFOA和PFOS的色谱峰发生严重的扩展,无法进行准确的定性和定量;但随着溶剂中水含量的提高,色谱峰的展宽得到改善。实验比较了纯水、20%甲醇、50%甲醇和75%甲醇作为溶剂的出峰效果,选取50%甲醇作为溶剂,既能保证良好的峰形,又能让样品溶液易于过滤。
2.3.2.6 净化效果的比较
实验将该富集、净化方法与目前普遍采用的Oasis WAX 60mg/3mL弱阴离子交换固相萃取法进行比较,回收率结果见表4。
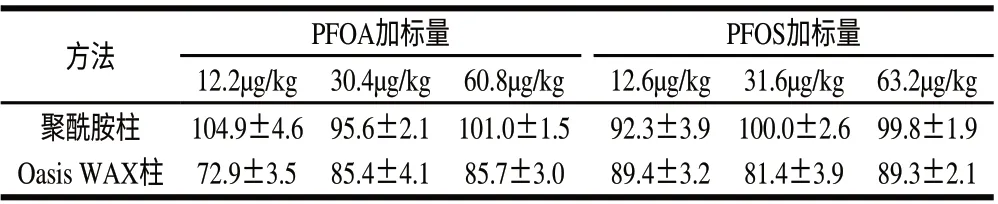
表4 不同萃取柱对全氟辛酸和全氟辛烷磺酸的回收率比较(n=3) Table 4 Effect of SPE column type on the recovery rates of PFOA and PFOS (n=3)
由表4可知,聚酰胺固相萃取法具有更好的回收效果,而其成本只有Oasis HLB柱和Oasis WAX柱的十分之一甚至更低。
2.4 线性范围
取标准储备液用50%甲醇配成1~60ng/mL的标准系列溶液,以PFOA和PFOS的质量浓度为横坐标,峰面积为纵坐标,绘制PFOA和PFOS的工作曲线,得到PFOA的线性回归方程为Y=8.34×102X+4.66×102,r=0.9999;PFOS的线性回归方程为Y=2.82×102X+61.2,r=0.9999。全氟辛酸和全氟辛烷磺酸在1~60ng/mL质量浓度范围内均呈良好的线性关系。
2.5 检测限
按1.3.2节得到1.22ng/mL PFOA样品提取溶液的峰峰信噪比RSN为30.56;1.26ng/mL PFOS样品提取溶液的峰峰RSN为30.50,按RSN=3计,本方法PFOA和PFOS的检测限均为0.2μg/kg。
2.6 回收率和精密度实验
取不含全氟辛酸和全氟辛烷磺酸的猪肉、鸡肉、牡蛎、鱼罐头、猪肉罐头和奶粉6种样品进行标准添加实验,每个添加量做5个平行,结果见表5。该方法对6种动物源食品中全氟辛酸和全氟辛烷磺酸的回收率在93.3%~102.8%之间,精密度在0.8%~6.2%之间。
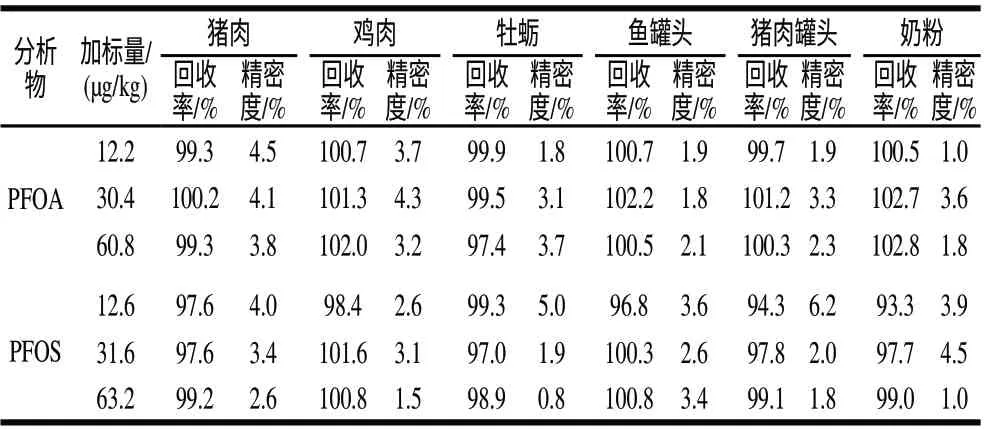
表5 不同食品中全氟辛酸和全氟辛烷磺酸的加标回收率和精密度(n=5)Table 5 Recovery rates and precision for determination of PFOA and PFOS in different food samples (n=5)
2.7 实际样品检测
实验对多种陆生动物和水生动物及其制品进行检测,发现多数样品存在全氟辛酸污染,含量多在0.5μg/kg以下,但有少数罐头食品可能受罐头盒内壁涂层污染,全氟辛酸的含量可达40μg/kg,该阳性样品谱图见图3,空白鱼罐头样品总离子流图见图4。
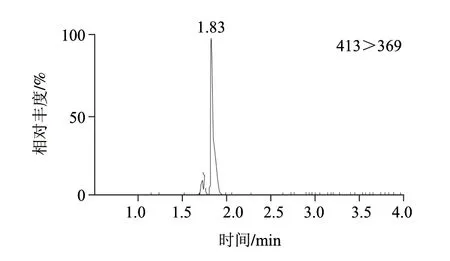
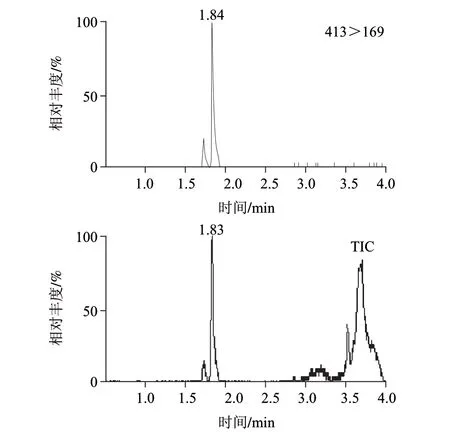
图 3 阳性样品的选择离子监测图和总离子流图Fig.3 TIC and MRM chromatograms of positive samples
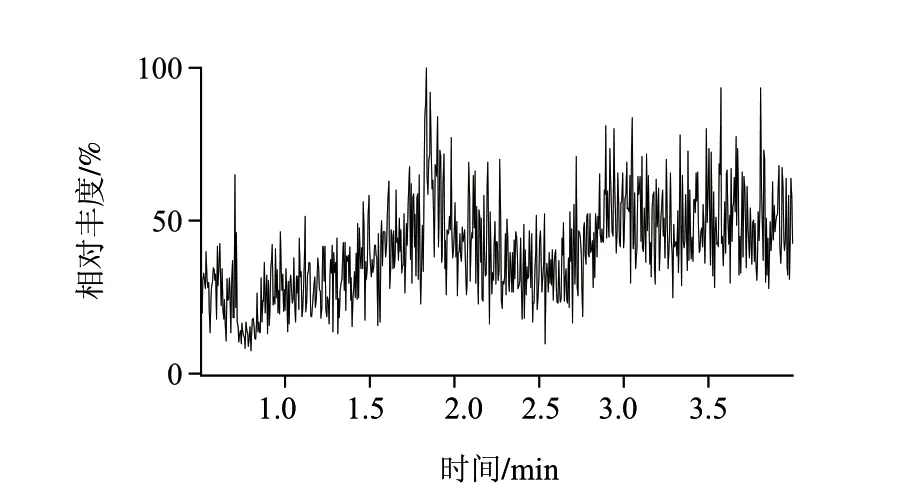
图 4 空白鱼罐头样品的总离子流图Fig.4 TIC chromatograms of blank canned fish
3 结 论
聚酰胺固相萃取富集、净化动物源食品中全氟辛酸和全氟辛烷磺酸并采用超高效液相色谱-串联四极杆质谱仪进行快速检测,该方法前处理成本低、效果好、检测时间短、灵敏度高、抗干扰能力强,在调查动物源食品中全氟辛酸和全氟辛烷磺酸污染状况的检验工作中具有很好的应用价值。
[1] CUI Lin, ZHOU Qunfang, LIAO Chunyang, et al. Studies on the toxicological effects of PFOA and PFOS on rats using histological observation and chemical analysis[J]. Archives of Environmental Contamination and Toxicology, 2009, 56(2): 338-349.
[2] 王媛, 张彭义. 全氟辛酸和全氟辛烷磺酸人体暴露途径解析及其污染控制技术[J]. 化学进展, 2010, 22(1): 210-219.
[3] 郭睿, 蔡亚岐, 江桂斌. 高效液相/四极杆-飞行时间串联质谱法分析活性污泥中的全氟辛烷磺酸及全氟辛酸[J]. 环境化学, 2006, 25(6): 674-677.
[4] 张萍, 史亚利, 蔡亚岐, 等. 高效液相色谱/串联质谱联用技术测定环境水样中的全氟化合物[J]. 分析化学, 2007, 35(7): 969-972.
[5] 潘媛媛, 史亚利, 蔡亚岐. 土壤、底泥和活性污泥中全氟化合物的高效液相色谱-串联质谱分析方法[J]. 环境化学, 2010, 29(3): 519-523.
[6] 陈会明, 郝楠, 陈伟, 等. 液相色谱-质谱法测定不粘锅特富龙涂层中全氟辛酸铵残留[J]. 分析化学, 2006, 34(8): 1106-1108.
[7] 王雨昕, 李敬光, 赵云峰, 等. 生物基质中全氟辛酸与全氟辛烷磺酸及其前体化合物的超高效液相色谱-串联质谱法研究[J]. 分析化学, 2011, 39(8): 1134-1140.
[8] 郭斐斐, 王雨昕, 李敬光, 等. 超高效液相色谱-串联质谱法测定人尿液中全氟有机化合物[J]. 色谱, 2011, 29(2): 126-130.
[9] 王杰明, 潘媛媛, 史亚利, 等. 高效液相色谱-串联质谱法对奶粉、酸奶中全氟化合物的分析[J]. 分析测试学报, 2009, 28(6): 720-724.
[10] 刘嘉颖, 王雨昕, 李敬光, 等. 超高效液相色谱-质谱法测定动物性膳食中全氟辛烷磺酸和全氟辛酸[J]. 中国食品卫生杂志, 2011, 23(6): 539-543.
[11] 温泉, 王靖, 施琦贻. 采用高效液相色谱-电喷雾串联质谱法测定猪肉中的全氟化合物(PFOS、PFOA)[J]. 现代食品科技, 2011, 27(10): 1271-1275.
[12] 王利兵, 吕刚, 刘绍从, 等. 气相色谱-质谱法测定包装材料中全氟辛酸及其盐类[J]. 分析实验室, 2007, 26(2): 94-96.
[13] 白桦, 郝楠, 崔艳妮, 等. 不粘锅涂层中全氟辛酸及其盐的快速溶剂萃取-气相色谱-质谱法测定[J]. 色谱, 2007, 25(2): 276-279.
[14] 于徊萍, 荣会, 卢利军, 等. 气相色谱法测定全氟辛磺酸化合物[J]. 印染, 2007(13): 37-39.
[15] GB/T 23243—2009 食品包装材料中全氟辛烷磺酰基化合物(PFOS)的测定: 高效液相色谱-串联质谱法[S].
[16] GB/T 24169—2009 氟化工产品和消费品中全氟辛烷磺酰基化合物(PFOS)的测定: 高效液相色谱-串联质谱法[S].
[17] SN/T 2257—2009 特氟隆材料及不粘锅涂层中全氟辛酸的测定: 气相色谱-质谱法[S].
