响应面优化三氯乙酸沉淀测定豆酱游离氨基酸中蛋白质
2013-08-07武俊瑞代金月邱小玉岳喜庆
张 苗,武俊瑞,代金月,邱小玉,岳喜庆*
(沈阳农业大学食品学院,辽宁 沈阳 110866)
豆酱(soybean paste)是我国四大传统的发酵豆制品之一,它是以大豆为主要原料制成的酱,经自然发酵而成的半流动状态的发酵食品,也称黄豆酱、黄酱或大豆酱[1]。传统发酵豆酱具有独特的风味,豆酱具有独特的风味,其风味是由酿造过程中微生物引起的生物化学反应形成的。把原料中的不溶性高分子物质,分解成低分子化合物,这些物质的相互结合形成了种类繁多的呈味物质[2]。这些呈味物质主要是氨基酸。因此豆酱中氨基酸的种类和数量决定了豆酱的品质,分析其含量和数量就显得尤为重要。
氨基酸自动分析仪对所进样品要求很严格,需要所进样品除去有机酸、脂肪、蛋白等物质。虽然样品溶解在水中后,游离态氨基酸可溶解在水中,但非水解样品溶液中的部分水溶性蛋白经过高速离心仍无法除去,因此需选用蛋白沉淀剂除去经高速离心后仍无法去除的水溶性蛋白[3]。三氯乙酸(TCA)沉淀法原理是:TCA作为蛋白质变性剂可使蛋白质构象发生改变,暴露出较多的疏水基团,使之聚集沉淀[4]。本研究利用蛋白质遇TCA产生沉淀的特点,结合双缩脲比色法测其含量[5],以此为指标来确定TCA沉淀测定豆酱游离氨基酸中蛋白的最佳实验条件,为氨基酸含量测定提供简便可行的方法。
1 材料与方法
1.1 材料与试剂
豆酱,采自当地农家自制的传统发酵豆酱,样品保存于密封袋中,4℃冷藏备用。
酪蛋白标准品(生化试剂,纯度≥99%) 北京世纪奥科生物技术有限公司;三氯乙酸(TCA)、氢氧化钾溶液、酒石酸钾钠(KNaC4H4O6·4H2O)、硫酸铜(CuSO4·5H2O)、95%乙醇、四氯化碳(均为分析纯) 国药集团化学试剂有限公司;混合氨基酸标准溶液、茚三酮 德国Sykam公司;实验用水为超纯水;磺酸型阳离子树脂分离柱(4.6mm×60mm,3μm) 日本Hitachi公司。
1.2 仪器与设备
CR22GⅡ/CR21GⅡ日立高速冷冻离心机 日立工机株式会社本社工厂;KQ-500DB型超声波清洗机 昆山市超声仪器有限公司;UV-5100B紫外分光光度计 上海元析仪器有限公司;L-8800全自动氨基酸分析仪 日本Hitachi公司。
1.3 方法
1.3.1 样品干燥
样品在恒温干燥箱中55℃烘干至恒质量。
1.3.2 三氯乙酸沉淀蛋白与双缩脲比色法测定蛋白质含量[6-11]
1.3.2.1 标准曲线回归方程的建立
准确称取10、20、30、40、50、60mg酪蛋白标准品分别置于6个50mL离心管内,各加入20.0mL双缩脲试剂,摇匀。静置10min后,以双缩脲试剂调零,540nm波长处测定各标准溶液的吸光度,以吸光度(y)为纵坐标,以酪蛋白质量浓度(mg/mL)为横坐标绘制标准曲线,得回归方程:y=0.1759x+0.0023,r2=0.9994。
1.3.2.2 蛋白质含量的测定
称取1g研磨均匀的豆酱干粉,加入8g/100mL TCA溶液,再充分研磨混匀转移至50mL容量瓶,25℃水浴条件下超声30min,10000r/min离心10min,倾去上清液,沉淀用95%乙醇10mL洗涤。向沉淀中加入四氯化碳2mL和双缩脲试剂20mL,置于超声波清洗器中振荡均匀,静置显色10min,在10000r/min离心20min,取上层清液,540nm波长处测吸光度。试样中蛋白质含量以ρ(g/100g)表示,结果按下式计算,实验平行测定3次。
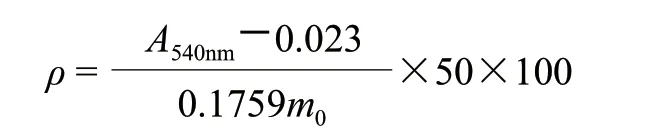
式中:m0为取样量/mg;A540nm为测得的吸光度。
1.3.3 单因素试验
分别考察沉淀剂TCA质量浓度、沉淀温度、离心转数3个因素对前处理中蛋白质沉淀效果的影响,以蛋白质含量为评定指标。

表1 单因素试验设计Table 1 One-factor-at-a-time design
1.3.4 响应面试验设计
根据单因素试验确定各因素的取值水平范围,结合Box-Behnken试验设计原理,分别选取TCA质量浓度(A)、沉淀温度(B)、离心机转数(C)作为自变量,以蛋白质含量作为响应值设计响应面试验。利用Design-Expert 7.0软件进行回归分析,预测沉淀蛋白质的最佳条件。
1.3.5 游离氨基酸测定
称取研磨均匀的豆酱干粉1g,加入8.3g/100mL的TCA溶液,再充分研磨混匀转移至50mL容量瓶,47℃温度条件下超声波超声提取1h,1726r/min离心30min,取上清液2mL于蒸发皿中蒸干。加入2.5mL 0.02mol/L的盐酸溶液溶解,经0.22μm的滤膜过滤,作为待测液。
色谱条件[12]:色谱柱:磺酸型阳离子树脂分离柱(4.6mm×60mm,3μm);梯度洗脱:循环时间53min,分离柱柱温57℃,反应柱柱温135℃,缓冲液流速0.4mL/min,茚三酮流速0.35mL/min;通道1:检测波长570nm,采集时间32min;通道2:检测波长440nm,采集时间10min;进样量20μL。
2 结果与分析
2.1 单因素试验结果
蛋白质沉淀效果受T C A 质量浓度、沉淀温度和离心转数影响,由图1 可知,T C A 质量浓度在2~10g/100mL时,测定样品中蛋白质含量呈上升的趋势,8g/100mL以后趋于平稳,考虑到过高的TCA会对氨基酸检测带来影响,故选择8g/100mL TCA质量浓度。TCA质量浓度从2~10g/100mL时,酸度逐渐增强,TCA在酸性条件下与蛋白质形成不溶性盐,并作为蛋白质变性剂使蛋白质构象发生改变,暴露出较多的疏水性基团,使蛋白质聚集沉淀[13]。此外,沉淀温度对蛋白质沉淀效果也存在影响,当反应温度从25℃升至65℃时,蛋白质含量增加不明显,可见温度对TCA沉淀蛋白质作用影响不大,这与任国谱等[14]的报道是一致的。但随温度的提高,分子运动速率提高,蛋白质沉淀速率加快,有助于缩短反应时间,综合考虑选择温度45℃。随离心转数的增加,蛋白质含量呈上升的趋势,16000r/min后趋于平稳,当离心转数16000r/min,测定样品中蛋白质含量达到最高值。
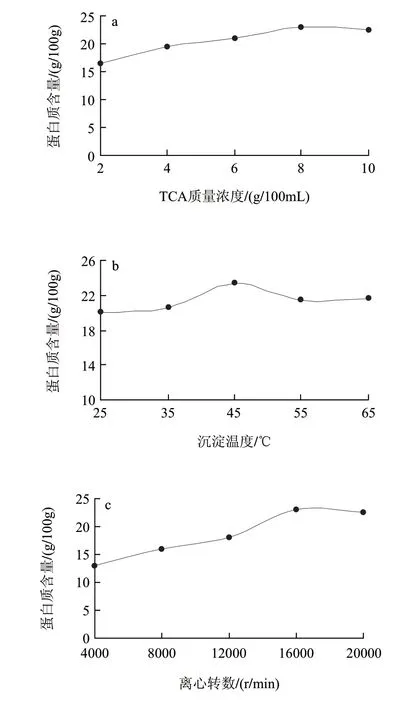
图 1 TCA质量浓度(a)、沉淀温度(b)、离心转数(c)对蛋白质沉淀的影响Fig.1 Effect of three factors on protein precipitation
2.2 响应面法优化蛋白沉淀条件
2.2.1 Box-Behnken试验设计及结果
在单因素试验基础上,根据Box-Behnken试验设计原理[15-17],选择TCA质量浓度(A)、沉淀温度(B)、离心转数(C),作为响应面优化的考察因素,每个因素取三水平,以(-1,0,1)编码,以测定的蛋白质含量为响应值,设计三因素三水平试验。试验因素及水平见表2。

表2 Box-Behnken试验因素及水平Table 2 Variables and coded values for Box-Behnken design
应用Design-Expert 7.0软件进行Box-Behnken试验设计,依次进行试剂的配制,蛋白质含量测定(每组3个平行)[18-19],以样品中蛋白质含量为响应值(Y),进行响应面试验,结果如表3所示。

表3 Box-Behnken试验设计及结果Table 3 Experimental design and results of Box-Behnken design
2.2.2 回归模型的建立及统计分析
根据表3的试验结果,通过Design Expert 7.0软件处理确定回归方程,该试验的回归方程为:Y=23.16+0.33A+0.32B+0.43C+0.23AB+0.23AC+0.25BC-1.43A2-0.95B2-0.83C2(1)
回归模型进行方差分析及可信度分析结果见表4。

表4 回归方程的统计分析Table 4 Statistical analysis of the fitted regression equation
由表4可知,TCA质量浓度和沉淀温度的二次项对蛋白质沉淀效果影响均具显著性(P<0.01),离心转数和它的二次项对蛋白质沉淀效果影响也具显著性(P<0.05),其他变量影响均不显著(P>0.05),无统计学差异。根据α=0.05显著水平剔除不显著项,简化后的回归方程为:
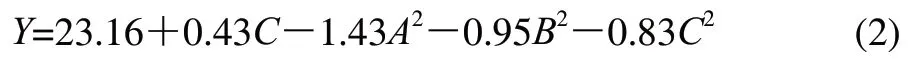
根据表4可知,模型极显著(P<0.01),因变量与自变量之间的线性关系显著(R2=0.9445),模型调整复相关系数R2Adj=0.8447,说明该模型能解释84.47%响应值的变化,拟合程度较好。失拟项不显著(P>0.05),说明试验所得二次回归方程能很好地对响应值进行预测[20-21]。
2.2.3 蛋白沉淀条件的响应面分析及优化

图 2 Y=f(A,B)响应面立体图及等高线图Fig.2 Response surface and contour plots showing the effects of precipitant concentration and temperature on protein precipitation
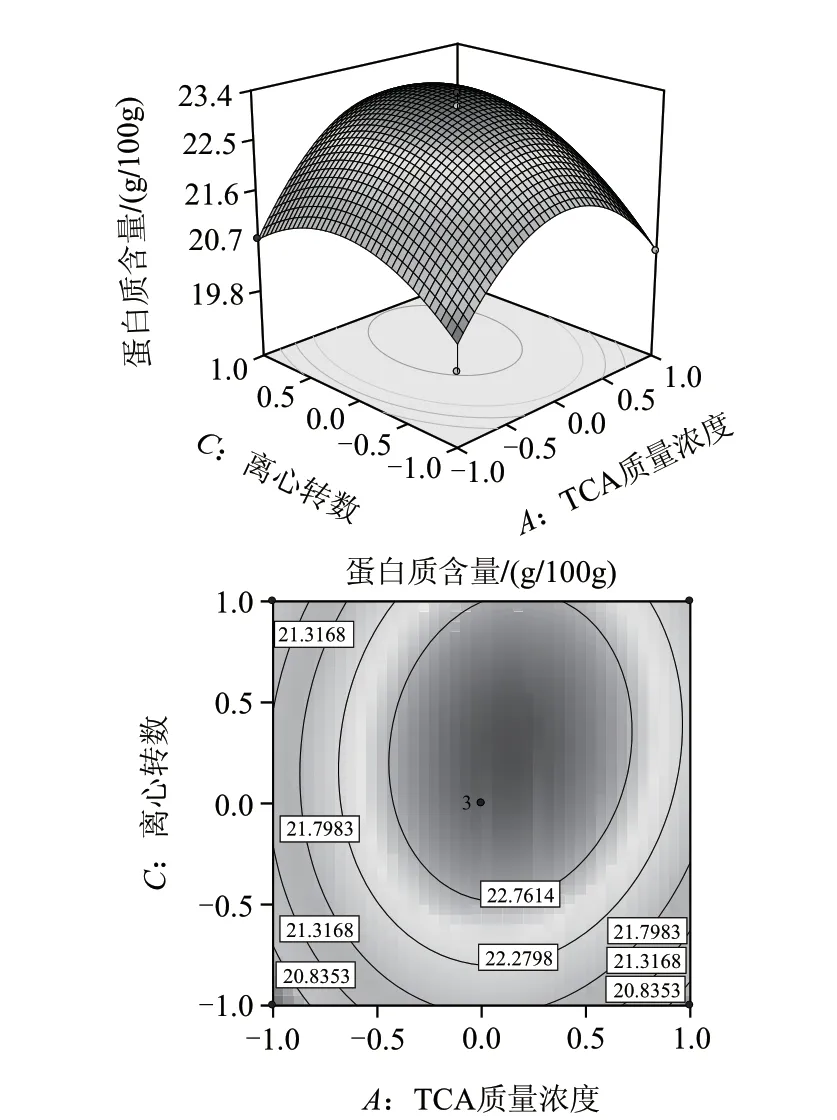
图 3 Y=f(A,C)响应面立体图及等高线图Fig.3 Response surface and contour plots showing the effects of precipitant concentration and centrifuge speed on protein precipitation

图 4 Y=f(B,C)响应面立体图及等高线图Fig.4 Response surface and contour plots showing the effects of temperature and centrifuge speed on protein precipitation
根据回归方程绘制响应面分析图,运用Design Expert 7.0软件对模型进行分析,寻求蛋白质含量的稳定点及对应的因素水平,由图2~4可知,回归模型存在稳定点,稳定点即极大值点,通过对回归模型求一阶偏导,得到各因素A、B、C的编码值为0.1588、0.2283、0.3160,利用编码公式Xi=(Xj-X0)/Δj将上述编码值转变为实际参数为TCA质量浓度8.320g/100mL、沉淀温度47.280℃、离心转数1726.060r/min,考虑实际操作性,将各沉淀工艺参数修正为TCA质量浓度8.3g/100mL、沉淀温度47℃、离心转数1726r/min。此时蛋白质沉淀效果最佳,为23.29g/100g。为了检验回归模型预测的准确性,在所得最佳沉淀条件下进行3组平行实验进行验证,沉淀中蛋白质实际含量分别为23.12、23.09、23.18g/100g,与预测值十分接近,可见该模型能较好地预测实际蛋白质沉淀情况。
2.3 豆酱中游离氨基酸含量测定

图 5 处理后豆酱中游离氨基酸测定色谱图Fig.5 Chromatogram of free amino acids in fermented soybean paste after protein removal
采用最佳蛋白质沉淀操作条件处理后,按照1.3.5节方法测定样品中游离氨基酸含量,结果见图5。
由图5可以看出,豆酱中的氨基酸分离效果很好,并且在检测过程中柱压稳定。
3 结 论
通过单因素试验和Box-Behnken试验,采用响应面分析法优化豆酱中蛋白质沉淀条件,得出沉淀工艺条件参数为TCA质量浓度8.3g/100mL、沉淀温度47℃、离心转数1726r/min,此条件下蛋白质沉淀量可达到23.29g/100g。并采用此法沉淀蛋白质后进行豆酱中游离氨基酸含量测定,各氨基酸分离效果很好,并且柱压稳定,由此可知样品中的蛋白充分的得到清除。
[1] 包启安. 酱及酱油的起源及其生产技术(一)[J]. 中国调味品, 1992(9): 1-4.
[2] 廖杰. 论酱油风味、香气的产生及形成[J]. 中国调味品, 2004(10): 5-7.
[3] 钟秋瓒. 乳饮料及乳制品中游离甘氨酸的测定[J]. 食品与发酵工业, 2009, 35(2): 159-161.
[4] 牛巍, 侯彩云, 祝晓芳. 三氯乙酸沉淀法与硫酸铜沉淀法在液态奶蛋白质检测中适用性研究[J]. 中国乳品工业, 2008, 36(9): 59-61.
[5] 余兰, 于香安. 三氯乙酸沉淀法结合双缩脲比色法测定水蛭提取液中总蛋白含量[J]. 中国药物与临床, 2004, 4(9): 685-686.
[6] 陈少迁, 吴少雄, 柳陈坚, 等. 三氯乙酸沉淀液态奶蛋白的最佳实验条件研究[J]. 乳业科学与技术, 2009(6): 278-281.
[7] 中华人民共和国卫生部, 中国国家标准化管理委员会. GB/T 5009.124—2003中国标准书号[S] . 北京: 中国标准出版社, 2003.
[8] 中华人民共和国农业部. NY/T 1678—2008 乳与乳制品中蛋白质的测定 双缩脲比色法[S]. 北京: 中国农业出版社, 2008.
[9] 刘莹, 傅泽田, 侯彩云. 人为添加三聚氰胺液态乳中蛋白质含量测定方法的研究[J]. 中国农业大学学报, 2009(2): 16-21.
[10] 刘媛, 谢孟峡, 龙梅, 等. FMOC-CL为柱前衍生化试剂对氨基酸PRHPLC定量分析方法的研究[J]. 现代仪器, 1999(6): 14-17.
[11] 刘惠文. 柱前和柱后衍生高效液相色谱分析氨基酸方法进展与评述[J]. 氨基酸和生物资源, 1995, 17(2): 50-55.
[12] 王翔, 杨晓燕, 张钰萍. 侗家奇液酒中游离氨基酸含量测定分析[J]. 中国酿造, 2012, 31(2): 182-186.
[13] 郭立安, 阎哲, 张晓楠, 等. 三氯乙酸对蛋白质结构稳定性的影响[J]. 第四军医大学学报, 2001(22): 40.
[14] 任国谱, 李忠海, 彭美纯, 等. 奶粉中低聚肽质量浓度测定方法[J]. 中国乳品工业, 2007, 35(10): 47-49.
[15] JOSHI S, YADAV S, DESAI A J. Application of response-surface methodology to evaluate the optimum medium components for the enhanced production of lichenysin by Bacillus licheniformis R2[J]. Biochemical Engineering Journal, 2008, 41(2): 122-127.
[16] 袁辉, 白云凤. 中心组合和响应面分析优化枇杷果酒发酵工艺[J]. 中国酿造, 2010(2): 103-106.
[17] 郑君晓, 麻成金, 肖旺, 等. 响应面法优化椪柑果酒发酵工艺研究[J]. 饮料工业, 2011(5): 12-17.冯培勇, 钟旭生, 杨立红, 等. 利用响应面法优化茶薪菇产纤维素酶的发酵条件[J]. 食品科学, 2009, 30(7): 162-165.
[18] 秦嘉炎, 于娜, 岳喜庆, 等. 酶法水解卵黄蛋白制备多肽的工艺优化[J]. 食品科学, 2012, 33(1): 147-151.吴竹青, 陈景, 黄群, 等. 响应面法优化雪莲果酒发酵工艺[J]. 食品科学, 2010, 31(23): 182-187.
[19] 吴有炜. 试验设计与数据处理[M]. 苏州: 苏州大学出版社, 2002: 110-115.
