利用电子舌对富含ACE抑制肽的酪蛋白水解物的脱苦评价
2013-08-07王佳佳胡志和
王佳佳,胡志和,*,赵 悦
(1.天津市食品生物技术重点实验室,天津商业大学生物技术与食品科学学院,天津 300134;2.北京盈盛恒泰科技有限责任公司,北京 100055)
牛乳不仅含有丰富的营养成分,提供人类丰富的必需氨基酸,而且还是生物活性肽的重要来源[1]。自Maruyama等[2]于1982年在酪蛋白水解物分离出具有ACE抑制活性的12肽(CEJ12),各国科研人员采用不同的方法从酪蛋白中分离提取了更多具有不同降压效果的ACE抑制肽,它与普通降压药物相比具有无毒副作用,且对正常的血压没有影响。因此,食源性降血压肽成为抗高血压功能食品或药物研究的重点[3]。酶法水解蛋白质可得到多种具有高ACE抑制活性的降压肽,但在水解的同时也会相应的有苦味肽的形成,这使得产品无法满足口感和嗜好的要求从而限制了短肽在食品工业领域的应用[4-5]。在酶解过程中,往往由于条件限制,尽管底物、酶和水解度可以选择并加以控制降低苦味,但有时也无法满足脱苦的最低条件,还需要外加措施进行脱苦,其方法主要包括选择性分离法、掩盖法、酶法等[6-7]。风味蛋白酶不仅可以通过使风味前体物水解释放出风味物质来增强和改善食品的风味,还可以通过内切蛋白酶将苦味肽彻底降解为氨基酸。
对苦味的评价长期以来主要采用感官评定法,但其结果不够客观,易受环境、评价者情绪、健康状况等的影响。作为一种能快速检测味觉品质的新技术,电子舌能够以类似人的味觉感受方式(人的舌头)检测出味觉物质,可以对样品进行味觉的量化,因而具有重复性、高灵敏性、可靠性等优势。由于电子舌的这些特点,目前该技术在饮料鉴别与区分、酒类产品(啤酒、清酒、白酒和红酒)区分与品质检测、初级农产品识别与分级、在茶叶评审中的鉴别应用、航天医学检测、制药工艺研究、环境监测等中有较多应用[8]。电子舌的兴起就是从对食品的鉴别中发展而来的,现在,电子舌在食品感官品质鉴别上的应用研究日益增多。本实验采用复合风味蛋白酶对富含ACE抑制肽的酪蛋白水解物进行脱苦处理,并采用味觉分析系统(电子舌),采用多通道型仿生脂质膜传感器技术对味觉进行量化而得到更加准确的结果。
1 材料与方法
1.1 试剂
酪蛋白(酪蛋白含量≥80%) 天津海河乳业有限公司;胰蛋白酶(10000U/g)、胃蛋白酶(10000U/g) 美国Sigma公司;风味蛋白酶(33000U/g) 丹麦Novo公司。
1.2 仪器与设备
UV-2100紫外-可见分光光度计 日本Unico公司;FA1104N电子天平 上海精密科学仪器有限公司;EMS-8A加热磁力搅拌器 天津市欧诺仪器仪表有限公司;PB-10普及型pH计 德国Sartorius公司;Scientz-50N冷冻干燥机 宁波新芝生物科技股份有限公司;TS-5000Z型电子舌(味觉分析系统) 日本Insent公司。
1.3 方法
1.3.1 酪蛋白的双酶水解
参照张艳等[9]确定的胃蛋白酶和胰蛋白酶水解酪蛋白的条件,对酪蛋白进行水解。
1.3.2 风味酶法脱苦的单因素试验
风味蛋白酶是一种由筛选的未经基因改造的米曲霉菌株经深层发酵生产的蛋白酶/肽酶复合物,含有两种活力的内切蛋白酶和外切蛋白酶,反应最佳温度为50℃,最佳pH值范围5.0~7.0,故从[E]/[S]、pH值和反应时间3个方面进行,固定[E]/[S]为3000U/g、pH6、酶解时间2h,改变其中一个条件,通过感官评分分别考察3个因素对水解液苦味脱除的影响。

表 1 风味酶法脱苦单因素因素水平表Table 1 Hydrolysis parameters and levels for one-factor-at-a-time design
1.3.3 风味酶法脱苦的正交试验
通过感官评分所确定的单因素试验结果,确定三因素的取值水平范围,进行正交试验确定最佳水解条件组合。
1.3.4 苦味的评价方法
1.3.4.1 感官评定
采用感官评定的方法,将通过风味酶水解的水解液提供给5名品尝者,将1.3.1节方法得到酪蛋白双酶水解液为基准液,将其分别稀释0、1、2、3、4、5、6、7、8倍,其对应的苦味评分分别是0、1、2、3、4、5、6、7、8。根据此评分标准,品尝复合肽溶液的苦味并与标准比较进行评分,最后取平均值表示苦味程度。
1.3.4.2 电子舌分析
取2.5g经冷冻干燥的风味酶水解过的酪蛋白水解物,加入70mL的蒸馏水使其充分溶解后,倒入电子舌配备的小塑料杯中,每个约35mL作为平行,放入仪器中进行测试。利用苦味和苦味的回味两种传感器获得味觉数据结果,并通过多元回归分析和主成分分析用图形化方式表达出结果。
1.3.5 ACE体外检测及IC50的确定
因为风味蛋白酶对酪蛋白双酶水解液的水解,可能会使水解液中原本的ACE抑制肽活性降低甚至丧失,所以需要对正交试验中选取的最好的几个结果中,挑选出对其活性影响最小的。
1.3.5.1 ACE抑制活性的体外检测
采用最常用的HHL方法[10-11]体外检测ACE抑制率。具体方法如表2所示。

表 2 ACE抑制率体外检测方法 Table 2 Procedure for detection of in vitro ACE inhibitory activity %
根据表2可知,将各试剂加入到5mL离心管中混匀(每管做3组平行),反应结束后加入1.7mL乙酸乙酯,经15s振荡、混匀后离心(4000r/min,15min,4℃),吸取1.0mL乙酸乙酯层于试管中,在120℃的烘箱中烘干30min后,向试管中加入3mL去离子水,检测在228nm处的吸光度,其计算公式为:

式中:A为反应中ACE抑制剂和ACE同时存在的吸光度;B为反应中不加抑制剂的吸光度,即对照;C为ACE和HHL空白反应的吸光度,即空白。1.3.5.2 半数抑制浓度(IC50)的测定
称取双酶水解产物以及通过电子舌评定结果脱苦效果最好的正交试验试样3、6、8、9,分别配制成质量浓度为0.1、0.2、0.3、0.6、1.0mg/mL的溶液,测定各溶液的ACE抑制率,并绘制ACE抑制率曲线,计算出IC50值。
2 结果与分析
2.1 风味酶脱苦试验苦味评分
2.1.1 单因素试验的苦味评分

表 3 感官评分结果Table 3 Results of one-factor-at-a-time design for sensory evaluation of debittered casein hydrolysate
由表3可以看出,当随着加酶量的增加苦味评分随之增加,当[E]/[S]为3000U/g时水解液的苦味基本脱除,再增加加酶量苦味评分增加的不大,且随着加入量的增加,对水解液的颜色有加深现象,不利于它的进一步应用,故这里选择加酶量为3000U/g;在水解pH值为6.5和水解时间2.0h时,苦味评分比较好,故选择水解pH值为6.5,水解时间2.0h,正交试验在此基础上确定因素水平范围。
2.1.2 正交试验的苦味评分

表 4 感官评价法正交试验结果Table 4 Orthogonal array design and results for sensory evaluation of debittered casein hydrolysate
由于人的感觉器官在分辨力、敏感度、稳定性等方面的个体差异,以及极易受外界因素的干扰,故将在各条件下的水解液进行冷冻干燥成粉末,进行电子舌的苦味和苦味回味的检测。
由表4极差分析可知酶解条件对风味酶法脱苦的影响依次为酶底比>水解时间>水解pH值,酶底比和水解时间是影响脱苦效果的主要因素,风味酶法脱苦的最佳处理条件为[E]/[S]= 3200U/g、时间1.5h、pH 6.8,在该条件下复合肽的苦味值评分为7.8,苦味基本脱除。
2.2 电子舌对风味酶脱苦的评定
2.2.1 酶用量对脱苦效果的影响
对照组为6天1轮输精周期,即公鸡连用5天输完3200只母鸡,休1天。试验1组是7天1轮输精周期,即公鸡连用5天,输完3200只母鸡,休2天;实验2组是8天1轮输精周期,即公鸡连用5天,输完3200只母鸡,休3天。输两个周期后,开始收集种蛋、及时入孵、统计受精率,具体输精方案见表1。

图 1 加酶量对脱苦的影响Fig.1 Effect of enzyme dosage on debittering
由图1可以看出,将电子舌的结果用二维坐标图表示出来,图中横坐标为苦味,纵坐标为苦味的回味,数值越大代表苦味和苦味的回味越显著,这里将加酶量2000U/g作为零点,可以看出随着加酶量的增加,水解物的苦味和苦味的回味都逐渐降低,在3500U/g时苦味和苦味的回味都最低,故加酶量为3500U/g时最好。
2.2.2 pH值对脱苦效果的影响

图 2 pH值对脱苦的影响Fig.2 Effect of pH on debittering
由图2可以看出,电子舌的结果通过二维坐标图表示出来,图中横坐标为苦味,纵坐标为苦味的回味,数值越大代表苦味和苦味的回味越显著,其中将加酶量2000U/g为零点,其他的与其进行对比,可以看出随着pH值的增加,水解物的苦味和苦味的回味都逐渐降低,在pH值为7时苦味和苦味的回味都最低,故pH值为7时最好。
2.2.3 水解时间对脱苦效果的影响
由图3可以看出,随着水解时间的延长苦味消除的反而不理想,这里0.5h和1.0h无论从苦味还是苦味的回味都很好,故水解时间为0.5h最好。
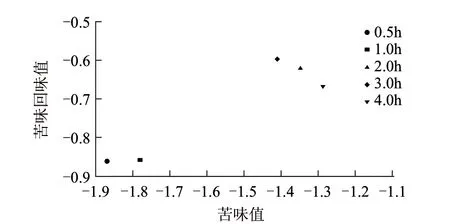
图 3 水解时间对脱苦的影响Fig.3 Effect of hydrolysis time on debittering
2.3 电子舌对正交试验的评定
电子舌法正交试验结果见表5。
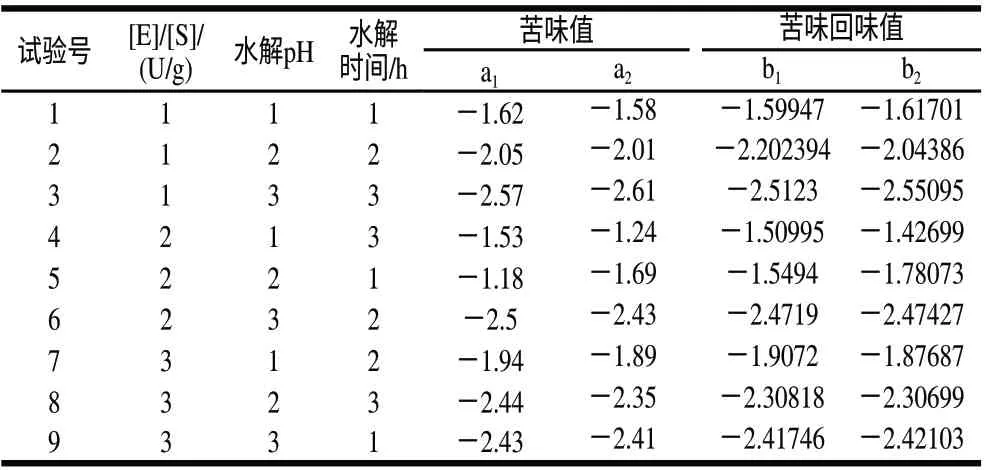
表 5 电子舌法正交试验结果Table 5 Orthogonal array design and results for electronic tongue measurement of debittered casein hydrolysate
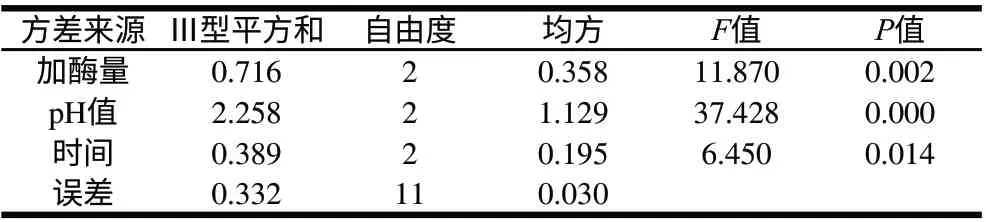
表 6 苦味值正交试验结果方差分析表Table 6 Analysis of variance for debitterness value
由表6方差分析可以看出,加酶量和pH值对苦味影响都为极显著,时间对苦味的影响为显著,其中影响的主次因素为pH值>加酶量>水解时间。
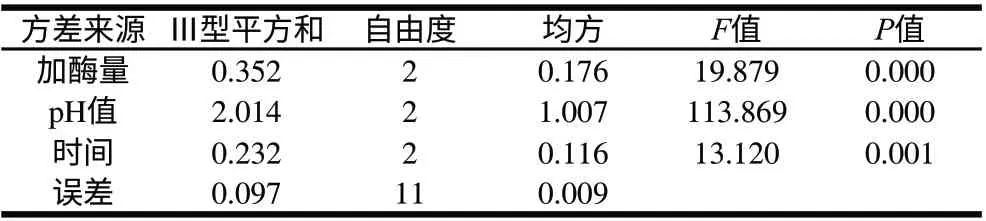
表 7 苦味回味值正交试验结果方差分析表Table 7 Analysis of variance for bitter aftertaste
由表7的方差分析可以看出加酶量、pH值、水解时间对苦味的回味都为极显著,其中影响的主次因素为pH值>加酶量>水解时间。
2.4 风味酶法脱苦对ACE抑制活性的影响
通过测定酪蛋白双酶水解液及经风味酶法脱苦处理的几个典型试样:3、6、8、9号试样(表4)的ACE抑制率,考察该脱苦工艺对复合肽ACE抑制活性的影响。
2.4.1 酪蛋白双酶水解产物的IC50值
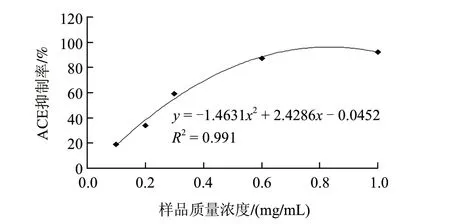
图 4 酪蛋白双酶水解产物质量浓度与ACE抑制活性关系曲线Fig.4 Relationship between casein hydrolysate concentration and ACE inhibitory activity
由图4可知,随着样品质量浓度的增大,其ACE抑制率也在增大,说明ACE抑制率与样品质量浓度存在质量浓度-效应关系。通过一元二次回归分析,得到一元二次回归方程为y =-1.4631x2+ 2.4286x-0.0452(R2=0.991),计算可得出酪蛋白双酶水解产物的IC50值为0.27mg/mL。
2.4.2 经风味酶脱苦后4个典型样的IC50值

图 5 四个典型样的IC50值Fig.5 IC50 of four typical samples
由图5可知,试样3、6、8、9的IC50值分别是0.31、0.8、0.56mg/mL和0.28mg/mL,与未经脱苦的酪蛋白双酶水解物的0.27mg/mL相比,试样9不仅脱苦效果好,而且IC50值也是相对最低的,虽然风味酶法的脱苦仍略带苦味,但配合加糖等办法仍具有应用价值。
3 讨 论
向含苦味的蛋白质水解液中加入一些能掩盖蛋白质水解液苦味的物质,也可使苦味减轻,如常用的食品添加剂有机酸、甜味剂等[12],其酸味、甜味对苦味均有较好的掩盖作用。微胶囊化包埋掩盖法是近年来新发展的脱苦方法,它是把分散的固体物质、液滴或气体完全包封在一层连续薄膜中形成微小包囊的方法,使产品在保留营养的同时保持良好的感官品质常用的是环糊精类。本实验曾尝试使用环糊精脱苦如α-环糊精、β-环糊精和羟丙基-环糊精,比较得到β-环糊精的脱苦效果较好,底物质量浓度为1g/100mL的水解物加入质量浓度为2g/100mL的β-环糊精即可脱苦,但随着底物浓度的增加环糊精的添加量也随之增加,当环糊精的质量浓度为3g/100mL时,放置一段时间后就会有晶体的析出和一些异味反而给产品带来不好的口感,故选择风味酶法脱苦,而风味酶法脱苦与普通物理方法相比,通过改变苦味短肽结构而脱苦,这势必影响到其功能活性,为此本实验对经风味酶脱苦后的水解物,进行了体外检测,挑选出对活性影响最小的水解物应用于食品中。
对蛋白短肽的苦味评价,有感官评价和仪器评价两种方法。目前感官评定的方法仍然是最为常用、直观和有效的方法[13]。由于感官评定法依赖经过长期训练、拥有特殊味觉判别能力的品评专家来判断,很多时候难以找到适合的人选,此外由于人的感觉器官在分辨力、敏感度、稳定性等方面的个体差异,以及极易受外界因素的干扰[14],仪器评价方法则避免了感官评价的不足,人类等生物活体的舌头表面是由具有特定电势的脂质双分子层膜构成。这种电势的变化是由于呈味物质和脂质之间的静电作用或疏水作用产生的,变化量作为味觉信息被人的大脑所感知,是味觉评价的有效依据。而本实验所使用的电子舌的味觉传感器模拟了这种生物活体的味觉感受机制,这种味觉传感器是由人工质膜(类似人的舌头)构成,它可以与各种呈味物质之间产生静电作用或疏水作用,以便于感受“味觉”。
4 结 论
利用风味蛋白酶对富含ACE抑制肽的酪蛋白双酶水解物进行脱苦处理,单因素结果通过感官评定选出[E]/[S]为3000U/g、水解pH值为6.5,苦味评分比较好,与电子舌评定结果[E]/[S]为3500U/g,水解pH值为7.0脱苦效果比较来说还是比较接近的,但电子舌对时间的评定为0.5h最好与感官结果水解时间2h最好有一定的差异。通过电子舌评价结果选出脱苦效果好的正交试验3、6、8、9号与未经脱苦的酪蛋白双酶水解物进行体外检测比较其IC50值可得到正交试验中9号试样的IC50值为0.28mg/mL与未经脱苦的水解物IC50值为0.27mg/mL相比基本接近,故选择正交试验9条件进行处理。
[1] MATSUMOTO H, SHIMOKAWA Y, USHIDA Y, et al. New biological function of bovine α-lactalbumin: protective effect against ethanol-and stress-induced gastric mucosal injury in rats[J]. Bioscience, Biotechnology, and Biochemistry, 2001, 65(5): 1104-1111.
[2] MARUYAMA S, SUZUKI H. A peptide inhibitor of angiotensinⅠ-converting enzyme in the tryptic hydrolysate of casein[J]. Agricultural Biology and Chemisty, 1982, 46(5): 1393-1394.
[3] 张源淑, 邹思湘. 酪蛋白源生物活性肽[J]. 国外畜牧科技, 1998, 25(4): 33-36.
[4] 何慧, 王进, 裴凡, 等. 蛋白质水解物与苦味的构效关系及脱苦研究[J]. 食品科学, 2006, 27(10): 571-574.
[5] 唐传核, 彭志英. 大豆蛋白水解物的苦肽以及脱除方法进展[J]. 中国油脂, 2000, 25(6): 167-172.
[6] PEDERSEN B. Removing bitterness from protein hydrolysates[J]. Food Technology, 1994, 48(10): 96-99.
[7] 杜林, 李亚娜. 生物活性肽的功能与制备研究进展[J]. 中国食物与营养, 2005(8): 18-21.
[8] 王平. 人工嗅觉与人工味觉[M]. 北京: 科学出版社, 2000: 1-20.
[9] 张艳, 胡志和, 闫星, 等. 胃蛋白酶水解酪蛋白制备ACE抑制肽的条件[J]. 食品科学, 2010, 31(14): 42-46.
[10] 申晓文, 牟光庆. 酪蛋白源ACE抑制肽的评价方法和研究进展[J]. 食品工业科技, 2010, 31(9): 375-381.
[11] CUSHMAN D W, CHEUNG H S. Spectrophotometric assay and properties of the angiotensin-converting enzyme of rabbit lung[J]. Biochemical Pharmacology, 1971, 20(7): 1637-1648.
[12] SHINODA I, OKAI H. Sweetness and bitterness contributions of structural units of aspartame and some analogs[J]. Agricultural and Food Chemistry, 1985, 33(5): 792-795.
[13] CHO M J. Characterization of bitter peptides from soy protein hydrolysates[D]. Columbia: University of Missouri-Columbia, 2000.
[14] 蒋丽施. 电子舌在食品感官品评中的应用[J]. 肉类研究, 2011, 25(2): 49-52.
