食品蛋白质的糖基化反应:美拉德反应或转谷氨酰胺酶途径
2013-08-07宋春丽赵新淮
宋春丽,赵新淮*
(1.齐齐哈尔大学食品与生物工程学院,黑龙江 齐齐哈尔 161006;2.东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150030)
食品蛋白质是人类和动物必需的营养素,它的一些功能特性如溶解性、乳化性、起泡性、胶凝性等,是赋予食品良好的质构、稳定性和加工特性的重要内在因素。但是,任何一种单一来源的天然蛋白质,不可能具有上述的所有这些优良功能性质。因而,蛋白质改性技术成为赋予食品蛋白质某些优良特性的必要手段。
食品蛋白质的糖基化修饰,是将亲水性的糖类物质以共价键连接的方式导入食品蛋白质分子之中,使修饰产物即糖蛋白既具有蛋白质的大分子特性,又具有糖类物质的亲水特性。研究发现,糖蛋白表现出优越的乳化能力,并且在溶解性、胶凝性、流变学特性、抗氧化性、热稳定性、抗菌性等功能特性方面,也有不同程度的提高。可以说,食品蛋白质的糖基化修饰是对其功能性质的一种有效改善。
蛋白质的糖基化,作为开发功能性配料的一个有效手段,是食品蛋白质研究的热点问题之一。美拉德反应(Maillard reaction)是食品蛋白质糖基化修饰的途径之一,近十几年中被众多的科学家采用,已有效的改善蛋白质的功能性质。同时,另一种蛋白质糖基化途径——转谷氨酰胺酶催化(transglutaminase)的蛋白质糖基化,最近已经被成功的应用于酪蛋白和大豆蛋白的糖基化,显示出其应用前景。基于蛋白质功能性质与食品品质的关系,以及糖蛋白优异功能特性的应用潜力,本文综述了蛋白质美拉德反应糖基化和转谷氨酰胺酶催化途径,并对反应机制、产物结构和功能性质变化等进行简单讨论和介绍。
1 美拉德反应途径
1.1 美拉德反应的化学机制
美拉德反应是普遍存在于食品体系、涉及到蛋白质和碳水化合物的一个反应,是醛、酮、还原糖以及脂肪氧化生成的羰基化合物与胺类、氨基酸、肽、蛋白质甚至氨水中的氨基之间的反应。该反应是法国生物化学家Louis Camille Maillard于1912年发现。该反应比较复杂,包括缩合、降解、裂解、聚合等一系列反应[1]。美拉德反应的第一步,是还原糖的羰基和氨基酸的氨基发生的缩合反应,生成糖基化产物(即糖蛋白)。然后,形成的氨基糖经Amadori和Heyns重排,得到糖醛类、还原酮类或脱氢还原酮类等中间产物。最后,经过一系列反应形成各种化合物,包括类黑精物质。
1.2 食品蛋白质的糖基化与功能性质变化
从20世纪90年代开始,食品科学家开始致力于利用美拉德反应对食品蛋白质进行糖基化。所研究的蛋白质包括酪蛋白、卵白蛋白、乳蛋白、β-乳球蛋白、牛血清白蛋白、肌原纤维蛋白、血浆蛋白、面筋蛋白、大豆蛋白和溶菌酶等。研究发现,糖基化修饰产物的功能性质都有不同程度的改善。
1.2.1 溶解性质
美拉德反应将糖基通过共价键连接而导入食品蛋白质分子之中。所连接的糖基分子中,其羟基的亲水特性能够显著的提高蛋白质的溶解性[2]。研究结果表明,在60℃、相对湿度79%的条件下,随着反应时间的延长,部分水解的面筋蛋白与糊精的美拉德反应产物,其溶解性逐渐增加,而且反应3周后的产物在pH2~12的范围内保持良好的溶解性,如果只将反应物进行简单混合则不会出现这些结果[3]。大豆蛋白与阿拉伯胶进行美拉德反应,同样可以提高蛋白质的溶解性。Mu等[4]研究发现,湿热法制备的大豆蛋白-阿拉伯胶共聚物,在等电点条件下的溶解性增加了近40%。卵白蛋白与葡萄糖、甘露糖在干热条件下(50℃、相对湿度65%)反应10d,所得的产物能够完全溶于pH7.0的磷酸盐缓冲液[5]。
利用美拉德反应糖基化改善蛋白质的溶解性时,糖的种类影响较大。鱼肌原纤维蛋白与葡萄糖或者海藻低聚糖在40℃、相对湿度65%条件下反应24h,所得糖蛋白若要达到相似的溶解度(如在0.16mol/L的NaCl中溶解度达到50%左右),前者参与反应的赖氨酸为6.8%,后者则为28.2%[6]。此外,Saeki等[7]研究鲤鱼肌原纤维蛋白质的葡萄糖糖基化时,发现当蛋白质中17%的赖氨酸参与美拉德反应时,61%的肌球蛋白或82%的肌动蛋白能够溶解在0.1mol/L的NaCl溶液中。
1.2.2 乳化性质
对于糖蛋白,它的蛋白质部分可以有效的吸附在油-水界面上,降低界面张力,所导入的糖基部分(特别是多糖分子)能够在膜的周围形成立体网络状结构,增加膜的厚度和机械强度,所以,有利于乳化性质的提高。有研究结果证实,美拉德反应产物的乳化性优于某些商业的乳化剂。在60℃、79%的相对湿度条件下,得到的血浆蛋白和半乳甘露聚糖共聚物,其乳化能力是血浆蛋白的1.4倍,并且乳化稳定性增加了10倍[8]。溶菌酶与半乳甘露聚糖干热反应2周后,产物的乳化能力随着半乳甘露聚糖分子质量(3.5~6.0、6.0~12、24kD)的增加而增加;同时,相应的3种美拉德产物的乳浊液稳定时间分别为:小于1min(与溶菌酶的乳化稳定时间相近)、1.7min、大于25min[9]。这个结果表明,糖基分子的大小对乳化性质产生了重要的影响。Babiker等[10]的研究也表明,增加糖链长度能够改善糖基化产物的乳化能力;谷蛋白的胰凝乳蛋白酶水解物与壳聚糖在干热条件下反应15d得到的糖蛋白,在酸性pH值条件下,分子质量高的壳聚糖更能够提高乳化能力(4倍左右)。此外,增加糖基的导入量也能够提高糖蛋白的乳化能力。如果半乳甘露聚糖的导入量增加(从1mol增加至2mol),溶菌酶-半乳甘露聚糖共聚物的乳化能力也得到提高[9]。大豆分离蛋白与魔芋胶的干热法制得的美拉德产物,也具较好的乳化性质[11]。
反应底物的配比,即蛋白质与糖基的配比,这将一定程度上决定糖基的导入量,进而会影响到糖蛋白的乳化性能。大豆分离蛋白和右旋糖苷在60℃、按3:1的质量比反应15d,所得糖蛋白质量比1:1得到的糖蛋白具有最好的乳化能力[12]。
当然,蛋白质的美拉德反应产物除了具有更好的乳化能力外,其他的一些功能特性也可能同时得到改善。60℃加热β-乳球蛋白与单糖(阿拉伯糖、半乳糖、葡萄糖、鼠李糖或核糖)或二糖(乳糖)的混合物,得到的糖蛋白在乳化性、溶解性、起泡性及热稳定性方面,均有不同程度的提高[13]。
1.2.3 胶凝性质
许多研究结果表明,美拉德反应能够增加蛋白质凝胶强度。例如,卵白蛋白与葡萄糖在55℃、相对湿度35%的条件下反应,利用产物形成热诱导凝胶,发现该凝胶的凝胶断裂强度和持水性都随着加热时间的延长而增加[14]。卵白蛋白与半乳甘露聚糖的美拉德反应产物,在较宽pH值范围(pH3或pH7~9)和低离子强度(NaCl浓度小于100mmol/L)条件下,也能制得坚实而透明的热诱导凝胶[15]。
糖的种类对糖蛋白的胶凝性质影响很大。乳糖与乳清浓缩蛋白的美拉德产物,相比乳清浓缩蛋白,需要更长的时间和更高的温度才能形成凝胶,同时,凝胶的断裂强度减小;与此不太一致的是,核糖与乳清浓缩蛋白反应得到的美拉德产物,其凝胶的断裂强度和凝胶弹性却得到增强[16]。
不过,也有研究结果表明美拉德反应不会明显的改变蛋白的胶凝性,牛血清白蛋白就是一个特例。牛血清白蛋白和牛血清白蛋白的木糖共聚物的酸诱导凝胶的性质表现出许多相似点,二者都能在较低浓度下形成凝胶,形成凝胶后pH值都下降到4.9,并且凝胶表现出相似的黏弹性[17]。
1.2.4 流变学特性
流变学是食品蛋白质的重要的功能性质之一,影响着加工食品的质构特性。Corzo-Martínez等[18]的研究发现,糖基化酪蛋白(糖基为半乳糖、乳糖、葡聚糖)的表观黏度,会随着糖基化反应程度的增加而增加,在50℃条件下酪蛋白与半乳糖反应48h后,糖基化酪蛋白具有最大的表观黏度;此外,糖基化酪蛋白的弹性模量也随着糖基化反应程度的增加而增加。Oliver等[19]的研究结果也表明,美拉德反应能够增加产物的黏度,在60℃、相对湿度67%条件下,酪蛋白酸钠和果糖反应48h后,黏度增加了24倍;酪蛋白酸钠、果糖、菊粉按照质量比1:1:0.2反应,产物的黏度则可以增加15倍。一个实际应用的例子是:将大豆分离蛋白与葡聚糖在干热条件反应,制得的美拉德产物加入到自制的色拉酱中,产品具有更好的流变性[20]。
1.2.5 热稳定性
美拉德反应造成蛋白质与多糖的共价结合,抑制了蛋白质与蛋白质之间的相互作用,从而可以提高蛋白质的热稳定性。在pH 5、85℃条件下,β-乳球蛋白与葡聚糖发生美拉德反应后,蛋白质的热稳定性提高[21]。血浆蛋白的半乳甘露聚糖糖基化产物,在80℃热处理30min,仍然具有较好的乳化能力[8]。在pH 7.5、50℃热处理6h,鲤鱼肌原纤维蛋白及其与葡聚糖的美拉德产物,在浊度及溶解性变化明显不同:前者浊度明显增加,而后者的浊度增加较小;前者中的不溶性蛋白质占63%,而后者中仅有10%[22]。
1.2.6 其他性质
蛋白质的糖基化反应可以提高蛋白质的抗氧化性。Nakamura等[23]通过美拉德反应,将糊精共价导入卵清蛋白中,糖基化的蛋白具有更好的抗氧化能力。在湿热法(80℃、12h)条件下酪蛋白水解物和葡萄糖反应,产物清除DPPH自由基的能力增强[24]。Chevalier等[25]的研究也表明,美拉德糖基化蛋白具有较好的抗氧化性。不过,笔者认为,蛋白质糖基化后抗氧化活性的提高,应该是与其中所含的美拉德反应后期产物关系更大,与糖基化蛋白质本身的关系不大。
蛋白质的美拉德反应对其致敏作用也存在影响作用,但是研究结果不一致。例如,β-乳球蛋白的糖基化修饰降低了致敏作用[26],而花生蛋白的糖基化修饰增加致敏作用[27]。所以,这一方面还有待进一步的研究。
1.3 蛋白质的糖基化修饰与结构变化
糖蛋白的糖基化修饰是在蛋白质分子的侧链引入糖基,所以势必对蛋白质的结构产生影响。对糖基化蛋白结构的研究,有利于了解糖基化蛋白功能性质变化的因果关系。不过,相对于对糖基化蛋白功能性质的研究,对糖基化蛋白结构的研究较少。目前,对糖基化蛋白结构的相关研究,主要是对蛋白质的一级结构、二级结构以及蛋白质的微观结构的研究。
1.3.1 微结构变化
目前,主要利用扫描电子显微镜、透射电镜、原子力显微镜和激光共聚焦显微镜等手段研究微结构。Niu等[28]利用扫描电子显微镜,分析了葡聚糖的导入对小麦胚芽蛋白微结构的影响,结果显示,小麦胚芽蛋白的微结构从大的、不平坦、无规则的颗粒变成细条形的颗粒,而且糖基化反应后许多小麦胚芽蛋白的粒子趋于伸展。Zhu等[29]利用透射电镜发现乳清蛋白的粒子大小为3~5nm,而乳清蛋白与葡聚糖美拉德反应产物的粒子大小则增大到15~30nm。Mu等[30]利用β-酪蛋白与葡聚糖(分子质量为10kD),在物质的量比1:8下反应24h得到糖蛋白,利用原子力显微镜分析,发现该蛋白典型颗粒的直径是110nm,高度为10nm。Zhang等[31]用激光共聚焦显微镜分析乳化液滴的大小,发现由β-伴大豆球蛋白-葡聚糖的美拉德反应产物形成的乳化液滴较小(0.1~10μm),絮凝程度减弱,这一结果还证实乳浊液的稳定性。
1.3.2 一级结构变化
电喷雾电离质谱(ESI-MS)和基质辅助激光解吸-电离飞行时间质谱(MALDI-MS),能够精确测定蛋白质与糖基的交联位点,是研究糖基化蛋白结构的有效手段。Oliver等[32]综述了这2种方法在乳蛋白美拉德糖基化分析中的应用。Fenaille等[33]则利用ESI-MS和MALDI-MS,确定了β-乳球蛋白与乳糖或半乳糖的糖基化位点;他们发现MALDI-MS能更加有效的确定产物的糖基化位点,赖氨酸是主要的糖基化位点,随后是α-氨基和Arg-124;另外,与半乳糖相比,乳糖与β-乳球蛋白的交联位点具有专一性。
ESI-MS和MALDI-MS能够精确测定美拉德产物的分子质量,分析美拉德产物交联程度。例如,相关的MALDI-MS分析表明,β-乳球蛋白与半乳低聚糖发生美拉德反应(水分活度 0.44、40℃、反应23d)后,β-乳球蛋白的平均分子质量增加了21%[34]。French等[35]分别采用干热法和湿热法制备β-乳球蛋白-乳糖共聚物,然后利用ESI- MS和MALDI-MS测定反应过程中β-乳球蛋白的糖基化反应程度;他们发现,随着反应时间的延长(>3h),湿热法所得产物的ESI-MS图谱中糖蛋白的信号消失,随之非糖蛋白的信号强度增强;然而,当利用高灵敏度的MALDI-MS分析时,结果表明产物仍然是糖蛋白,其最大的交联度为11%~12%。
红外光谱在一定程度上能够反应蛋白质的一级结构。糖基化蛋白一级结构的变化,主要体现在C-N和N-H键的变化,这些基团具有红外特征吸收峰。Gu等[36]分析酪蛋白与葡萄糖的美拉德产物的红外特征,结果表明,酰胺-Ⅰ和酰胺-Ⅱ吸收强度减少,相应的,C=O(1650cm-1)和C-N(1540cm-1)的吸收强度增强;酰胺-Ⅲ(主要是C-N伸缩振动和N-H伸缩振动,在1300~1200cm-1有吸收)的吸收强度减小,这也一定程度上表明蛋白质一级结构发生了改变。
1.3.3 二级结构
整体上看,美拉德反应糖基化引起蛋白质二级结构的改变,主要表现为α螺旋、β折叠、β转角和无规则卷曲的增减。相关研究采用的手段主要为圆二色谱和X射线等。
采用圆二色谱分析糖基化蛋白的二级结构的研究相对较多。Niu等[28]研究表明,小麦胚芽蛋白的二级结构中α螺旋57%、β折叠9%、无规则卷曲33%;而其与葡聚糖进行美拉德反应后,产物的二级结构中α螺旋99%、无规卷曲1%。这一分析结果表明糖基化反应对蛋白质的二级结构影响很大。Darewicz等[37]的研究表明,β-酪蛋白-葡萄糖的糖基化产物中β转角结构增加,而无规卷曲结构减少,α螺旋和β-折叠结构没有明显变化。Stanic-Vucinic等[38]采用圆二色谱研究β乳球蛋白与一些单糖(如葡萄糖、半乳糖、果糖、核糖和阿拉伯糖)或二糖(乳糖)的美拉德反应产物,结果表明,蛋白质的二级结构和三级结构基本不变。β-乳球蛋白与葡萄糖反应后得到的共聚物,其二级和三级结构也基本不变[39]。羧甲基纤维素-大豆分离蛋白共聚物的X射线衍射扫描表明,美拉德反应会降低大豆分离蛋白的结晶度[40]。
1.4 美拉德反应糖基化途径所存在的问题
蛋白质的美拉德反应糖基化修饰能够有效地改善蛋白质的功能性质,但是所存在的问题也不容忽视。1)制备工艺上,美拉德糖基化存在不足。目前,糖基化反应途径主要包括2种方法:干热法和湿热法。干热反应速率很慢,在已研究的蛋白中,酪蛋白反应速率最快,要达到理想的反应程度需要大约 24h,而多数蛋白质在适宜的条件下的常常需要 2~3 周才能完成反应。同时,利用干热反应、欲得到理想的糖基化产物,就需要对反应条件加以严格控制。湿热法糖基化,虽然速度有所提高,但是主要是应用在简单蛋白质与单糖或双糖之间的反应,如β-乳球蛋白与乳糖的湿热反应[35,39]。2)美拉德反应存在产品褐变而影响产品的感官特性的问题,这是所不期望的。3)存在降低食品蛋白质的营养价值的问题[41]。赖氨酸是必需氨基酸,而美拉德反应中,赖氨酸通常是首先反应的交联位点。4)由于反应中所得的产物的结构极其复杂,种类繁多,因而存在食品安全问题[42]。有研究证实,一些含水量低且富含淀粉和糖类的物质,加热处理后形成5-羟甲基糠醛,该物质的代谢产物是5-硫代甲氧基糠醛,它对细菌和哺乳动物细胞具有损伤基因及诱发突变的作用[43]。也有研究证实,美拉德终产物可以引起氧化性应激和毒害神经元[44-45]、引发炎症[46]、促使结缔组织老化[47]。
可见,利用美拉德反应对蛋白质进行糖基化修饰,确实存在一些不足之处。因此,需要寻求可以替代美拉德反应的蛋白质糖基化新方法,例如,利用某些酶的作用。
2 转谷氨酰胺酶途径
2.1 转谷氨酰胺酶与其催化反应机制
转谷氨酰胺酶(EC 2.3.2.13)广泛地存在于动物、植物和微生物体内。商品化的转谷氨酰胺酶最初是从豚鼠肝脏中提取的,由于酶的原料来源较少、分离纯化工艺复杂,导致酶的价格十分昂贵,仅限于基础研究中应用。因此早期关于转谷氨酰胺酶应用的研究较少。1993年日本味素公司将微生物转谷氨酰胺酶实现了工业化生产,推出的转谷氨酰胺酶,推动了该酶在研究和生产中的应用。此后,关于转谷氨酰胺酶改善蛋白质功能性质的研究相当多,应用于众多类型的食品,如海洋食品、肉制品、乳制品、面制品、烘焙食品、豆制品等,相关文献和综述颇多,这里不加介绍。
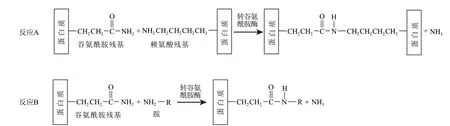
图 1 转谷氨酰胺酶催化的蛋白质交联与胺类化合物导入反应Fig.1 Cross-linking of proteins and incorporation of amine compounds catalyzed by transglutaminase
转谷氨酰胺酶能够催化蛋白质分子中谷氨酰胺残基与赖氨酸残基中的ε-氨基发生反应,形成分子内和/或分子间形成ε-(γ-谷氨酰基)赖氨酸异肽键,结果使蛋白质分子发生交联。其中,赖氨酸残基可以被伯胺类物质取代,即转谷氨酰胺酶能够催化蛋白分子中谷氨酰胺残基与伯胺类物质发生反应。也就是说,对于蛋白质底物,转谷氨酰胺酶可催化以下两种反应,如图1所示。反应A产生γ-谷氨酰基-ε-赖氨酸侧链肽,导致蛋白质交联;反应B使得在蛋白质底物上导入胺类化合物,两种反应竞争发生[48]。如果所导入的胺类化合物是一个氨基糖,就产生蛋白质的糖基化反应。但利用转谷氨酰胺酶对蛋白质进行糖基化的研究较少,同时,蛋白质分子之间的交联反应也是不可避免的。
2.2 蛋白质转谷氨酰胺酶途径糖基化研究近况
相对于转谷氨酰胺酶催化的蛋白质交联的研究,转谷胺酰胺酶途径的蛋白质糖基化研究极少,仅有有限的几篇报道。起初,研究者尝试利用该酶改善生物酶的性质。Villalonga等[49]利用转谷氨酰胺酶的催化作用使β-环糊精的衍生物(单-[6-(乙二胺)-6-脱氧]-β-环糊精等)与胰蛋白酶交联,发现胰蛋白酶-环糊精共聚物的热稳定性大大增强。Yan等[50]利用动物来源的转谷氨酰胺酶,将胺化的麦芽三糖导入β-酪蛋白,1mol琥珀酰化的β-酪蛋白可结合8mol胺化的麦芽三糖,首先证实转谷氨酰胺酶途径实现蛋白质糖基化的可行性。随后,Colas等[51]利用转谷氨酰胺酶,将半乳糖胺导入豌豆蛋白和醇溶蛋白,每摩尔豌豆蛋白及醇溶蛋白分别导入18和57个糖基单位(6-乙氨基-β-D-1-硫代吡喃半乳糖),糖基化蛋白在等电点处的溶解度增加了20%。随后,利用转谷氨酰胺酶对蛋白质糖基化的研究几乎停滞。
最近,本研究组也注意到转谷胺酰胺酶在蛋白质糖基化方面的潜力,分别将氨基葡萄糖共价交联至大豆分离蛋白和酪蛋白,同时诱导蛋白质发生交联反应,并发现糖基化蛋白质的溶解性、乳化性质等都有较大改善,尤其是流变学性质[52-54]。反应时间短、产物的性质变化显著。与单糖相比,寡糖具有更高的分子质量和更多的亲水性羟基,利用转谷氨酰胺酶将寡糖导入蛋白质中,在改善蛋白质功能特性方面将会具有更好的前景。所以,Flanagan等[55]就利用转谷氨酰胺酶将酪蛋白酸钠与阿拉伯胶共聚,赋予产品新的功能性质。不过,有关糖基化反应对蛋白质结构的影响,结构变化与功能性质之间的内在关系,还未得到揭示和解释。
转谷氨酰胺酶催化的蛋白质糖基化,是一种有前景的糖基化途径,能够有效的改善蛋白质的功能性质,并且不存在美拉德反应途径中所存在的那些副反应。需要进一步深入研究不同种类的蛋白质与具有伯胺特性的糖类之间的糖基化反应,以及糖基化反应对功能性质的影响,以最终建立转谷氨酰胺酶途径的蛋白质新型糖基化技术。
3 结 语
美拉德反应是一个食品蛋白质糖基化反应修饰时最重要的反应,在改善蛋白质的乳化性、溶解性、流变学性质等方面产生有利的影响,但是也存在反应速度慢的缺点,以及食品安全性、营养学上的不足。基于转谷氨酰胺酶途径的蛋白质糖基化,具有反应速度快、不产生副反应等优点,具有进一步研究、开发的前景。
[1] 赵新淮. 食品化学[M]. 北京: 化学工业出版社, 2006: 62-65.
[2] KOBAYSSHI K, KATO A. Developments in new functional food materials by hybridization of soy protein to polysaccharides[J]. Nutritional Science of Soy Protein, 1992, 13(1): 15-21.
[3] DICKINSON E, MCCLEMENTS D J. Advances in food colloids[M]. Blackie Academic and Professional, 1996.
[4] MU L X, ZHAO H F, ZHAO M M, et al. Physicochemical properties of soy protein isolates-acacia gum conjugates[J]. Czech Journal of Food Sciences, 2011, 29(2): 129-136.
[5] KATO Y, MATSUDA T, KATO N, et al. Browning and insolubilization of ovalbumin by the Maillard reaction with some aldohexoses[J]. Journal of Agricultural and Food Chemistry, 1986, 34(2): 351-355.
[6] SATO R, SAWABE T, KISHIMURA H, et.al. Preparation of neoglycoprotein from carp myofibrillar protein and alginate oligosaccharide: improved solubility in low ionic strength medium[J]. Journal of Agricultural and Food Chemistry, 2000, 48(1): 17-21.
[7] SAEKI H, AND INOUE K. Improved solubility of carp myofi brillar proteins in low ionic strength medium by glycosylation[J]. Journal of Agricultural and Food Chemistry, 1997, 45(9): 3419-3422.
[8] MATSUDOMI N, INOUE Y. Emulsion stabilization by Maillard-type covalent complex of plsama protein with galactomannan[J]. Journal of Food Science, 1995, 60(2): 265-268.
[9] SHU Y W, SAHARA S. Effect of the length of polysaccharide chains on the functional properties of the maillard-type lysozymepolysaccharide conjugates[J]. Journal of Agricultural and Food Chemistry, 1996, 44(9): 2544-2548.
[10] BABIKER E E. Effect of chitosan conjugation on the functional properties and bactericidal activity of gluten peptides[J]. Food Chemistry, 2002, 79(3): 367-372.
[11] 齐军茹, 杨晓泉, 彭志英. 大豆蛋白-多糖复合物的制备及乳化性能的研究[J]. 食品科学, 2003, 24(11): 34-37.
[12] DIFTIS N, KIOSSEOGLOU V. Physicochemical properties of dry-heated soy protein isolate-dextran mixtures[J]. Food Chemistry, 2006, 96(2): 228-233.
[13] CHEVALIER F, HOBERT M, POPINEAU Y, et al. Improvement of functional properties of β-lactoglobulin glycated through the Maillard reaction is related to the nature of the sugar[J]. International Dairy Journal, 2001, 11(3): 145-152.
[14] HANDA A, KURODA N. Functional improvements in dried egg white through the Maillard reaction[J]. Journal of Agricultural and Food Chemistry, 1999, 47(5): 1845-1850.
[15] MATSUDOMI N, NAKANO K, SOMA A, et al. Improvement of gel properties of dried egg white by modification with galactomannan through the Maillard reaction[J]. Journal of Agricultural and Food Chemistry, 2002, 50: 4113-4118.
[16] RICH L M, FOEGEDING E A. Effects of sugars on whey protein isolate gelation[J]. Journal of Agricultural and Food Chemistry, 2000, 48(10): 5046-5052.
[17] ARMSTRONG H J, HILL S E, SCHROOYEN P, et al. A comparison of the viscoelastic properties of conventional and Maillard protein gels[J]. Journal of Texture Studies, 1994, 25: 285-298.
[18] CORZO-MARTÍNEZ M, JAVIER MORENO F, VILLAMIEL M, et al. Characterization and improvement of rheological properties of sodium caseinate glycated with galactose, lactose and dextran[J]. Food Hydrocolloids, 2010, 24(1): 88-97.
[19] OLIVER C M, MELTON L D, STANLEY R A. Functional properties of caseinate glycoconjugates prepared by controlled heating in the ‘dry’ state[J]. Journal of the Science of Food and Agriculture, 2006, 86(5): 732-740.
[20] DIFTIS N G, BILIADERIS C G, KIOSSEOGLOU V D. Rheological properties and stability of model salad dressing emulsions prepared with a dry-heated soybean protein isolate: dextran mixture[J]. Food Hydrocolloids, 2005, 19(6): 1025-1031.
[21] JIMÉNEZ-CASTAÑO L, LÓPEZ-FANDIÑO R, OLANO A. Study on β-lactoglobulin glycosylation with dextran: effect on solubility and heat stability[J]. Food Chemistry, 2005, 93(4): 689-695.
[22] FUJIWARA K, OOSAWA T, SAEKI H. Improved thermal stability and emulsifying properties of carp myofibrillar proteins by conjugation with dextran[J]. Journal of Agricultural and Food Chemistry, 1998, 46(4): 1257-1261.
[23] NAKAMURA S, KATO A, KOBAYASHI K. Enhanced antioxidative effect of ovalbumin due to covalent binding of polysaccharides[J]. Journal of Agricultural and Food Chemistry, 1992, 40(11): 2033-2037
[24] DONG S Y, WEI B B, CHEN B C. Chemical and antioxidant properties of casein peptide and its glucose Maillard reaction products in fish oil-in-water emulsions[J]. Journal of Agricultural and Food Chemistry, 2011, 59(24): 13311-13317.
[25] CHEVALIER F, CHOBERT J M, GENOT C, et al. Scavenging of free radicals, antimicrobial, and cytotoxic activities of the Maillard reaction products of α-lactoglobulin glycated with several sugars[J]. Journal of Agricultural and Food Chemistry, 2001, 49(10): 5031-5038.
[26] MAKOTO H, KOICHI H, KOKI O, et al. Reduced immunogenicity of β-lactoglobulin by conjugation with carboxymethy dextran[J]. Bioconjugate Chemistry, 2000, 11(1): 84-93.
[27] CHUNG S Y, CHAMPAGNE E T. Allergenicity of Maillard reaction products from peanut proteins[J]. Journal of Agricultural and Food Chemistry, 1999, 47(12): 5227-5231.
[28] NIU L Y, JIANG S T, PAN L J, et al. Characteristics and functional properties of wheat germ protein glycated with saccharides through Maillard reaction[J]. International Journal of Food Science and Technology, 2011, 46(10): 2197-2203.
[29] ZHU D, DAMODARAN S, LUCEY J A. Physicochemical and emulsifying properties of whey protein isolate (WPI): dextran conjugates produced in aqueous solution[J]. Journal of Agricultural and Food Chemistry, 2010, 58(5): 2988-2994.
[30] MU M F, PAN X Y, YAO P, et al. Acidic solution properties of β-casein-graft-dextran copolymer prepared through Maillard reaction[J]. Journal of Colloid and Interface Science, 2006, 301(1): 98-106.
[31] ZHANG J B, WU N N, YANG X Q, et al. Improvement of emulsifying properties of Maillard reaction products from β-conglycinin and dextran using controlled enzymatic hydrolysis[J]. Food Hydrocolloids, 2012, 28(2): 301-312.
[32] OLIVER C M. Insight into the glycation of milk proteins, an ESI-and MALDI-MS perspective (review)[J]. Critical Reviews in Food Science and Nutrition, 2011, 51(5): 410-431.
[33] FENAILLE F, MORGAN F, PARISOD V, et al. Solid-state glycation of β-lactoglobulin by lactose and galactose: localization of the modifi ed amino acids using mass spectrometric techniques[J]. Journal of Mass Spectrometry, 2004, 39(1): 16-28.
[34] SANZ M L, CORZO-MARTÍNEZ M, RASTALL R A, et al. Characterization and in vitro digestibility of bovine β-lactoglobulin glycated with galactooligosaccharides[J]. Journal of Agricultural and Food Chemistry, 2007, 55(19): 7916-7925.
[35] FRENCH S J, HARPER W J, KLEINHOLZ N M, et al. Maillard reaction induced lactose attachment to bovine β-lactoglobulin: electrospray ionization and matrix-assisted laser desorption/ionization examination[J]. Journal of Agricultural and Food Chemistry, 2002, 50(4): 820-823.
[36] GU F L, KIM J M, ABBAS S, et al. Structure and antioxidant activity of high molecular weight Maillard reaction products from caseinglucose [J]. Food Chemistry, 2010, 120(2): 505-511.
[37] DAREWICZ M, DZIUBA J. The effect of glycosylation on emulsifying and structural properties of bovine β-casein[J]. Nahrung Food, 2001, 45(1): 15-20.
[38] STANIC-VUCINIC D, PRODIC I, APOSTOLOVIC D, et al. Structure and antioxidant activity of β-lactoglobulin-glycoconjugates obtained by high-intensity-ultrasound-induced Maillard reaction in aqueous model systems under neutral conditions[J]. Food Chemistry, 2013, 138(1): 590-599.
[39] van TEEFFELEN A M M, BOERSEN K, DE JONGH H H J. Glucosylation of β-lactoglobulin lowers the heat capacity change of unfolding: a unique way to affect protein thermodynamics[J]. Protein Science, 2005, 14(8): 2187-2194.
[40] SU J F, HUANG Z, YUAN X Y, et al. Structure and properties of carboxymethyl cellulose/soy protein isolate blend edible fi lms crosslinked by Maillard reactions[J]. Carbohydrate Polymers, 2010, 79(1): 145-153.
[41] MARTINS S I F S, JONGEN W M F, van BOEKEL M A J S. A review of Maillard reaction in food and implications to kinetic modeling[J]. Trends in Food Science and Technology, 2001, 11(9): 364-373.
[42] BRANDS C M J, ALINK G M, van BOEKEL M A J S, et al. Mutagenicity of heated sugar-casein systems: effect of the Maillard reaction[J]. Journal of Agricultural and Food Chemistry, 2000, 48(6): 2271-2275.
[43] GLATT H R, SOMMER Y. Health risks by 5-hydroxymethylfurfural( HMF) and related compounds[M]//SKOG K, ALEXANDER J. Acrylamide and other health hazardous compounds in heat-treated foods. Cambridge: Woodhead Publishing; 2007: 328-357.
[44] MRUTHINTI S, SOOD A, HUMPHREY C L, et al. The induction of surface beta-amyloid binding proteins and enhanced cytotoxicity in cultured PC-12 and IMR-32 cells by advanced glycation end products[J]. Neuro Science, 2006, 142(2): 463-473.
[45] WEI Y, CHEN L, CHEN J. Rapid glycation with D-ribose induces globular amyloid-like aggregations of BSA with high cytotoxicity to SH-SY5Y cells[J]. BMC Cell Biology, 2009, 10(1): 10.
doi:10.1186/1471-2121-10-10.
[46] MUNCH G, APELT J, ROSEMARIE KIENTSCH E, et al. Advanced glycation endproducts and pro- infl ammatory cytokines in transgenic Tg2576 mice with amyloid plaque pathology[J]. Neurochemistry, 2003, 86(2): 283-289.
[47] BAYNES J W, MONNIER V M, AMES J M, et al. The Maillard reaction: chemistry at the interface of nutrition, aging and disease[M]. Annals of the New York Academy of Sciences, 2005: 1043.
[48] de JONG G A H, KOPPELMAN S J. Transglutaminase catalyzed reactions: impact on food applications[J]. Concise Reviews and Hypotheses in Food Science, 2002, 67(8): 2798-2806.
[49] VILLALONGA R, FERNÁNDEZ M, FRAGOSO A, et al. Thermal stabilization of trypsin by enzymatic modification with β-cyclodextrin derivatives[J]. Biotechnology and Applied Biochemistry, 2003, 38(1): 53-59.
[50] YAN S C B, WOLD F. Neoglucoproteins: in vitro introduction of glycosyl units at glutamine in α-casein using transglutaminase[J]. Biochemistry, 1984, 23(16): 3759-3769.
[51] COLAS B, CAER D, FOURNIER E. Transglutaminase-catalyzed glycosylation of vegetable proteins. Effect on solubility of pea legumin and wheat gliadins[J], Journal of Agricultural and Food Chemistry, 1993, 41: 1811-1815.
[52] JIANG S J, ZHAO X H. Transglutaminase-induced cross-linking and glucosamine conjugation in soybean protein isolates and its impacts on some functional properties of the products[J]. European Food Research and Technology, 2010, 231(5): 679-689.
[53] JIANG S J, ZHAO X H. Transglutaminase-induced cross-linking and glucosamine conjugation of casein and some functional properties of the modifi ed product[J]. International Dairy Journal, 2011, 21(4): 198-205.
[54] JIANG S J, ZHAO X H. Cross-linking and glucosamine conjugation of casein by transglutaminase and the emulsifying property and digestibility in vitro of the modifi ed product[J]. International Journal of Food Properties, 2012, 15(6): 1286-1299.
[55] FLANAGAN J, SINGH H. Conjugation of sodium caseinate and gum arabic catalyzed by transglutaminase[J]. Journal of Agricultural and Food Chemistry, 2006, 54(19): 7305-7310.
