带鱼蛋白酶解条件优化及酶解物抗氧化性能
2013-08-07武玉学
厉 望,靳 挺*,武玉学
(1.浙江大学化学工程与生物工程学系,浙江 杭州 310027;2.浙江大学宁波理工学院生物与化学工程学院,浙江 宁波 315100)
氧化与人类及其他动物的许多疾病诸如癌症、老化、动脉硬化等的发病机理有关。适当摄入具有抗氧化活性的物质可以降低体内自由基水平,防止脂质过氧化,帮助机体抵御疾病。介于蛋白质和氨基酸间的肽类由于结构特点,与其他生物分子如氨基酸、大分子蛋白质等比较,食用安全性更高,具有极强的活性和多样性,而且容易被吸收利用,同时还具有独特的生理功能,如降血压、抗氧化、降低胆固醇、增强免疫力等。其抗氧化性相比于蛋白质和氨基酸往往更为显著,通过蛋白质的可控酶解技术制备天然的抗氧化肽将能很好地解决以上需求[1-3]。随着生物工程技术的发展,将有越来越多的抗氧化肽被开发,作为功能性基料或添加剂应用于食品工业和医药工业[4]。
水解鱼蛋白中蛋白质含量高,必需氨基酸比例较高,含有较高水平的微量元素碘和硒,VB2和VB5含量也较为丰富[5],可作为制取抗氧化肽的理想原料。目前国内外有不少研究者用不同种类的蛋白在适当条件下经过酶解制备抗氧化活性肽,如侯雅坤等[6]利用核桃蛋白酶解,制备了具有良好抗氧化性的酶解物;Li Lin等[7]水解鳙鱼制得抗氧化肽;李俊江等[8]研究鹅肉蛋白酶解物的抗氧化特性及功能特性。本实验以DPPH自由基清除率为主要指标,水解度为辅助指标,选用4种蛋白酶对带鱼进行酶解,筛选出最适用酶,并优化带鱼蛋白的酶解工艺,研究酶解产物的抗氧化特性,旨在为带鱼蛋白制备抗氧化肽提供依据。
1 材料与方法
1.1 材料与试剂
新鲜带鱼,市售,去头和内脏,贮于-20℃冰箱中备用。
碱性蛋白酶(Alcalase 2.4L,酶活力2.4AU/g)、风味蛋白酶(Flavourzyme,酶活力500LAPU/g)、中性蛋白酶(Neutrase,酶活力0.8AU/g) 丹麦诺维信公司;木瓜蛋白酶(酶活力200万U/g) 南宁庞博生物工程有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) 美国Sigma公司;其他化学试剂均为分析纯。
1.2 仪器与设备
DS-1型电动高速组织捣碎机 上海精科实业有限公司;HHS型恒温水浴锅、85-2型恒温磁力搅拌器 巩义市英峪予华仪器厂;高速冷冻离心机 长沙湘仪离心机器械有限公司;722S型紫外分光光度计 上海精密科学仪器有限公司;Kjeltec 2300凯氏定氮仪 丹麦FOSS公司;DELTA-320pH计 梅特勒-托利多仪器(上海)有限公司;Sartorius(BP211D)电子天平 北京赛多利斯仪器系统有限公司;Aminosys A200氨基酸自动分析仪 德国安米诺西斯公司。
1.3 方法
1.3.1 带鱼蛋白酶解液的制备
带鱼肉→去头内脏洗净→按比例加水→搅成肉糜→水浴锅中酶解并不断搅拌→90℃水浴中灭酶15min→4000r/min、4℃离心20min→过滤取上清液→酶解产物
1.3.2 酶种类的选择
分别选用碱性蛋白酶(Alcalase 2.4L)、风味蛋白酶(Flavourzyme)、中性蛋白酶(Neutrase)、木瓜蛋白酶,确定带鱼、蒸馏水质量比1:3,水解时间5h,加酶量1.6%(以鱼肉质量的百分比计),按照表1所示,在各蛋白酶最适pH值和温度条件下进行水解。综合考虑酶解物DPPH自由基清除率和水解度,筛选出最适用酶。

表 1 各种酶酶解条件Table 1 Hydrolysis conditions of 4 kinds of proteases
1.3.3 蛋白质水解度的测定
分别采用中性甲醛滴定法[9]和凯氏定氮法[10]测水解液中氨基态氮含量和样品总氮含量,按式(1)计算水解度。

1.3.4 酶解物DPPH自由基清除率的测定
称取DPPH试剂12.80mg,用50%乙醇溶解,定容转入50mL容量瓶中,摇匀得质量浓度为256.1mg/L DPPH 储备液,置于冰箱中备用,使用前用50%乙醇稀释至质量浓度为25.61mg/L。将DPPH溶液室温条件下静置10min 后,加入样品待测液2mL,摇匀,放置一定时间,以乙醇调零,测定波长517nm处吸光度(Ai)。测定2mL DPPH溶液与2mL 50%乙醇溶液在波长517nm处吸光度(Ao),测定2mL样品待测液与2mL 50%乙醇溶液在波长517nm处吸光度(Aj)[11]。每个样品重复3次,求得清除率平均值。
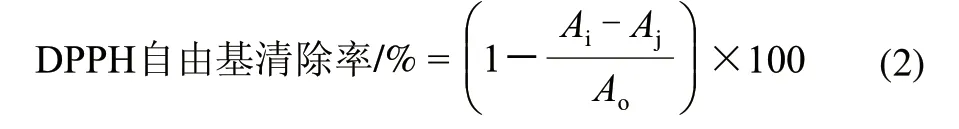
1.3.5 酶解物还原力的测定
在1mL各浓度样品中,加入2.5mL质量分数为1%的铁氰化钾溶液和2.5mL 0.2mol/L的磷酸盐缓冲液(pH6.6),混匀后在50℃水浴保温20min,然后加入2.5mL质量分数为10%的三氯乙酸,混合后以3000r/min离心10min,取上清液2.5mL,加入2.5mL蒸馏水和0.5mL质量分数为0.1%的FeCl3,室温反应10min后在波长700nm处测其吸光度[12],吸光度越大则样品的还原能力越强。
1.3.6 酶解物·OH清除率的测定
取5mmol/L的邻二氮菲溶液1mL于试管中,依次加入0.2mol/L磷酸盐缓冲液(pH7.4)2mL和蒸馏水1mL、5mmol/L硫酸亚铁溶液1mL,充分混匀,加0.1%的H2O21mL,于37℃条件下恒温反应60min,于波长536nm处测其吸光度AP;同前步,以1mL蒸馏水代替其中的H2O2,测得的吸光度Ab;用样品液1mL代替其中的1mL蒸馏水,测得吸光度As[13]。
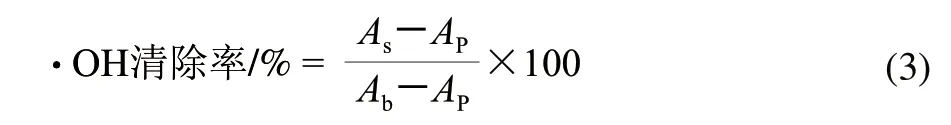
1.3.7 响应面分析因素及水平表
根据单因素试验结果,运用Box-Behnken的中心组合试验设计原理,以酶解温度(X1)、酶解时间(X2)、加酶量(X3)为变量,展开三因素三水平的响应面试验,分析因素及水平设计见表2。
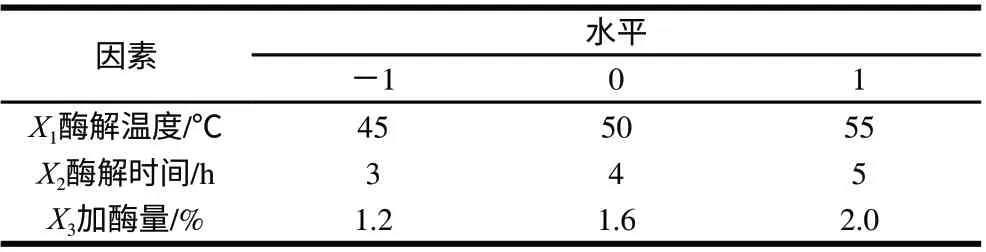
表 2 响应面分析因素及水平Table 2 Analytical factors and levels for response surface methodology
1.3.8 带鱼蛋白酶解物分子质量的测定
采用Sephadex G-25凝胶,选用柱管内径15mm,柱长50cm的层析柱。采取标准蛋白对照层析方法测定酶解物的分子质量。上样量1mL,以1/15mol/L pH6.98磷酸盐缓冲液(含0.15mol/L NaCl洗脱,流速0.5mL/min。标准蛋白分别为BSA、胰凝乳蛋白酶原A、溶菌酶、VB12,分子质量分别为67000、25000、14400、1355D,各取10mg用上述磷酸盐缓冲液定容于10mL容量瓶中。测定各标准样出峰时间(t),以出峰时间为横坐标(x),标准样分子质量的对数值(lgM)为纵坐标(y)制作标准曲线。酶解物的分子质量(M)由其出峰时间和标准曲线求得。
1.3.9 带鱼蛋白酶解物氨基酸组成分析
按GB/T 18246—2000《饲料中氨基酸测定》和GB/T 15399—1994 《饲料中含硫氨基酸测定:离子交换色谱法》,在氨基酸自动分析仪上进行。
2 结果与分析
2.1 酶种类的选择
酶的专一性决定了某种蛋白酶只作用于某些肽键或带有某种基团的氨基酸所形成的肽键。酶种类不同,其底物特异性和作用位点也不同,这决定了酶解产物的组成、结构和功能,因此需要筛选出能高效作用于低值鱼蛋白的蛋白酶。
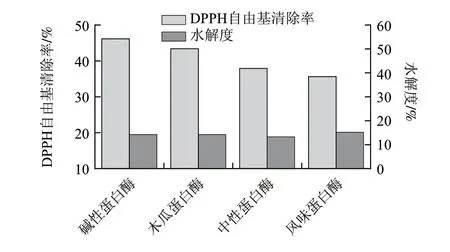
图 1 不同蛋白酶解物的DPPH自由基清除率和水解度Fig.1 DPPH radical scavenging rate and hydrolysis degree of the enzymatic hydrolysates obtained by different proteases
由图1可知,碱性蛋白酶酶解产物的DPPH自由基清除率较高,风味蛋白酶的水解度最大。各种蛋白酶酶解产物的DPPH自由基清除率和水解度分别为碱性蛋白酶(46.15%,14.13%),木瓜蛋白酶(43.38%,14.20%)、风味蛋白酶(35.64%,15.23%)、中性蛋白酶(37.91%,13.37%)。风味蛋白酶是经米曲霉发酵制得真菌蛋白酶和肽酶的复合体,包含内切蛋白酶和外切肽酶两种活性,主要从肽链内部或肽链末端切断肽键,将多肽水解为低分子小肽和氨基酸,因而水解程度较高。碱性蛋白酶是一种内切丝氨酸蛋白酶,主要用于切断蛋白质肽链内部的肽键,生成多肽等中间产物,且可以裂解谷氨酸、蛋氨酸、亮氨酸、酪氨酸和赖氨酸等羧端肽键[14],其酶解产物DPPH自由基清除率较高。因此综合考虑抗氧化活性与水解效果,选用碱性蛋白酶作为水解用酶。
2.2 带鱼蛋白酶解工艺优化
2.2.1 酶解时间对DPPH自由基清除率、水解度的影响
在酶解温度50℃、加酶量1.6%、固液比1:3,调节酶解时间3、4、5、5.5、6h,考察酶解时间对DPPH自由基清除率、水解度的影响。由图2可知,水解度随着水解时间的增加,呈现上升的趋势,在6h时达到16.3%。酶解产物的DPPH自由基清除率随酶解时间的延长逐渐增大,在4h时达到最大值46.15%,之后随着时间延长开始减小。在反应的开始阶段,酶活力高,酶切位点多,反应速率快,水解度显著增大;随着酶解时间延长,酶的活性部位被饱和,反应速率降低,水解趋于平缓,多肽逐渐水解为无抗氧化作用的氨基酸,而多肽为清除自由基的主要成分[15],因而DPPH自由基清除率下降。因此酶解时间以4h左右为宜。
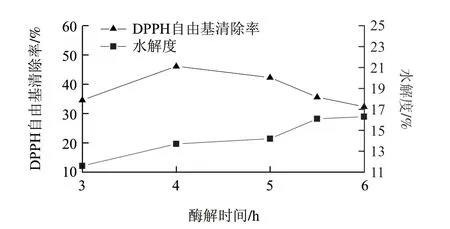
图 2 酶解时间对DPPH自由基清除率、水解度的影响Fig.2 Effect of hydrolysis duration on DPPH radical scavenging rate and hydrolysis degree of resultant hydrolysates
2.2.2 酶解温度对DPPH自由基清除率、水解度的影响
在固液比1:3、酶解时间3h、加酶量1.6%,调节酶解温度30、40、45、50、55、60℃,考察酶解温度对DPPH自由基清除率、水解度的影响。由图3可知,随着温度的升高,DPPH自由基清除率与水解度逐渐增大,在50℃时达到最大值,分别为46.15%和14.2%,当温度高于50℃时,清除率与水解度开始减小。在反应的初始阶段,温度较低,酶活性较低,随着温度的升高,体系的内能逐渐增大,酶与底物之间的接触机会增多,酶促反应速率加快,水解度上升,当温度继续升高时,当其所处环境的温度高于某一点时,酶蛋白的特定结构会发生改变,酶的活性也会降低甚至失活,此时水解度开始下降,因此酶催化反应要有一个适宜的温度[16]。酶解温度以50℃左右为宜。
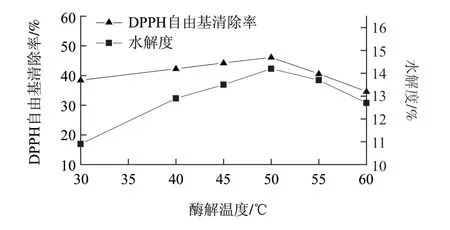
图 3 酶解温度对DPPH自由基清除率、水解度的影响Fig.3 Effect of hydrolysis temperature on DPPH radical scavenging rate and hydrolysis degree of resultant hydrolysates
2.2.3 加酶量对DPPH自由基清除率、水解度的影响
在酶解温度50℃、酶解时间3h、固液比1:3,调节加酶量0.4%、0.8%、1.2%、1.6%、2.0%,考察加酶量对DPPH自由基清除率、水解度的影响,结果如图4所示。随着加酶量增大,相应DPPH自由基清除率显著增大,在加酶量为1.6%时达最大值55.37%,而后逐渐减小。水解度随着加酶量的增加显著增大,在加酶量大于1.2%时,变化趋于平稳。加酶量增加虽然可以提高蛋白质水解速率,但同时也增加了水解液中的抗氧化肽段被降解成无抗氧化作用的小肽段及游离氨基酸的几率[17]。综合考虑酶的使用成本,加酶量以1.6%为宜。
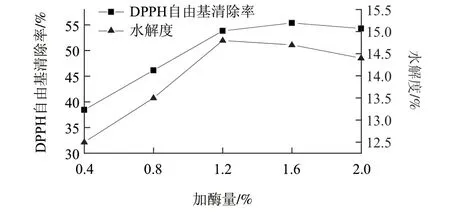
图 4 加酶量对DPPH自由基清除率、水解度的影响Fig.4 Effect of enzyme addition amount on DPPH free radical scavenging rate and hydrolysis degree of resultant hydrolysates
2.2.4 响应面优化结果分析
根据单因素试验得到的结果,选择酶解温度、酶解时间、加酶量3个因素,以DPPH自由基清除率为响应值,设计三因素三水平的响应面试验,见表3。碱性蛋白酶酶解带鱼蛋白的工艺优化根据Box-Behnken试验设计进行了15组试验,其中1~12组为析因点和零点试验,13~15组为中心点重复试验。利用Design-Expert8.0.7软件对DPPH自由基清除率与各水解因素进行多元回归拟合,得到回归方程:Y=59.647-1.99X1+0.705X2-4.07X3-2.68X1X2+0.895X1X3+3.225X2X3-8.143X12-4.253X22-7.303X32,方差分析结果见表4。
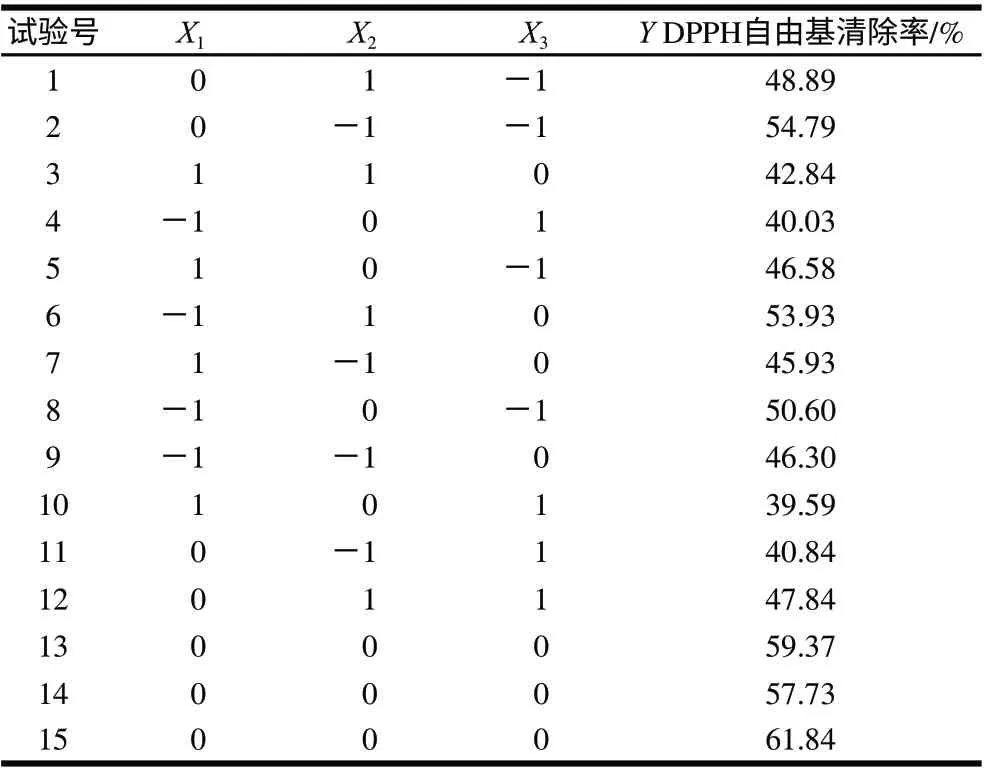
表 3 Box-Beknhen中心组合试验设计及结果Table 3 Design and results of Box-Beknhen tests
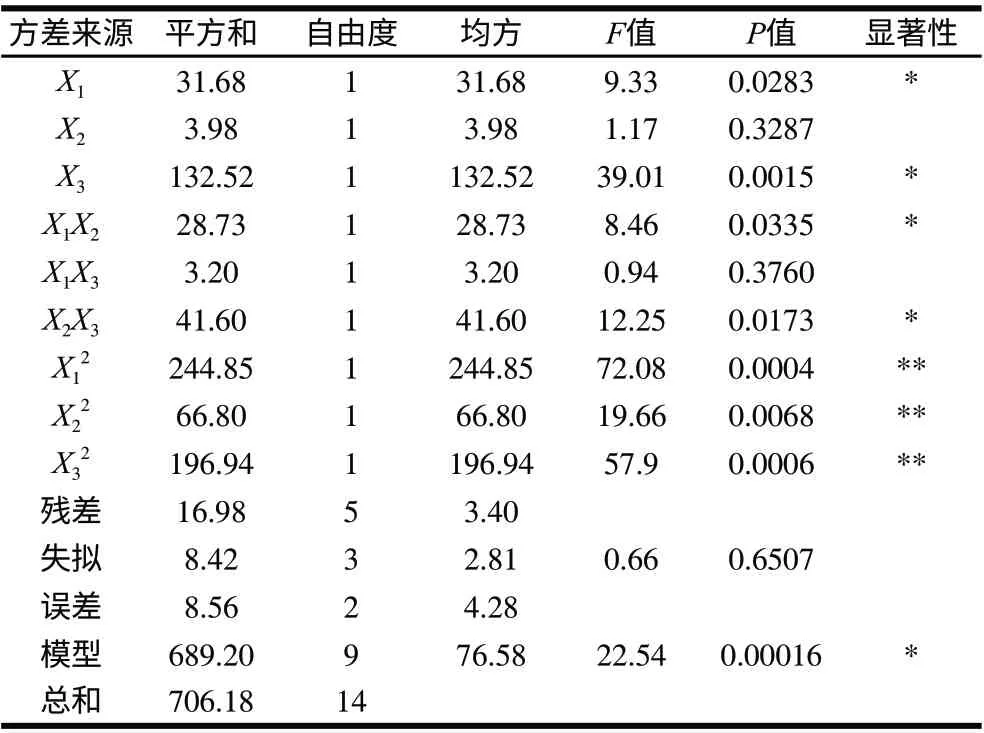
表 4 DPPH自由基清除率为响应值的二次多项式模型方差分析Table 4 Variance analysis for the fitted quadratic polynomial model describing DPPH radical scavenging rate
由表4可知,回归方程R2=0.9757,RAdj2=0.9627,说明该模型方程有很好的精密度,回归效果较好,可信度高;失拟项不显著(P=0.6507>0.05),表明该模型拟合程度良好,因此以该模型优化带鱼蛋白的酶解工艺是合适的,能很好地预测酶解各因素对DPPH自由基清除率的影响。
试验中一次项X1(酶解温度)、X3(加酶量)及交互项X2X3(酶解时间和加酶量),X1X2(酶解温度和酶解时间)和全部二次项影响较为显著,各个因素对DPPH自由基清除率的影响不是简单的线性关系。由F值可知,酶解温度和加酶量对结果影响较大,酶解时间影响较小。
响应面图形是响应值对应自变量酶解温度、酶解时间、酶用量所构成的一个三维空间图,可直观地反映出各自变量对响应值的影响。利用二次多项式回归方程和Box-Behnken试验所得的结果,利用Design-Expert 8.0.7软件作图分析(图5),可以看出清除率存在最高点。对上述回归方程求解,可得X1=0.1272,X2=-0.0654,X3=-0.2853,Y有最大值,即蛋白酶解物清除DPPH自由基的最佳条件组合为:酶解温度48.57℃、酶解时间3.81h、加酶量1.65%、固液比1:3,此时DPPH自由基清除率为59.81%。为了验证模型预测的准确性,在酶解温度48℃、酶解时间3.8h、加酶量1.65%、固液比1:3的条件下进行实验,实际测得的DPPH自由基清除率为60.13%,实测值和最佳理论值误差在±1%以内,可见该模型能较好地预测带鱼蛋白酶解物清除DPPH自由基的情况。
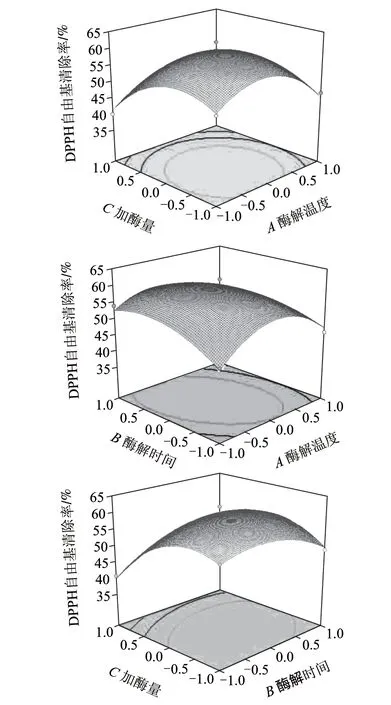
图 5 各因素交互作用对DPPH自由基清除率的影响Fig.5 Response surface plots for the effects of the cross-interactions among different variables on DPPH radical scavenging rate
2.3 酶解物的还原力和对·OH的清除率
在2.2节所得优化条件下酶解带鱼蛋白,测定酶解物的还原力和对·OH的清除率。由图6可知,酶解起始阶段,酶解物还原力和对·OH的清除率随着酶解时间的延长而增大,在酶解3.8h时达到最大;但随着酶解的继续开始减小。这与前述结论多肽逐渐水解成无抗氧化作用的氨基酸导致抗氧化能力下降是相符的。可见所得酶解物具有良好的还原力和对·OH清除能力,表现出较好的抗氧化能力。
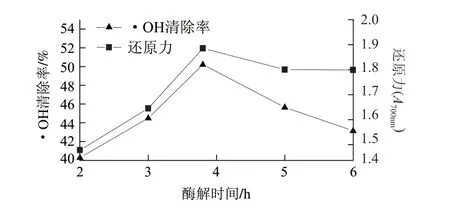
图 6 酶解物还原力和清除·OH的能力Fig.6 Reducing power and hydroxyl radical scavenging rate of resultant hydrolysates
2.4 带鱼蛋白酶解物的分子质量
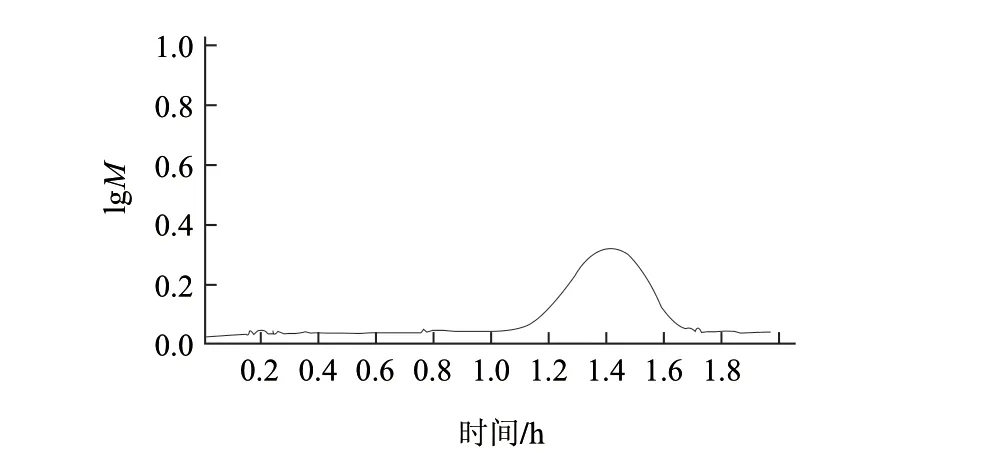
图 7 带鱼蛋白酶解物层析谱图Fig.7 Sephadex G-25 chromatographic pattern of optimal hairtail protein hydrolysates
经测定,标准曲线方程为y=5.7 4 7 0-0.0 3 1 3 t (R2=0.9829)。由图7可知,酶解物的出峰时间为84min,由标准曲线方程计算得样品带鱼蛋白酶解液的分子质量为1311D。范建凤等[18]研究了蟹抗氧化肽的分离纯化,蟹抗氧化肽经Sephadex G-25凝胶分离得到3种组分,其中分子质量为1096.5D的组分抗氧化活性较强;据文献[19-20]报道,分子质量低于3000D的多肽不仅容易吸收,加工性能好,易与其他调料协调搭配,而且还显示出良好的如降血脂、抗氧化等生理活性。本研究带鱼蛋白酶解物分子质量在3000D以下,层析图中只出现1个洗脱峰,分子质量较为接近,可见带鱼蛋白具有开发制备抗氧化产品的潜力。
2.5 带鱼蛋白酶解物氨基酸组成分析
将经Sephadex G-25凝胶层析收集的洗脱峰样品进行氨基酸组成分析,结果如表5所示。酶解产物含有苏氨酸、亮氨酸、赖氨酸和蛋氨酸等人体必需氨基酸,必需氨基酸含量占总氨基酸含量的37.13%;据文献[21]报道,丙氨酸、蛋氨酸、脯氨酸、半胱氨酸、亮氨酸、甘氨酸和缬氨酸对清除自由基有较好的效果,经计算上述氨基酸含量占总氨基酸含量的35.1%;带鱼蛋白酶解物构成肽的氨基酸含量占总氨基酸含量的89.8%,含量较为丰富,因此低分子肽为带鱼蛋白酶解物的主要成分。
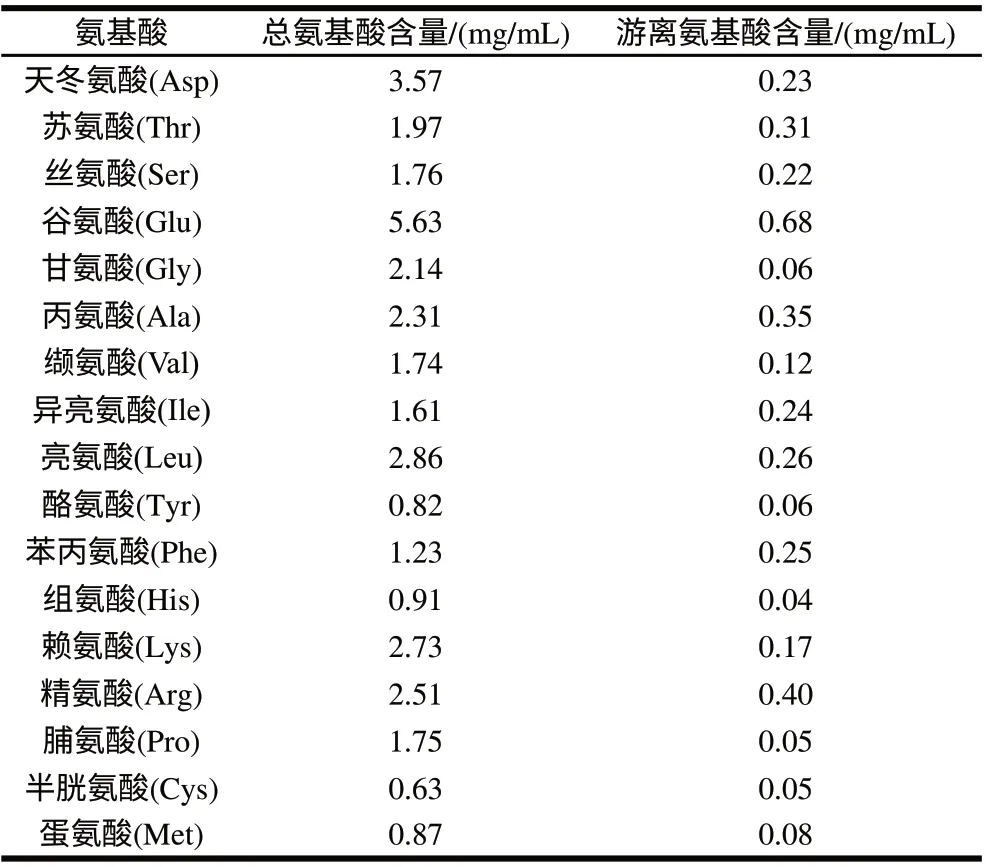
表 5 酶解物氨基酸组成分析Table 5 Amino acids compositions of the hydrolysates
3 结 论
以DPPH自由基清除率为主要指标,水解度为辅助指标,分别选用碱性蛋白酶、风味蛋白酶、中性蛋白酶、木瓜蛋白酶,在各自最适pH值和温度条件下对带鱼蛋白进行酶解,其中碱性蛋白酶水解产物的DPPH自由基清除率较高。因此综合考虑抗氧化能力和水解效果,选用碱性蛋白酶作为实验用酶。通过响应面优化试验得到,碱性蛋白酶水解带鱼蛋白所得酶解液清除DPPH自由基的最佳条件为酶解温度48℃、加酶量1.65%、酶解时间3.8h、固液比1:3,清除率达到60.13%;所得酶解物具有良好的还原力和对·OH的清除能力,分子质量为1311D;酶解物含有清除自由基作用较好的氨基酸,构成肽的氨基酸含量占总氨基酸含量的89.8%,低分子肽为带鱼蛋白酶解物的主要成分。由此看来,带鱼蛋白酶解物对DPPH自由基和·OH有很好的清除作用,且有较好的还原力,表现出一定的抗氧化能力,为带鱼蛋白制取天然抗氧化肽提供了理论依据。
[1] LYENGAR R, MCEVILY A J. Antibrowning agents: alternatives to the use of sulfi tes in foods[J]. Trends Food Sci Technol, 1992, 3: 60-64.
[2] 丁利君, 黄小梅, 何颖基. 罗非鱼蛋白制取多肽酶解条件的优化[J]. 食品与机械, 2008, 24(2): 15-19.
[3] CHAN K M, DECKER E A, MEANS W J. Extraction and activity of Carnosine, a naturally occurring antioxidant in beef muscle[J]. J Food Sci, 1993, 58(1): 1-4.
[4] 张昊, 任发政. 天然抗氧化肽的研究进展[J]. 食品科学, 2008, 29(4): 443-447.
[5] 王新星, 孔凡华, 许团辉, 等. 水解鱼蛋白营养组成及评价[J]. 渔业科学进展, 2011, 32(3): 104-110.
[6] 侯雅坤, 王晟, 黄昆, 等. 核桃蛋白酶解工艺优化与酶解液抗氧化活性分析[J]. 食品与发酵工业, 2012, 38(4): 99-103.
[7] LI Lin, WANG Jinshui, ZHAO Mouming, et al. Artificial neural network for production of antioxidant peptides derived from big head carp muscles with alcalase[J]. Food Technology and Biotechnology, 2006, 44(3): 441-448.
[8] 李俊江, 潘道东, 郭宇星, 等. 鹅肉蛋白酶解条件优化及酶解产物抗氧化活性研究[J]. 食品科学, 2012, 33(3): 126-130.
[9] 朱俭. 生物化学实验[M]. 上海: 上海科学技术出版社, 1987: 100-159.
[10] 张意静. 食品分析技术[M]. 北京: 中国轻工业出版社, 2001: 186-194.
[11] BOUGATEF A, NEDJAR A N, MANNI L, et al. Purification and identification of novel antioxidant peptides from enzymatic hydrolysates of sardinelle(Sardinella aurita)by-product proteins[J]. Food Chemistry, 2010, 118(3): 559-565.
[12] OYAIZU M. Studies on products of browning reaction: antioxdative activities of products of browning reaction prepared from glucosamne[J]. Japanese Journal of Nutrition, 1986, 44: 307-315.
[13] 陈学勤. 抗氧化研究实验方法[M]. 北京: 中国医药科技出版社, 1996: 499-500.
[14] ADAMSON N J, REYNOLDS E C. Characterization of casein phosphor peptides prepared using Alcalase: determination of enzyme specificity[J]. Enzyme and Microbial Technology, 1996, 19(3): 202-207.
[15] 陈轩, 周坚, 李吉绪, 等. 分布酶解制备鲢鱼抗氧化肽的工艺研究[J]. 食品工业科技, 2012, 33(15): 181-186.
[16] 毛善勇, 周瑞宝, 仪凯, 等. Protamex水解牛肉的研究[J]. 郑州工程学院学报, 2004, 25(2): 61-63.
[17] 宋茹, 冯婷立, 谢超. 海产小杂鱼抗氧化肽制备工艺[J]. 食品科学, 2012, 32(12): 29-32.
[18] 范建凤, 王则南, 杨柯, 等. 蟹抗氧化肽的分离纯化及活性研究[J]. 食品科学, 2010, 31(13): 48-51.
[19] JE J Y, PARK P J, KIM S K. Antioxidant activity of a peptide isolated from Alaska pollack (Theragra chalcogramma) frame protein hydrolysate[J]. Food Research International, 2005, 38(1): 45-50.
[20] FAHMI A, MORIMURA S, GUO H C, et al. Production of angiotensin Ⅰ converting enzyme inhibitory peptides from sea bream scales[J]. Process Biochemistry, 2004, 39(10): 1195-1200.
[21] GIMENEZ B, ALEMON A, MONTERO P, et al. Antioxidant and functional properties of gelatin hydrolysates obtained from skin of sole and squid[J]. Food Chemistry, 2009, 114: 976-983.
