牦牛奶酪中乳酸菌的分离鉴定及发酵性能分析
2013-08-07杨吉霞陈芝兰杨海燕黄艾祥陈宗道贺稚非
杨吉霞,陈芝兰,杨海燕,黄艾祥,陈宗道,贺稚非,*
(1.西南大学食品科学学院,重庆 400715;2.重庆市农产品加工技术重点实验室,重庆 400715;3.西藏农牧学院科研处生物技术中心,西藏 林芝 860000;4.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052;5.云南农业大学食品科学与技术学院,云南 昆明 650201)
牦牛是一种能够在寒冷和缺氧的高原环境中生存的动物,中国大约有1300万头,占世界总数的90%以上[1],分布于青海、西藏、四川、甘肃、新疆和云南地区[2]。每头哺乳期牦牛产奶量为147~487kg[1],其营养成分比普通牛奶高,含有16.9%~17.7%固形物、4.9%~5.3%蛋白质、5.5%~7.2%脂肪、4.5%~5.0%乳糖、0.8%~0.9%矿物质,普通牛奶含有大约13.3%固形物、3.4%蛋白质、4.0%脂肪、4.8%乳糖、0.7%矿物质[1,3]。高原牧民将牦牛奶制作成奶酪,是一种重要的延长奶食用期限的方式,几千年来牧民很好地保持了用原料奶或者容器中的天然乳酸菌发酵的传统,一方面,不同地域的自然环境和气候、不同的原料奶以及不同的加工工艺,造成了不同奶酪中乳酸菌菌种构成的差异,可能存在菌种的多样性,另一方面,在长期生产实践中,奶酪中的乳酸菌可能积累了某些优良的发酵性能,如果能发掘出其中的优良乳酸菌,将有助于丰富工业发酵菌种,改变菌种同质化严重的现状。
本研究分别采用表型和基因型方法鉴定牦牛奶酪中的乳酸菌,以探讨乳酸菌的构成情况。一般来说,综合运用表型和基因型方法,是鉴定乳酸菌、获得全面的基础数据的最佳方式。乳酸菌对于奶酪质构和风味的形成起着关键的作用,可分为发酵菌和非发酵菌(non-starter lactic acid bacteria,NSLAB),发酵菌的主要作用是产酸,使酪蛋白凝固,非发酵菌产酸弱但耐酸能力强,在奶酪成熟过程中,产生酶(主要是蛋白酶)裂解蛋白质而影响奶酪的质构,或者与形成风味的前体物质有关[4],此外,乳酸菌产胞外多糖的活性也受到一些学者的关注,因为胞外多糖既可以作为酸奶发酵中的增稠剂,改变乳的流变特性,也有免疫调节等生理功能[5-6]。本研究对菌株的产酸活性、产蛋白酶、利用柠檬酸盐、产胞外多糖等发酵性能进行分析,以筛选有优良发酵性能的菌株。
1 材料与方法
1.1 材料与试剂
1.1.1 样品采集
奶酪样品采集自西藏、云南、新疆3个省区17户牧民家庭,西藏样品4个(rkz、yzy、nd、mls),云南样品5个(3-1、3-3、3-4、3-5、6-1),新疆样品8个(2#、4#、8#、9#、10#、22#、44#、77#)。将奶酪样品用无菌操作装入无菌采样袋中(NASCOB00679WA),冷藏运输到实验室。
1.1.2 试剂
乳酸菌表型鉴定所用的培养基和试剂参照文献[7-9]中的方法配制;石蕊牛奶培养基 美国BD公司;BBLTM、API®50CHL 生物梅里埃中国有限公司。分子生物学实验用的缓冲液和常备试剂按照文献[10]中的方法配制。Taq酶(5U/μL)、dNTPs(10mmol/L)、10×酶缓冲液、MgCl2(25mmol/L) New England Bio Labs公司;100bp DNA Ladder 美国Promega公司;琼脂糖、溶菌酶、蛋白酶K、EDTA-Na2、Tris-base、Guanidine Thiocyanate 美国Fisher Scientific公司;引物由生工生物工程(上海)股份有限公司合成。
1.1.3 标准菌株
Lactobacillus casei ATCC 393;Lactobacillus rhamnosus ATCC 7469和Lactobacillus plantarum ATCC 8014购自青岛绿谷商贸有限公司。
1.2 仪器与设备
S1000系列高性能PCR仪、164-5050电泳仪 美国Bio-Rad公司;Syngene Gene Genius凝胶成像系统 美国基因有限公司;Biospec-mini型DNA/RNA/蛋白质分析装置 岛津中国有限公司;HB031型金属恒温加热器 上海博彩生物科技有限公司;SIM-F140AY65型制冰机 日本三洋有限公司;1-15PK型台式离心机 德国Sigma公司。
1.3 方法
1.3.1 样品的pH值检测、菌落计数和分离纯化乳酸菌
取10g奶酪样品,用90mL 0.9%生理盐水(pH7.0)均质,测pH值,然后做10倍系列稀释,10-1、10-2、10-3、10-4共4个稀释度各取1mL,用平板涂布法接种于MRS培养基,37℃厌氧培养48h,测菌落总数,设3个重复。根据形态特征挑选菌落,用MRS培养基划线分离至纯菌株,将革兰氏染色阳性、过氧化氢酶阴性的菌株初步选为乳酸菌。将纯化后的菌株分别于-20℃和-80℃冷冻保藏。
1.3.2 乳酸菌菌种鉴定
1.3.2.1 表型鉴定
参照文献[8-9]的方法,做属的鉴定实验:产芽孢、运动性、硝酸盐还原反应、H2S产生、明胶液化、生成吲哚、精氨酸产氨、发酵葡萄糖产气;菌株在不同的NaCl质量浓度(4、6.5、8g/100mL)、不同pH值(3.9、4.5、9.6)、不同温度(10、15、45℃)条件下的生长特性;石蕊牛奶实验,并判断出菌属。
用API®50CHL检测菌株的碳水化合物发酵模式,根据API的判读结果,并参照文献[8-9]的标准判断菌种。
1.3.2.2 基因型鉴定
用16S rRNA序列分析法进一步验证菌种:用文献[11]所述异硫氰酸胍法提取乳酸菌基因组DNA,用引物27fF (5’-AGAGTTT GAT(C/T)(A/C)TGGCTCAG-3’)和S-G-Lab-0677-R(5’-CACCGCTACACATGGAG-3’)做PCR扩增[12],25μL反应体系为:2.5μL 10×酶缓冲液(无Mg2+),2.5μL(25mmol/L)MgCl2,0.5μL dNTPs,0.2μL(10μmol/L)引物,0.2μL Taq DNA酶,50ng模板DNA,加超纯水至25μL,反应程序为:94℃预变性3min;94℃、30s,55℃、30s,72℃、40s,30次循环;72℃延伸7min,目标产物约为700bp。产物送生工生物工程(上海)股份公司测序。将菌株序列输入GenBank数据库中做同源序列搜索,用MEGA 5软件包将待测菌株与模式菌株的序列以Clustal W进行比对,用UPGMA(unweighted pair-group method with arithmetic means)法进行1000次Bootstrap检验后构建系统发育树。一般来讲,在种分类等级上,如果2个分类单位间的16S rRNA序列同源性大于97.5%,则认为属于同一个种[13],对于同源性低于97.5%的菌株采用种特异性PCR验证,或结合表型鉴定方法判断菌种。
L.casei 种特异性PCR:用引物5’-TGCAC TGAGATTCGACTTAA-3’和Y2(5’-CCCACTGC TGCCTCCCGTAGGAGT-3’)进行PCR扩增[14],反应体系和反应程序如前所述,采用标准菌株Lactobacillus casei ATCC393和Lactobacillus rhamnosus ATCC7469;Lactobacillus plantarum ATCC8014分别作为阳性和阴性对照,目标片段长度约290bp。
1.3.3 乳酸菌发酵性能分析
1.3.3.1 菌株产酸活性
将活化后的菌株按体积分数1%接种到11g/100mL的脱脂牛奶中(110℃灭菌10min),初始pH值为6.6,37℃厌氧培养,分别于6h和24h取样测可滴定酸,用0.1mol/L NaOH滴定,酚酞作为指示剂,以乳酸的百分比表示结果[15]。
1.3.3.2 菌株利用柠檬酸盐的能力
根据Kempler等[16]的方法检测,能够利用柠檬酸盐的菌落是深蓝色的(普鲁氏蓝),不能利用柠檬酸盐的菌落保持白色。
1.3.3.3 菌株prt P基因
参照文献[1 7-1 8]用引物P 6(5’-C A A C A CGGCATGCATGTTGC-3’)和P7(5’-CTGGCGTTCCCACCA TTCA-3’)做PCR扩增,反应体系和反应程序如前所述,目标片断为393bp。该目标片断与菌株合成蛋白酶相关,故可用于产蛋白酶菌株的初步筛选。
1.3.3.4 菌株产胞外多糖的活性
配制钌红牛奶培养基[19]:0.5g/100mL酵母提取物、10g/100mL脱脂乳粉、1g/100mL蔗糖、1.5g/100mL琼脂、1g/100mL葡萄糖,110℃灭菌10min,待温度降至约50℃,用0.22μm滤膜过滤除菌加入钌红(终质量浓度0.08g/L),混匀后倒平板。将菌株用划线法接种,37℃培养72h,产胞外多糖的菌株不被钌红染色,仍为白色或乳白色菌落。对于筛选出的阳性菌株,参照文献[20-21]分离提取胞外多糖,用苯酚-硫酸法[22]测菌株胞外多糖产量,葡萄糖标准曲线为y=0.0067x-0.0149(R2=0.9958)。
2 结果与分析
2.1 样品的菌落计数、pH值和分离纯化的乳酸菌
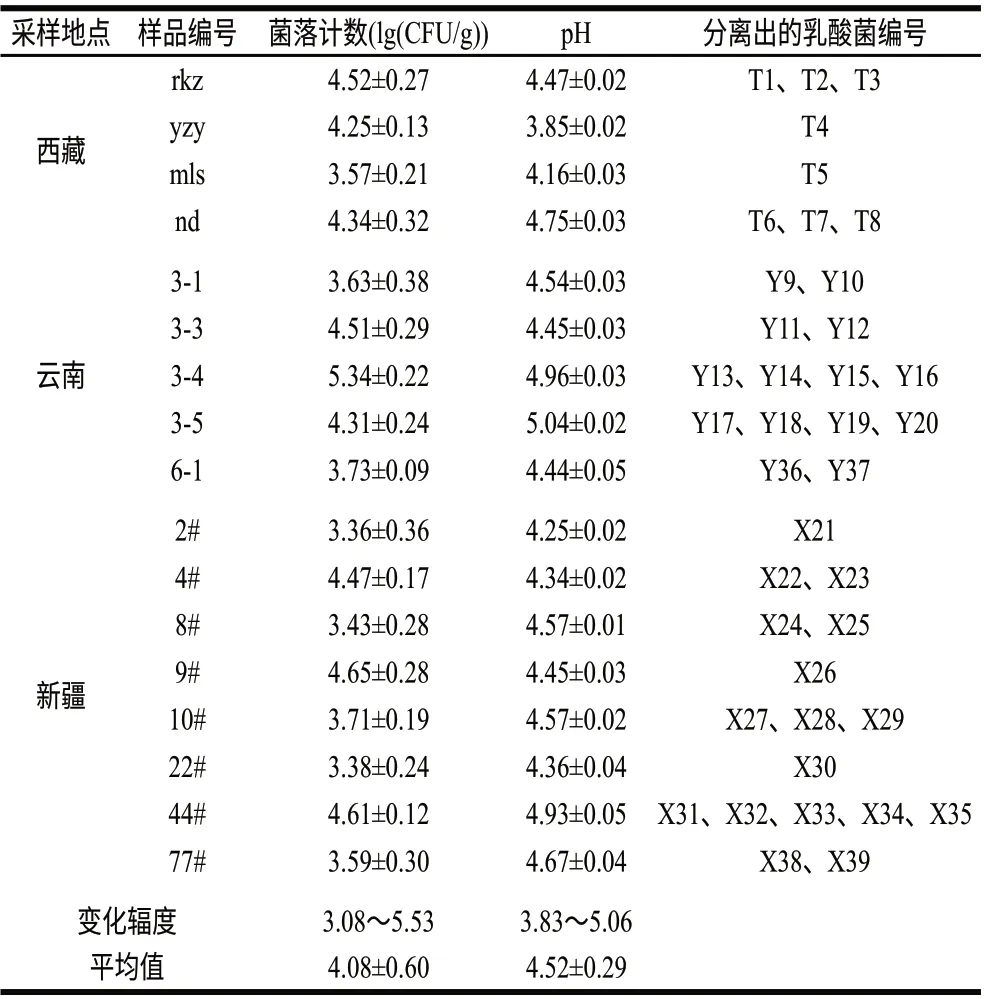
表 1 各地牦牛奶酪样品的pH值、菌落计数及分离纯化出的乳酸菌Table 1 pH and colony enumeration of yak milk cheese samples and isolated strains from each sample
如表1所示,西藏、云南、新疆3个地区菌落计数平均值分别为4.17±0.43、4.30±0.68、3.90±0.59(lg(CFU/g)),pH值平均值分别为4.31±0.39、4.69±0.29、4.52±0.22,地区之间不存在显著性差异(菌落计数P=0.468>0.05;pH值P=0.176>0.05)。与酸奶中乳酸菌的数量(6~8(lg(CFU/mL)))相比,奶酪中乳酸菌的数量较低,可能是因为在除去乳清、腌渍和成熟后,奶酪中的水分活度下降,而且奶酪有一定的含盐量,多数pH<5.0,这些因素都不利于乳酸菌的生长。
2.2 乳酸菌的鉴定
2.2.1 表型鉴定
39株乳酸菌主要的生理生化特性列于表2。其中有35株菌在显微镜下的形态为杆状,芽孢、运动性、硝酸盐还原、H2S实验(与丹毒丝菌属相区分)均为阴性;在pH4.5的环境中生长(与肉食杆菌属相区分),符合乳杆菌属的特征。4株菌(T5、Y11、Y14、Y17)在显微镜下的形态为成对或四联状球菌,芽孢、运动性、硝酸盐还原实验均为阴性,不产生H2S或吲哚、在6.5g/100mL NaCl或者pH4.5 MRS培养基中生长、在pH9.6中不生长,在45℃能生长、能水解精氨酸产氨、不能发酵葡萄糖产CO2,符合片球菌属的特征。从样品中分离出的球菌种类和数量很少,可能与奶酪的水分活度低,pH值较低,致使耐酸性差的球菌生长受到抑制,到发酵后期很难存活有关。
对于35株乳杆菌用API50CHL检测了碳水化合物发酵模式,参照文献[8-9]将主要的发酵模式归纳于表3中。经过API LAB Plus对结果的判读,35株乳杆菌被分为7个菌种:L. buchneri 2株、L. casei 16株、L. diolivorans 3株、L. fermentum 3株、L. helveticus 3株、L. kefiri 3株和L. plantarum 5株,结果见表2。
值得指出的是,所有35株乳杆菌在15℃都能生长,但是根据文献[8] L. fermentum和L. helveticus在15℃不生长,其原因可能是菌株经过长期适应高原地区相对低温气候环境,形成了这种在广泛温度范围内生长的特性,说明被分离菌株的适应能力增强。
2.2.2 分子生物学鉴定
39株菌用部分16S rRNA序列(V1~V3区)分析法鉴定菌种。35株乳杆菌的鉴定结果与表型鉴定结果是一致的,其中25株菌序列同源性≥99%,4株菌(T6、T7、Y10、Y13)为98%,6株菌低于97.5%:T15(97%)、Y18(96%)、Y19(95%)、X21(94%)、X26(97%)、X29(94%)。其中Y19、X21、X26和X29用种特异性PCR进一步验证为L. casei(图1)。
4株球菌也用部分16S rRNA序列分析法鉴定出菌种,序列同源性均高于97.5%。T5为P. acidilactici,Y11、Y14和Y17为P. pentosaceus。
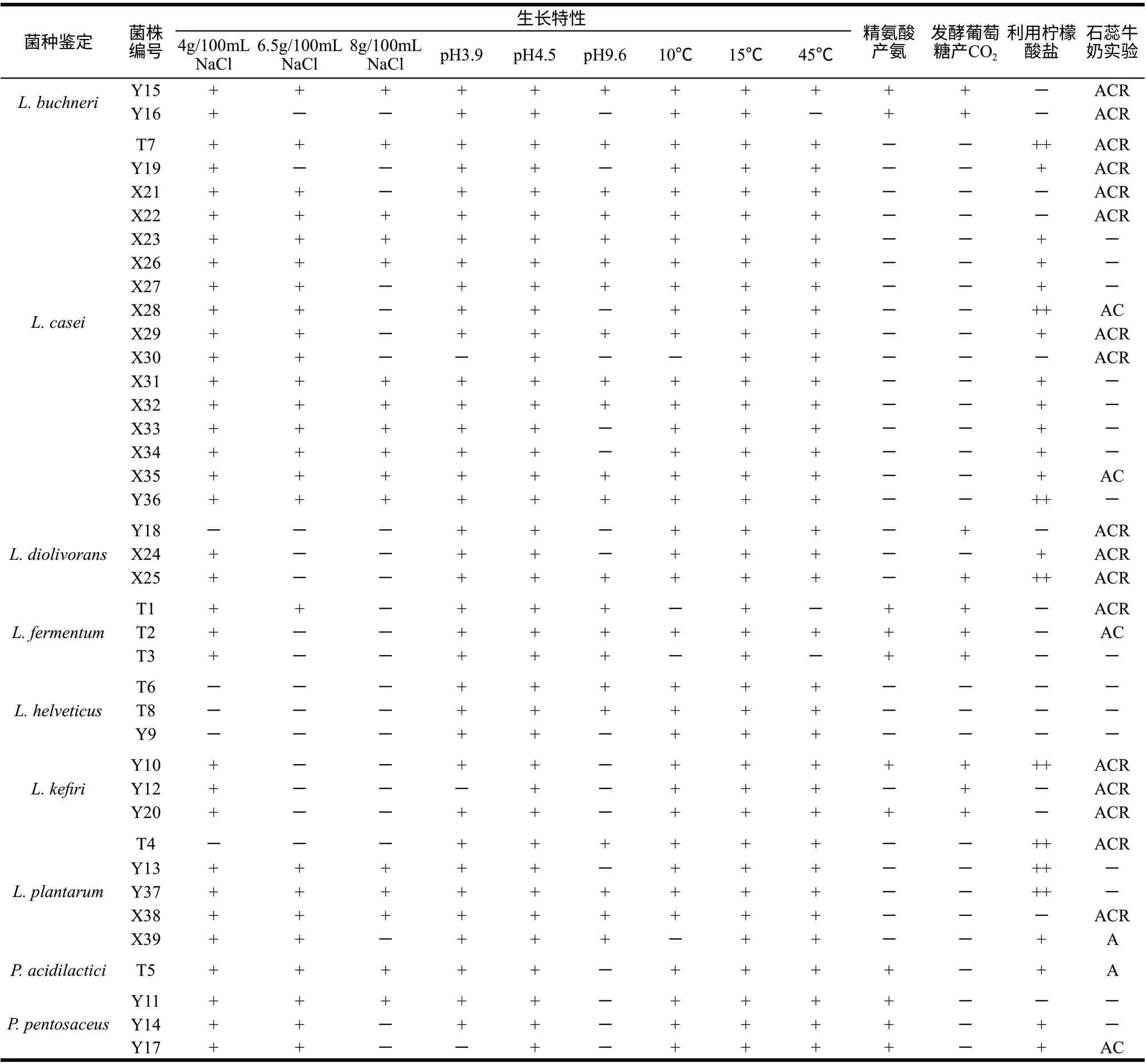
表 2 牦牛奶酪中乳酸菌的主要生理生化特性Table 2 Primary biochemical and physiological characteristics of isolated strains from yak milk cheeses
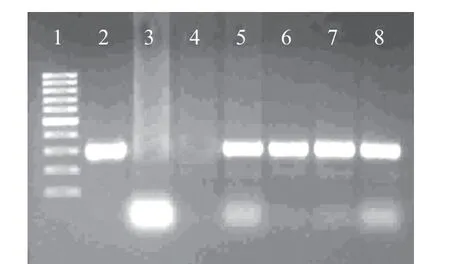
图 1 L.casei种特异性PCR鉴定结果Fig.1 Profi le of PCR amplicons with L. casei species specifi c primers
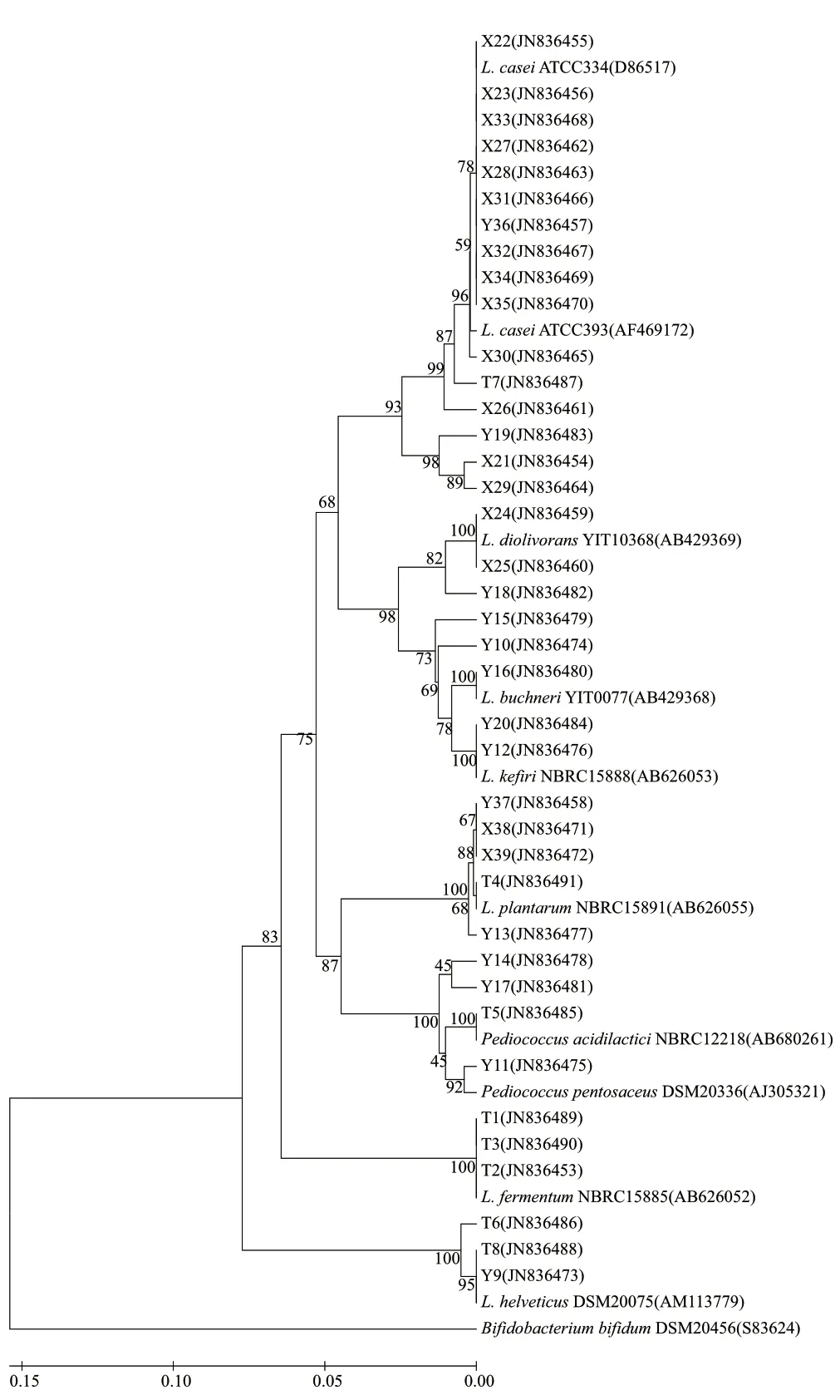
图 2 用乳酸菌16S rRNA序列构建的系统进化树Fig.2 Phylogenetic tree originated from partial 16S rRNA sequences of lactic acid bacteria isolates.
系统进化树(图2)显示了不同菌种之间清晰的分类关系。L. casei、L. plantarum、L. diolivorans、L. fermentum和L. helveticus的菌株完全按照菌种各自聚为一类,L. buchneri和L.kefi ri组的聚类稍有偏差,Y15和Y10没有归在相应的组里,球菌Y14、Y17也没有归在P. pentosaceus组内,可能是因为与模式菌株的序列同源性比较低。39株菌的序列数据都提交到GenBank,注册号为JN836453~JN836491。
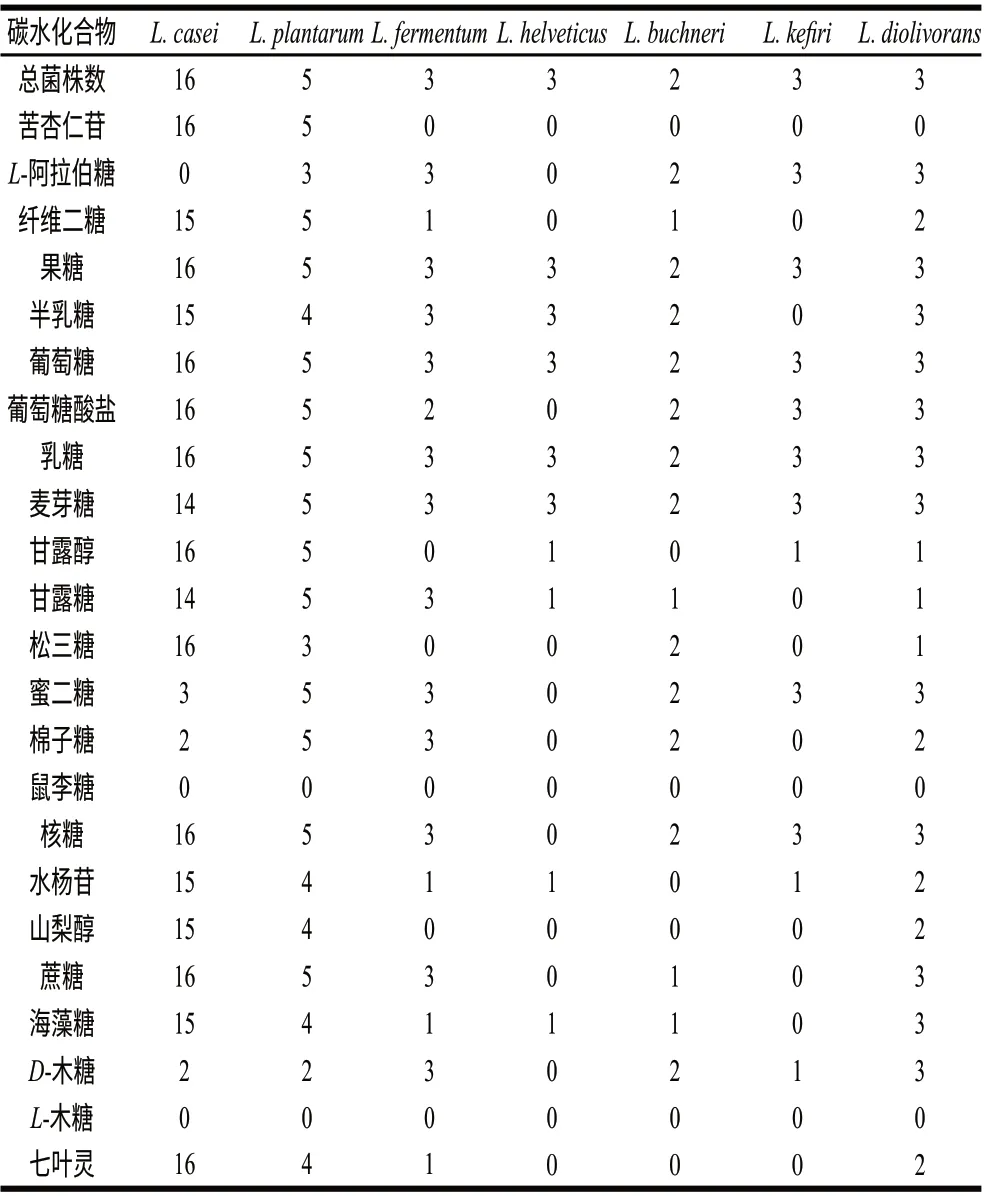
表 3 API 50CHL测出的牦牛奶酪中乳杆菌的碳水化合物发酵模式Table 3 Carbohydrate fermentation patterns of isolated lactobacilli by API 50CHL
2.2.3 乳酸菌菌株按地区的分布情况
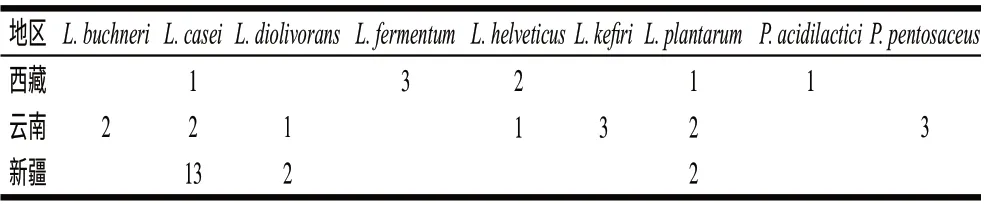
表 4 各地区乳酸菌菌株的分布情况Table 4 Regional distribution of identified lacticacid bacteria from yak milk cheeses
由表4可知,从云南地区样品分离出的乳酸菌中共鉴定出7个菌种,多样性最为丰富,其次为西藏地区样品(鉴定出5个菌种),从新疆样品中仅鉴定出3个菌种。新疆样品乳酸菌主要是L. casei为优势菌种。
2.3 乳酸菌的发酵性能
2.3.1 乳酸菌的产酸活性
通过测39株菌在11g/100mL脱脂牛奶中培养6h和24h时可滴定酸(图3)分析乳酸菌的产酸活性。培养6h时,可滴定酸的范围是0.24%~1.08%,培养24h时的范围是0.63%~2.19%,产酸活性最强的是X24(L. diolivorans)。国外文献[17]将6h可滴定酸值大于0.6%作为筛选产酸能力强的乳酸菌的标准,本实验中有8株菌满足这一条件:X24、X38、X29、X25、X21、X22、X30、X35。
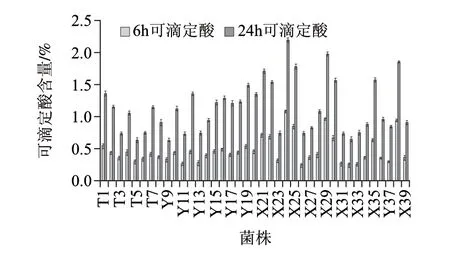
图 3 菌株在11g/100mL脱脂牛奶中培养6h和24h后的可滴定酸Fig.3 Titratable acidity of 11 g/100 mL non-fat dry milk after incubation with each isolate for 6 h and 24 h
一般来说,乳杆菌属大多属于非起酵菌种(non-starter lactic acid bacteria)(L. delbrueckii 和L. helveticus中的嗜热菌种除外),产酸活性不强[4]。在本实验中,有少数乳杆菌产酸活性达到了发酵菌种的水平,可能是由于在长期生产过程中积累而成的优良特性。
2.3.2 利用柠檬酸盐
乳酸菌发酵柠檬酸盐的活性与风味前体物质双乙酰的形成有关,因此可以影响奶酪的风味和香味[16]。39株菌中有23株能发酵柠檬酸盐(表2),其中T4、T7、Y10、Y13、X25、X28、Y36、Y37利用柠檬酸盐的能力比较强。
2.3.3 prt P基因筛选
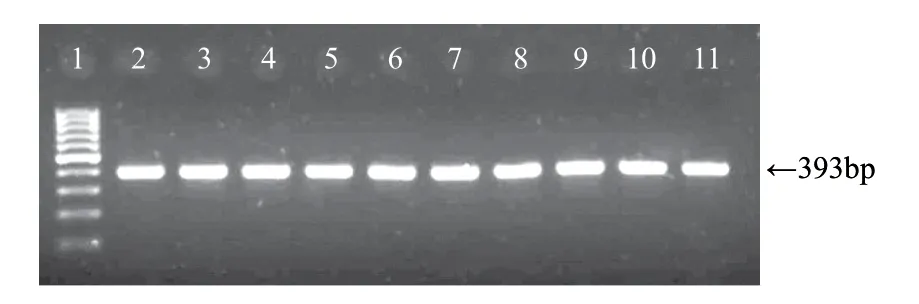
图 4 乳酸菌prt P基因扩增结果Fig.4 Prt P gene amplifi cation results obtained from LAB isolates
10株菌prt P基因扩增阳性(图4):T7、Y19、X21、X22、X23、X26、X28、X29、X30、X34,即这些菌株能产生蛋白水解酶。乳酸菌的蛋白酶用于降解酪蛋白和多肽,产生大量的自由氨基酸,从而影响奶酪的质构和风味[4,17]。
2.3.4 产胞外多糖
9株菌产胞外多糖(图5):T3、T4、T5、T7、T8、Y11、Y14、Y17、X29。胞外多糖产量如表5所示,产量最高的菌株是T8,为(193.00±1.75)mg/L。

图 5 钌红平板培养基筛选产胞外多糖的乳酸菌Fig.5 Colony on ruthenium red milk plates with or without exopolysaccharide-producing capability
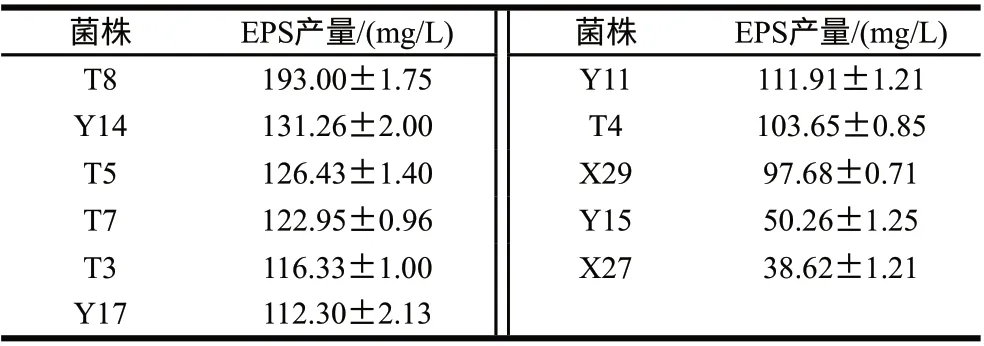
表 5 乳酸菌胞外多糖产量Table 5 Exopolysaccharide yield of selected lactic acid bacteria
3 结 论
3.1 本研究从西藏、云南、新疆采集了17份自然发酵的牦牛奶酪,用MRS培养基菌落计数平均值分别为4.17±0.43、4.30±0.68、3.90±0.59(lg(CFU/g)),pH值平均值分别为4.31±0.39、4.69±0.29、4.52±0.22,地区之间不存在显著性差异(菌落计数P=0.468>0.05;pH值P=0.176>0.05)。
3.2 从17份牦牛奶酪样品中,用表型和基因型相结合的方法鉴定出39株乳酸菌,其中乳杆菌35株,分别为L. buchneri 2株、L. casei 16株、L. diolivorans 3株、L. fermentum 3株、L. helveticus 3株、L. kefiri 3株和L. plantarum 5株,片球菌4株,分别为P. acidilactici 1株、P. pentosaceus 3株。乳杆菌占总菌株89.7%,为优势菌属。
3.3 从各地区的菌株分布情况来看,云南样品乳酸菌共有7个菌种,多样性最为丰富,其次为西藏样品乳酸菌(鉴定出5个菌种),新疆样品乳酸菌仅有3个菌种,主要是L. casei为优势菌种。
3.4 通过测菌株在11g/100mL脱脂牛奶中37℃培养6h和24h后的可滴定酸,筛选出8株菌X24、X38、X29、X25、X21、X22、X30、X35产酸活性较强,有可能作为发酵菌种。
3.5 菌株T7在柠檬酸盐利用、prt P基因扩增和产胞外多糖活性实验中结果均为阳性,有可能作为非发酵菌种,在奶酪成熟过程中对风味质地的形成产生影响。
[1] NIKKHAH A. Science of camel and yak milks: human nutrition and health perspectives[J]. Food and Nutrition Sciences, 2011, 2: 667-673.
[2] 黄敬蜂, 王秀珍. 我国牦牛分布及其气候生态适应性分析[J]. 家畜生态, 1990(3): 17-21.
[3] ZHANG Heping, XU Jie, WANG Junguo, et al. A survey on chemical and microbiological composition of kurut, naturally fermented yak milk from Qinghai in China[J]. Food Control, 2008, 19: 578-586.
[4] 贾宏信, 吴正钧, 刘振工, 等. 干酪内微生物及其功能的研究进展[J]. 食品与发酵工业, 2012, 38(2): 135-140.
[5] 李瑶喜, 牟光庆. 乳酸菌胞外多糖的生理功能及其在发酵乳中的应用[J]. 食品研究与开发, 2008, 29(5): 181-182.
[6] 王亚峰, 霍贵成. 乳酸菌胞外多糖的应用[J]. 食品工业科技, 2005, 26(5): 176-178.
[7] 杨洁彬, 郭兴华, 凌代文. 乳酸菌: 生物学基础及应用[M]. 北京: 中国轻工业出版社, 1991: 1-3.
[8] 凌代文. 乳酸菌分类鉴定及实验方法[M]. 北京: 中国轻工业出版社, 1999: 1-129.
[9] 东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001: 289-294.
[10] 萨姆布鲁克 J, 拉塞尔 D W. 分子克隆实验指南[M]. 2版. 黄培堂, 译. 北京: 科学出版社, 2002: 1564-1594.
[11] PITCHER D G, SAUNDERS N A, OWEN R J. Rapid extraction of bacterial genomic DNA with guanidium thiocyanate[J]. Letters in Applied Microbiology, 1989, 8: 151-156.
[12] HEILIG H G, ZOETENDAL E G, VAUGHAN E E, et al. Molecular diversity of Lactobacillus spp. and other lactic acid bacteria in the human intestine as determined by specific amplification of 16S ribosomal DNA[J]. Applied and Environmental Microbiology, 2011, 68(1): 114-123.
[13] 郭兴华, 曹郁生, 东秀珠. 益生乳酸细菌: 分子生物学及生物技术[M]. 北京: 科学出版社, 2008: 376-378.
[14] WARD L J H, TIMMINS M J. Differentiation of Lactobacillus casei, Lactobacillus paracasei and Lactobacillus rhamnosus by polymerase chain reaction[J]. Letters in Applied Microbiology, 1999, 29: 90-92.
[15] 中华人民共和国卫生部. GB 5413.34—2010 食品安全国家标准 乳和乳制品酸度的测定[S]. 北京: 中国标准出版社, 2010.
[16] KEMPLER G M, MCKAY L L. Improved medium for detection of citrate-fermenting Streptococcus lactis subsp. diacetylactis[J]. Applied and Environmental Microbiology, 1980, 39(4): 926-927.
[17] NANDA D K, TOMAR S K, SINGH R, et al. Phenotypic and genotypic characterization of lactobacilli isolated from camel cheese produced in India[J]. International Journal of Dairy Technology, 2011, 64(3): 437-443.
[18] KLIJN N, WEERKAMP A H, VOS W M. Detection and characterization of lactose-utilizing Lactococcus spp. in natural ecosystems[J]. Applied and Environmental Microbiology, 1995, 61(2): 788-792.
[19] STINGELE F, NEESER J R, MOLLET B. Identification and characterization of the eps (exopolysaccharide) gene cluster from Streptococcus thermophilus Sfi6[J]. Journal of Bacteriology, 1996, 178(6): 1680-1690.
[20] 刘先, 康小红, 孙军德. 高产胞外多糖乳酸菌的筛选与初步鉴定[J]. 农产品加工, 2010(3): 38-40.
[21] 王瑞琼, 张红星, 熊利霞, 等. 乳酸菌胞外多糖分离纯化方法研究进展[J]. 食品科学, 2008, 29(8): 700-703.
[22] 李平兰, 贺稚非. 食品微生物学实验原理与技术[M]. 北京: 中国农业出版社, 2005: 248-251.
