磁性纳米粒子快速分离纯化超氧化物歧化酶
2013-08-07孙术国
杨 林,孙术国,罗 章,*
(1.西藏农牧学院食品科学学院,西藏 林芝 860000;2.中南林业科技大学食品科学与工程学院,稻谷及副产物深加工国家工程实验室,湖南 长沙 410004)
1969年,美国科学家McCord等[1]从牛血红细胞中首次分离超氧化物歧化酶(superoxide dismutase,SOD),此后科学家对SOD研究作了大量的工作,研究发现SOD是一种以自由基为底物的酶,能快速有效清除过剩的超氧阴离子自由基,具有抗炎[2]、抗辐射[3]、抗肿瘤[4]、抗衰老[5]及提高机体自身免疫力[6]等功效,由于功能强大,使用广泛,因而备受科学家关注。
动物血液富含SOD,西藏牦牛作为高原最为活跃的动物,其血液SOD在克服高原反应,抗除疲劳方面发挥重要作用,然而牛血液成分复杂,给SOD分离和纯化增添困难。分离纯化SOD的研究已有不少报道,如张波等[7]采用沉淀、热变、再沉淀获SOD粗品,再经DEAESephadex A-50柱层析,得到比活力为2325U/mg SOD。Fattman等[8]采用琼脂糖层析来纯化鼠肺细胞外SOD粗酶液。王保全[9]以牛血为原料,采用过溶血、热变、丙酮沉淀、超滤浓缩等获得SOD粗品,再经Sephadex G-75凝胶过滤层析和DEAE-Sepharose Fast Flow离子交换层析纯化超滤后酶液,获得比活力大于3000U/mg SOD。这些研究都需采用层析法对粗酶液进一步纯化,层析法作为蛋白质分离纯化具有选择性高、分离效果佳等优点,但也具有对填料要求高、分离效率低、操作难度大等缺点。而磁性纳米粒子作为一种新型的蛋白质分离介质,具有快速、分离效率高、操作简单以及可重复使用等优点[10-12],本实验采用Fe3O4磁性纳米粒子从牦牛血液中分离纯化SOD,研究磁性纳米粒子对酶的吸附动力学以及影响SOD比活力和回收率的各种因素。
1 材料与方法
1.1 材料、试剂与仪器
牛血清超氧化物歧化酶(Cu/Zn-SOD)、牛血清白蛋白(BSA) 美国Sigma-Aldrich公司。
六水三氯化铁(分析级)、三水醋酸钠(分析纯)、乙二醇(分析纯)、戊二醛(体积分数25%)和聚乙烯亚胺(质量分数99%) 国药集团化学试剂有限公司;SOD试剂盒 上海工硕生物技术有限公司;其他试剂均为分析级。
JEM-1230透射电镜仪 日本JEOL公司;Nicolet 5700智能傅里叶红外光谱仪 美国Thermo Nicolet公司;DU700紫外-可见光分光光度计 美国贝克曼库尔特有限公司。
1.2 磁性纳米粒子的制备
称取0.025g FeCl3·6H2O和1.2g乙酸钠移入含有20mL乙二醇的烧杯中,室温下磁力搅拌30min,混合均匀后,再添加0.5g 聚乙烯亚胺(PEI),室温下搅拌30min至溶液均匀透明,将搅拌好的混合物溶液倒入25mL的高压反应釜中,密封,并将反应釜置于200℃电热鼓风干燥箱当中,反应12h,取出自然冷却至室温。将产物用双蒸水洗涤数两2次,再用无水乙醇洗涤2次,然后进行超声波处理,接着再用双蒸水洗涤1次,最终将纳米粒子分散于20mL双蒸水,装入玻璃瓶,室温保存,备用。
1.3 SOD粗酶液制备
制备SOD粗酶液参考王保全[9]改进传统工艺提纯SOD方法。获得的SOD粗酶液冷冻干燥制成酶粗品,置于4℃保藏,备用。
1.4 磁性纳米粒子分离纯化SOD过程
首先将一定量SOD酶粗品溶于结合液(0.05mol/L磷酸盐缓冲溶液,pH6.5,含有NaCl浓度为0.5mol/L),再将100mg的磁性纳米粒子分散于结合液中,在4℃条件下轻轻搅拌2h,然后磁性分离,接着将吸附酶的磁性纳米粒子分散在结合液(不含酶粗品)清洗两次,最终将吸附酶的磁性纳米粒子分散于20mL的解离液(0.05mol/L醋酸盐缓冲溶液,pH 4.0)中,在4℃条件下轻轻搅拌30min,磁性分离,此过程重复一次,两次获得的解离液汇集,透析浓缩后冷冻干燥,最终SOD样品置于4℃保藏。
为了研究结合液pH值对SOD的比活力和回收率影响,实验设计结合液pH值分别为4.5、5.5、6.5、7.5和8.5;为了研究不同离子强度对SOD的比活力和回收率影响,结合液中NaCl浓度分别为0、0.5、1.0、1.5、2.0mol/L;为了研究解离液pH值对SOD的比活力和回收率影响,将解离液pH值分别设定为4.0、4.5、5.0、5.5;为了研究吸附时间对SOD的比活力和回收率影响,吸附时间分别设定为0.5、1.0、1.5、2.0、2.5h。为了研究不同酶粗品蛋白初始浓度对SOD吸附效果的影响,实验设计酶粗品蛋白初始浓度分别为0.2、0.4、0.6、0.8、1.0、1.2、1.4mol/L。
1.5 磁性纳米粒子表征
采用透射电镜(TEM)观察磁性纳米粒子形貌。采用傅里叶红外光谱(FTIR)分析磁性纳米粒子吸附SOD前后红外光谱图的变化,扫描范围500~4000cm-1,分辨率为4cm-1。
1.6 SOD比活力和回收率分析
SOD在每分钟内转化1μmol底物所需的酶量为一个活力单位(U)。酶活力计算见式(1)。总蛋白含量根据考马斯亮蓝G-250法测定[13],以牛血清白蛋白为标准蛋白质。
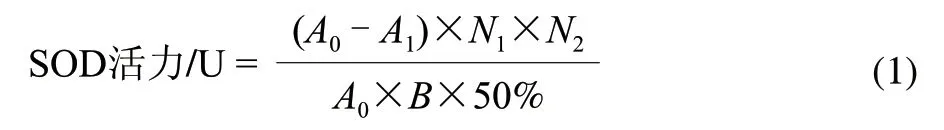
式中:A0为参照液吸光度;A1为样品吸光度;N1为反应体系的稀释倍数;N2样品测试前的稀释倍数;B为蛋白质含量。
SOD比活力为SOD活力与分离纯化后酶的质量比值。
回收率为磁性纳米粒子分离后总蛋白占酶粗品总蛋白的百分数。
1.7 SDS-PAGE分析
将12%聚丙烯酰胺凝胶用于SDS-PAGE测定 SOD 的纯度。所用的分析条件为:5%浓缩胶,10%分离胶,浓缩胶电泳电压80V,分离胶电压 120V,电泳样品用考马斯亮蓝G-250染色后再按照标准程序褪色[14]。
1.8 数据统计
上述所有实验重复3次,取平均值,实验采用SPSS统计软件对数据进行分析。
2 结果与分析
2.1 磁性纳米粒子外貌、粒径及表面化学性质分析
2.1.1 磁性纳米粒子外貌和粒径

图 1 表面包埋聚乙烯亚胺的磁性纳米粒子的透射电镜图Fig.1 Transmission electron micrograph of magnetic nanoparticles with surface-coated ethylene imine polymer
采用TEM表征磁性纳米粒子,结果如图1所示,用于酶分离纯化的磁性纳米粒子颗粒分散均匀,粒径约为(35±5)nm,这些说明磁性纳米粒子分散性好,稳定性较佳。而SOD分子粒径在2~4nm,磁性纳米粒子表面可以同时吸附较多数量的SOD,同时也不会因为纳米粒子粒径太大,球表面曲率过高造成对蛋白吸附产生空间位阻,进而降低对蛋白的吸附。
2.1.2 磁性纳米粒子表面化学性质分析
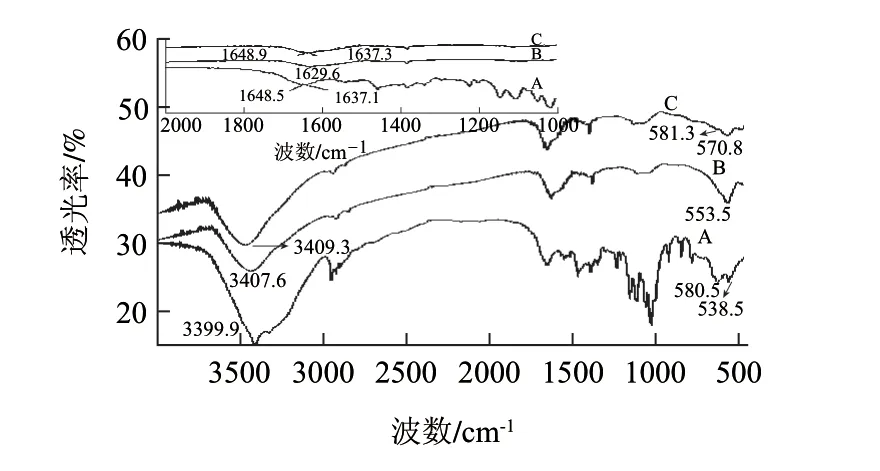
图 2 磁性纳米粒子吸附蛋白前(B)后(C)及纯SOD(A)的红外光谱分析Fig.2 FTIR spectra of pure SOD (A), Fe3O4 magnetic nanoparticles (B) and magnetic nanoparticles with SOD (C)
FTIR可以用于分析磁性纳米粒子表面活性基团,同时也能分析纳米粒子吸附蛋白前后红外光谱特征所发生的变化。结果如图2所示,红外光谱扫描图(A)在1637.1cm-1和1648.5cm-1处出现最大吸收峰,为SOD蛋白质酰胺Ι带的红外特征吸峰[15];红外光谱扫描图(B)在553.5cm-1的红外特征吸峰为Fe—O的振动,在3407.6cm-1有最大吸收峰,说明磁性纳米粒子表面富含NH2基团(来自于聚乙烯亚胺),这赋予了纳米粒子表面可带大量的正电荷。红外光谱扫描图(C)在570.8cm-1的红外特征吸峰为Fe—O的振动,在1637.3cm-1和1648.9cm-1处出现最大吸收峰,这是蛋白质酰胺Ι带的红外特征吸峰[15],说明纳米粒子已经吸附SOD,同时也证明了SOD吸附到纳米粒子表面过程,酶分子的二级结构发生了变化。
2.2 结合液pH值对SOD比活力和回收率的影响
在磁性纳米粒子吸附纯SOD实验当中,通过表面化学分析证实SOD已经吸附到磁性纳米粒子表面(2.1.2节)。现将磁性纳米粒子分散在不同pH值的结合液(含适量的酶粗品)中,研究结合液pH值对SOD比活力和回收率的影响。结果如图3A所示,结果表明:随着pH值增大,磁性分离获得的SOD比活力先增加,后急剧降低,而获得的酶回收率在pH4.5~8.5始终呈增大趋势。由于SOD在pH5.5~8.5稳定性较好,磁性纳米分离也是一种非常温和的分离纯化方式,因此,此分离纯化过程对SOD酶活力损失较低。在pH8.5处,SOD比活力迅速降低和回收率增高,说明总蛋白的量增加,但SOD在总蛋白中占的比例下降,即获得的SOD纯度在pH4.5~7.5一直呈上升趋势,在pH8.5则急剧下降,因此造成比活力也急剧降低。可能的原因在于牛的SOD的等电点(pI)在5.5左右,当pH值在6.0~7.5时,SOD表面带负电荷,且负电荷的数量随pH值的增大而增加,而磁性纳米粒子表面带有大量的正电荷,因此,电荷之间相互作用促进磁性纳米粒子对SOD的吸附,同时也对牛血清白蛋白排斥(或者说不吸附)。但pH>8.0时,由于杂蛋白也带负电荷,致使纳米粒子对杂蛋白的吸附,因而SOD纯度降低,同时比活力降低,因此最佳结合液pH值为7.5。
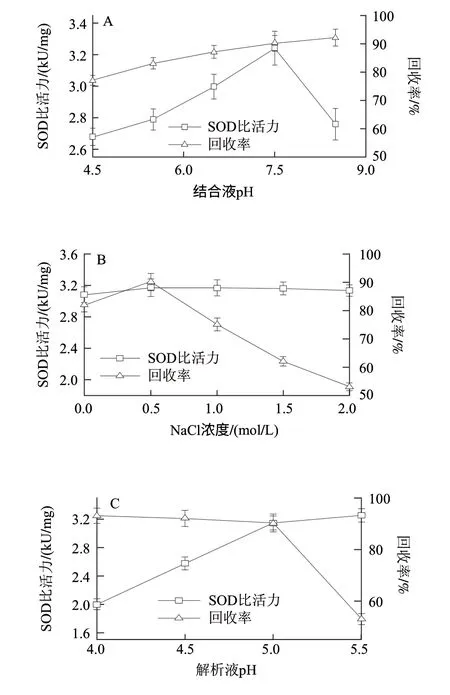
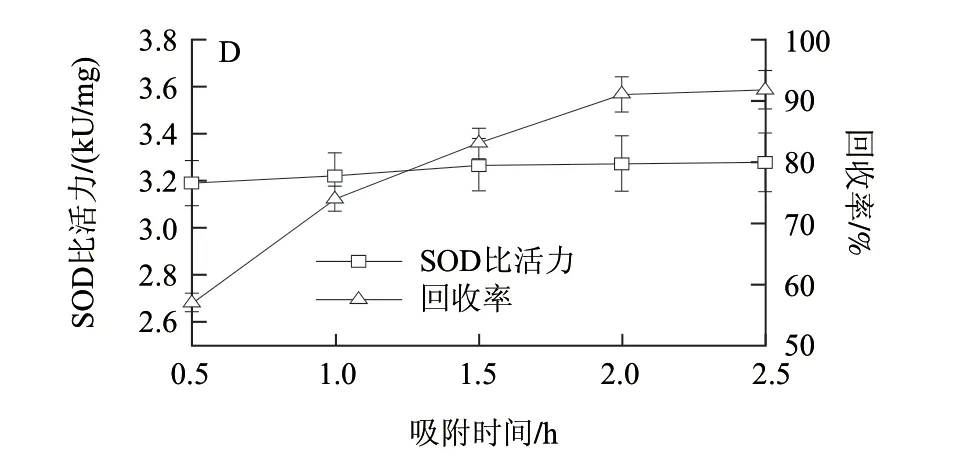
图 3 磷酸盐缓冲溶液pH值(A)和NaCl浓度(B)、解析液pH值(C)以及吸附时间(D)对SOD比活力和回收率的影响Fig.3 The effects of pH of binding buffer (A), pH of dissociation buffer (C), NaCl concentration (B) and adsorption time (D) on the specifi c activity and recovery of SOD
2.3 NaCl浓度对SOD比活力和回收率的影响
对于蛋白质分离纯化,其分离体系中离子强度也是重要的影响因子。不同NaCl浓度对SOD比活力和回收率的影响结果如图3B所示,结果表明随离子强度的增加,SOD比活力变化不明显,而SOD回收率先增加,然后迅速降低。可能原因在于低离子强度促进一些蛋白的分散,有利于蛋白向磁性纳米粒子靠近,但溶液体系离子强度过高,易导致纳米粒子表面电荷和蛋白分子表面电荷产生屏蔽作用,因而阻止了纳米粒子对蛋白分子的吸附[16],造成SOD回收率降低,上述结果表明最佳NaCl浓度为0.5mol/L。
2.4 解离液pH值对SOD比活力和回收率的影响
将SOD从磁性纳米粒子表面解离,一方面可以回收高比活力的SOD,另外可以重复使用磁性纳米粒子,但解离液pH值不同,获得的SOD比活力和回收率也各异,解离液pH值对SOD比活力和回收率影响如图3C所示,结果表明,在pH4.0~5.5,SOD比活力随pH值的增加而增大,而回收率随pH值的增加而降低。可能原因在于当pH值为4.0,由于SOD带正电荷,同种电荷相互排斥,促进SOD从磁性纳米粒子解离下来,而pH值增加,SOD表面正电荷减少,因此,这种排斥降低,致使少量的SOD仍然保留在磁性纳米粒子表面,因此回收率降低。同时,由于较低pH值易造成Zn2+从酶上脱落,SOD酶活性受到损失[17],因此,在较低pH值解离,SOD比活力降低,综合考虑SOD比活力和回收率,最佳的解离液pH值为5.0。
2.5 吸附时间对SOD比活力和回收率的影响
磁性纳米粒子吸附溶液中蛋白质是一个动态过程,从磁性纳米粒子表面第一个吸附位点被蛋白占据到全部吸附位点被蛋白占据,需要一段时间,这段时间由磁性纳米粒子与蛋白的相互作用力、磁性纳米粒子分散密度、蛋白的浓度以及机械搅拌等因素决定,本实验在上述因素都确定的情况下,研究吸附时间对SOD比活力和回收率的影响,结果如图3D所示,结果表明:随吸附时间的延长,SOD比活力变化不明显,但其回收率呈上升趋势,这说明磁性纳米粒子对SOD吸附不断增加,对杂蛋白的吸附很低甚至不吸附,因而最佳的吸附时间为2h。
2.6 磁性纳米粒子对SOD吸附动力学研究
载体对目标蛋白的吸附作用可以采用吸附等温线表征,而且,通过掌握等温线相关参数,可以建立数学模型用于预测载体对目标蛋白的吸附规律。Langmuir吸附模型目前广泛用于分离纯化生物大分子过程[18-19],其表达式如下:

等式(2)和(3)中q和C分别是蛋白的载荷/(mg/g)和水溶中蛋白的质量浓度/(mg/mL),Kd是解离常/(mg/mL),qm是最大载荷/(mg/g)。
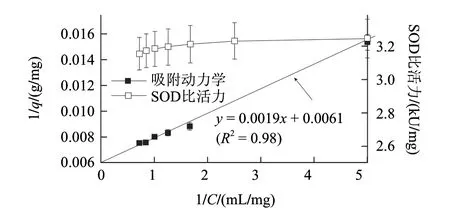
图 4 酶粗品质量浓度对SOD吸附效果的影响Fig.4 Effect of initial concentration of crude enzyme extract on SOD adsorption
如图4所示,结果表明磁性纳米粒子对SOD吸附很好的拟合Langmuir吸附模型(R2=0.98),获得磁性纳米粒子对SOD最大的载荷为166.7mg/g,解离常数Kd为0.32mg/mL,高于Ma Zhiya等[20]报道的亲和作用解离常数(Kd=0.14mg/mL),说明这种依靠电荷之间的相互作用力低于亲和作用相互作用力,同时随酶粗品蛋白质量浓度的增加,分离纯化的SOD比活力变化不明显,说明磁性纳米粒子对酶粗品中蛋白的吸附主要是针对SOD的吸附,因此上述建立的数学模型本质上是预测磁性纳米粒子对SOD吸附作用。
2.7 SOD纯度分析
为了进一步检验分离纯化的SOD纯度,并且对纯化过程进行监控,实验采用SDS-PAGE对各阶段的样品进行分析,结果如图5所示,泳道A是采用溶菌酶作为标品,泳道B是粗酶液样品的电泳结果,结果表明粗酶液样品的杂蛋白主要是牛血清白蛋白,分子质量为66.43kD,采用磁性纳米粒子分离纯化的SOD,其电泳结果在C泳道,结果显示泳道呈单一条带,由于牦牛SOD为Cu/Zn-SOD,其分子质量为32kD左右,为二聚体分子,在SDS-PAGE电泳过程中分离成单体,因此在16kD左右出现单条带[21],此结果证明获得的SOD纯度较高。
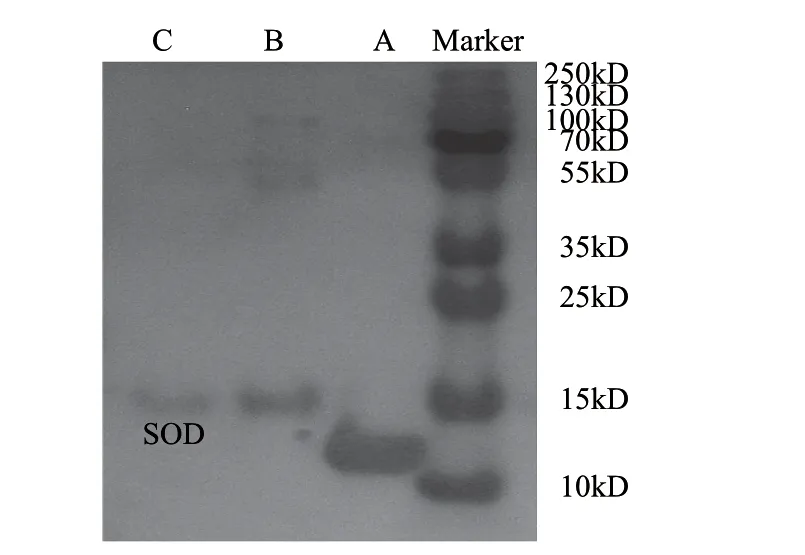
图 5 磁性纳米粒子吸附分离SOD的电泳表征 Fig.5 Separation of SOD from crude enzyme extract using magnetic nanoparticles
3 结 论
采用溶剂热法制备Fe3O4磁性纳米粒子,表面经聚乙烯亚胺包埋,磁性纳米粒子对SOD的吸附作用可以通过红外光谱法证实。利用磁性纳米粒子从粗酶液中直接分离纯化SOD,结果表明磁性纳米粒子对SOD的载荷和获得的SOD纯度受到粗酶液pH值、离子强度、解离液pH值等因素的影响,其中最佳的分离条件为结合液pH7.5、NaCl浓度0.5mol/L,解离液pH5.0和吸附时间2h,最大SOD比活力为3252U/mg,最大回收率可达到91.23%。结果也显示,磁性纳米粒子对不同浓度的SOD吸附拟合Langmuir吸附模型,SOD最大的载荷为166.7mg/g,解离常数Kd为0.32mg/mL,采用该数学模型,可以较好的预测磁性纳米粒子对SOD吸附作用规律。本实验建立的方法为快速分离纯化蛋白质提供一定得借鉴。
[1] McCORD J M, FRIDOVICH I. Superoxide dismutase. An enzymic function for erythrocuprein (hemocuprein)[J]. Journal of Biological Chemistry, 1969, 244(22): 6049-6055.
[2] LOENDERS B, van MECHELEN E, NICOLAÏ S, et a1. Localization of extracellular superoxide dismutase in rat lung neutrophils and macrophages as carriers of the enzyme[J]. Free Radical Biology and Medicine, 1998, 24: 1097-1106.
[3] ABE M, NISHIDAI T, YUKAWA Y, et a1. Studies on the radioprotective effects of superoxide dismutase in mice[J]. International Journal of Radiation Oncology Biology Physics, 1991, 7: 205-209.
[4] 毕武平. 超氧化物歧化酶及其与癌症的关系[J]. 中国生化药物杂志, 1991, 57(3): 1-5.
[5] 陈来同. 生化工艺学[M]. 北京: 科学出版社, 2004.
[6] 谢继青, 李玉华, 杨春梅, 等. 超氧化物歧化酶的药理作用[J]. 中国生化药物杂志, 2009, 30(2): 72-76.
[7] 张波, 庞第, 王全林. 牛血中SOD的提取技术研究[J]. 宁夏大学学报, 2002, 23(1): 69-70.
[8] FATTMAN C L, ENGHILD J J, CRAPO J D, et al. Purification and characterization of extracellular superoxide dismutase in mouse lung[J]. Biochemical& Biophysical Research. Communications, 2000, 75(2): 542-548.
[9] 王保全. 血液超氧化物歧化酶提纯工艺改进及其抗氧化活性研究[D]. 开封: 河南大学, 2010.
[10] SHAMIM N, HONG L, HIDAJAT K, et al. Thermosensitive-polymercoated magnetic nanoparticles: adsorption and desorption of bovine serum albumin[J]. Journal of Colloid and Interface Science, 2006, 304(1): 1-8.
[11] JANG J H, LIM H B. Characterization and analytical application of surface modified magnetic nanoparticles[J]. Microchemical Journal, 2010, 94(2): 148-158.
[12] NATA I F, EI-SAFORY N S, LEE C. Carbonaceous materials passivation on amine functionalized magnetic nanoparticles and its application for metal affi nity isolation of recombinant protein[J]. ACS Applied Materials & Interfaces, 2011, 3(9): 3342-3349.
[13] 王丽英, 马美湖, 蔡朝霞. 等. 离子交换色谱法分离纯化鸡卵黄免疫球蛋白[J]. 色谱, 2012, 30(1): 80-85.
[14] 郭尧军. 蛋白质电泳技术[M]. 北京: 科学出版社, 1999: 8-9.
[15] BYLER D M, SUSI H. Examination of the secondary structure of proteins by deconvolved FTIR spectra[J]. Biopolymers, 1986, 25(3): 469-487.
[16] CHIANG C L, SUNG C S, WU T F, et a1. Application of superparamagnetic nanoparticles in purifi cation of plasmid DNA from bacterial cells[J]. Journal of Chromatography B, 2005, 822: 54-60.
[17] RIGO A, VIGLINO P, CALABRESE L, et a1. Thbinding of copper free bovine superoxide dismatase: copper distriburtion in protein samples recombined with less than stoicheiometric, copper ion/protein ratios[J]. Biochemical Journal, 1977, 161: 27-30.
[18] SHENTU J L, WU J M, SONG W H, et a1. Chitosan microspheres as immobilized dye affi nity support for catalase adsorption[J]. International Journal of Biological Macromolecules, 2005, 37 (12): 42-46.
[19] VIDAL C V, JUAN A O, MUNOZ I. Adsorption of bovine serum albumin on CoCrMo surface:effect of temperature and protein concentration[J]. Colloids and Surfaces B: Biointerfaces, 2010, 80(1): 1-11.
[20] MA Zhiya, GUAN Yueping, LIU Huizhou. Superparamagnetic silica nanoparticles with immobilized metal affinity ligands for protein adsorption[J]. Journal of Magnetism and Magnetic Materials, 2006, 301: 469-477.
[21] 黄维华, 袁勤生. SOD的分子结构与性质[J]. 工业生化杂志, 1995(1): 26-32.
