发酵芝麻粕中芝麻小肽的分离纯化及其体外抗氧化活性
2013-08-07彭惠惠李吕木许发芝丁小玲
彭惠惠,李吕木,,,*,钱 坤,许发芝,吴 东,周 芬,丁小玲
(1.安徽农业大学茶与食品科技学院,安徽 合肥 230036;2.安徽农业大学动物科技学院,安徽 合肥 230036;3.安徽省畜牧生物工程技术研究中心,安徽 合肥 230031)
芝麻属胡麻科胡麻属,在亚洲广泛种植,榨油后的副产物麻渣或饼粕中蛋白质质量分数为38%~50%,芝麻蛋白中氨基酸含量丰富。大量研究证实蛋白质在生物体内并不是全部以单个氨基酸形式被吸收,部分是以小肽的形式被吸收,且小肽被吸收的效果要比氨基酸好[1],同时小肽还具有特殊的生物活性功能如抑制血压升高[2]、抗疲劳[3]、增强免疫功能[4]及降低胆固醇[5]等作用,而这些作用均与其抗氧化性质有关。芝麻蛋白经蛋白酶水解后,酶解物具有体外抗氧化活性,在质量浓度为1mg/mL时,对·OH、超氧阴离子自由基都有明显的清除作用[6]。在微生物固态发酵芝麻粕以提高其饲用品质的过程中也产生了一定量的小肽[7],但这种小肽是否也具有很好的抗氧化活性,尚未见文献报道。为此,本实验选取枯草芽孢杆菌和乳酸菌混菌发酵的芝麻粕为原料,研究其发酵过程中产生的小肽的抗氧化能力,为芝麻小肽在食品、饲料等领域内的应用提供依据。
1 材料与方法
1.1 材料、试剂与仪器
发酵芝麻粕:枯草芽孢杆菌和乳酸菌混菌接种比例1:1,菌种由安徽农业大学饲料科技研究所提供,接种量8%,30℃固态厌氧发酵14d,小肽含量7.13%。
蓝色葡聚糖-2000、L-酪氨酸、还原型谷胱甘肽、氧化型谷胱甘肽 北京索莱宝科技有限公司;Sephadex G-15 北京瑞达恒辉科技发展有限公司;1,1-二苯基-2-三硝基苯肼(DPPH) 上海源叶生物技术有限公司。
752紫外-可见分光光度计 上海浦东物理光学仪器厂;DHL-A电脑恒流泵、HD-21-1核酸蛋白检测仪、SBS-100自动液相色谱层析仪 上海青浦沪西仪器厂;层析柱(2.6cm×60cm) 上海锦华层析设备厂;多功能有机膜实验设备 合肥世杰膜工程有限责任公司。
1.2 方法
1.2.1 芝麻小肽粗提
称10g发酵芝麻粕加100mL纯水150r/min浸提30min,溶液过0.45μm滤膜后,用1000D纳滤膜过滤,取分子质量小于1000D部分浓缩待测。
1.2.2 芝麻小肽分离纯化
采用Sephadex G-15凝胶层析柱对芝麻小肽粗体液进行分离纯化。用pH7.0双蒸水洗脱,样品质量浓度为70mg/mL,上样量为lmL,流速为0.5mL/min,检测波长为280nm。
1.2.3 标准曲线绘制
凝胶层析组分小肽分子质量测定用蓝色葡聚糖-2000测定外体积V0,用铬酸钾测总体积Vt。分别用L-酪氨酸(M=181.19)、还原型谷胱甘肽(M=307.32)、氧化型谷胱甘肽(M=612.6)上柱,层析柱(2.6cm×60cm),洗脱液为双蒸水,上样量为lmL,洗脱流速0.5mL/min,检测波长280nm,得出标准蛋白的洗脱体积Ve。计算得到系数Kav=(Ve-V0)/(Vt-V0)。以标准蛋白质的分子质量的对数(lgM)为横坐标,系数Kav为纵坐标,作标准曲线。用芝麻小肽粗提液代替标准蛋白,按照标准曲线的制作方法操作,得出洗脱体积,重复测定1~2次,取洗脱体积的平均值。从标准曲线的方程算出样品的分子质量。
1.2.4 小肽含量测定
采用Lowry-福林酚法[8],重复测定2次。
1.2.5 DPPH自由基清除作用的测定[9]
准确称取20mg DPPH用无水乙醇定容于250mL容量瓶中,得到浓度为2×10-4mol/L的DPPH溶液。利用DPPH溶液的特征紫红色团波长517nm的吸收峰,测定加入样品后A517nm吸收的下降表示其对有机自由基的清除能力。
取2mL不同质量浓度的样品液,加入2mL 2×10-4mol/L (0.1mmol/L)的DPPH无水乙醇溶液,混匀,室温避光反应30min后测定波长517nm处的吸光度Ai,同时测定2mL DPPH+2mL乙醇的吸光度A0和2mL样品液+ 2mL乙醇混合后的吸光度Aj。重复测定2次。计算DPPH自由基的清除率。
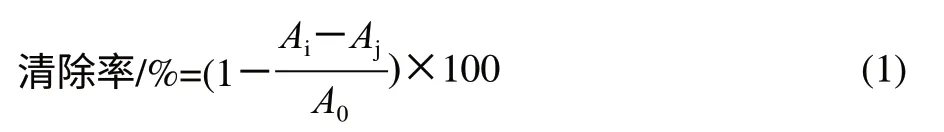
1.2.6 ·OH清除作用的测定[10]
在10mL试管中依次加入6mmol/L硫酸亚铁溶液 2.0mL,不同质量浓度的小肽溶液2.0mL,6mmol/L双氧水溶液2.0mL,摇匀后静置10min,再加入6mmol/L水杨酸溶液2.0mL,摇匀后静置30min后于波长510nm处测定其吸光度。重复测定2次。
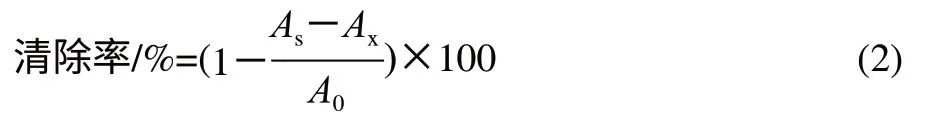
式中:A0为不加样品液的本底吸光度;As为加入样品溶液反应后的吸光度;Ax为不加水杨酸溶液酶解液的吸光度。
1.2.7 还原力测定[11]
具塞试管中依次加入0.5mL小肽溶液、2.5mL 0.2mol/L PBS磷酸缓冲液(pH6.6)、2.5mL 1.0% K3(Fe(CN)6),迅速混匀,50℃水浴中反应20min,冰水冷却并加2.5mL 10%三氯乙酸(TCA),混匀后以3000r/min离心10min。取2.5mL上清液,加2.5mL双蒸水和0.5mL 0.1%三氯化铁,混匀,测定各样品在700nm波长处的吸光度。用蒸馏水作为无还原能力对照。重复测定2次。
1.3 数据统计
2 结果与分析
2.1 标准曲线的绘制
用蓝色葡聚糖-2000测定外体积V0=41.8mL,用铬酸钾测总体积Vt=76.1mL,L-酪氨酸(M=181.19)、还原型谷胱甘肽(M=307.32)、氧化型谷胱甘肽(M=612.6)的洗脱体积分别为91.65、67.20、44.51mL。拟合得到回归方程:y =-0.3841x + 2.802,回归方程的相关系数为0.9904,说明lgM与Kav线性相关。
2.2 Sephadex G-15检测芝麻小肽的相对分子质量分布
芝麻小肽粗提液经过Sephadex G-15凝胶色谱柱分离,得到了3个峰,如图1所示,各个峰的洗脱体积分别是41.69、57.13、73.07mL,代入标准曲线拟合的方程,得到酶解物中3个组分的分子质量分布为:636、426、282D,即芝麻小肽粗体液分离得到的3个组分为六肽、四肽、三肽。经凝胶柱分离小肽回收率达到60.2%,将收集的3个组分的洗脱液进行冷冻存放,待进一步分析。
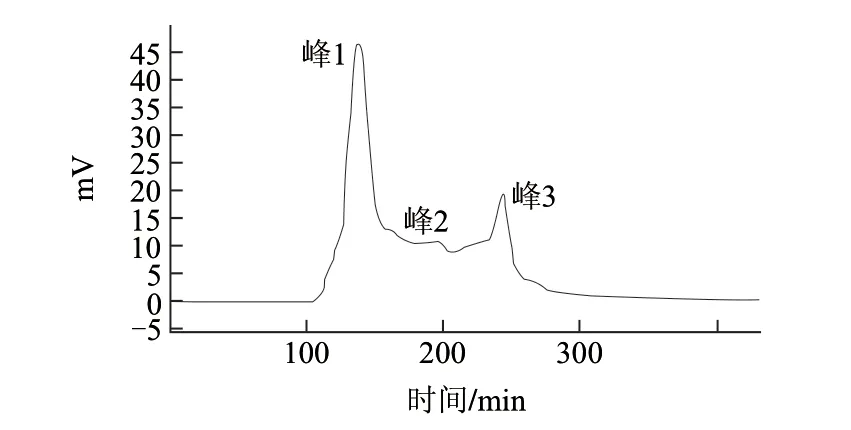
图 1 芝麻小肽Sephadex G-15柱层析洗脱图谱Fig.1 Elution profi le of sesame peptide on Sephadex G-15
2.3 芝麻小肽对DPPH自由基的清除作用
DPPH自由基清除能力可以很好表达对于油溶性自由基的清除能力。DPPH自由基是一种很稳定的以氮为中心的自由基,若小肽能清除它,则小肽具有打断脂质过氧化链反应的作用[12]。由图2可知,在高质量浓度(mg/mL)条件下小肽粗提液的DPPH自由基清除率高于2,6-二叔丁基- 4-甲基苯酚(BHT),经SAS软件分析知,差异极显著(P<0.01);但在低质量浓度(0.1mg/mL)条件下,小肽粗提液的DPPH自由基清除率与BHT差异不显著。表明芝麻小肽可以作为高效抗氧化剂。
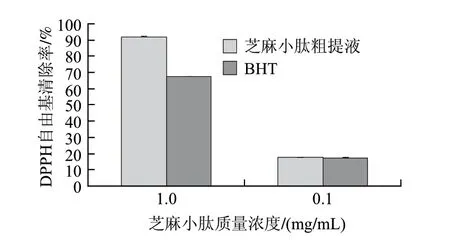
图 2 芝麻小肽粗提液与BHT清除DPPH自由基能力的比较Fig.2 Scavenging capacity of sesame peptide and BHT on DPPH free radicals
由图3可知,芝麻小肽粗提液及分离得到的各肽组分均具有清除DPPH自由基的能力,并且在实验质量浓度范围内对DPPH自由基清除率呈现出良好的量效关系。在低质量浓度下,三肽的抗氧化活性最强;四肽抗氧化性与芝麻小肽粗提液抗氧化能力接近;六肽的抗氧化性最弱。在高质量浓度下,三肽、四肽和粗提液的DPPH自由基清除率均接近90%。初步可以推断对于质量浓度相同、分子质量不同的小肽而言,清除DPPH自由基的能力随着小肽分子质量的减小而增大。上述结果与Chen等[13]的研究一致,肽的抗氧化活性与其分子质量大小密切相关。这主要是因为抗氧化活性肽含有某些能与自由基反应的特殊基团即供氢基团,只有当小肽在适当分子质量时,这些特殊的供氢基团才能得到最大的暴露充分与自由基作用,此时才具有较强的抗氧化性。
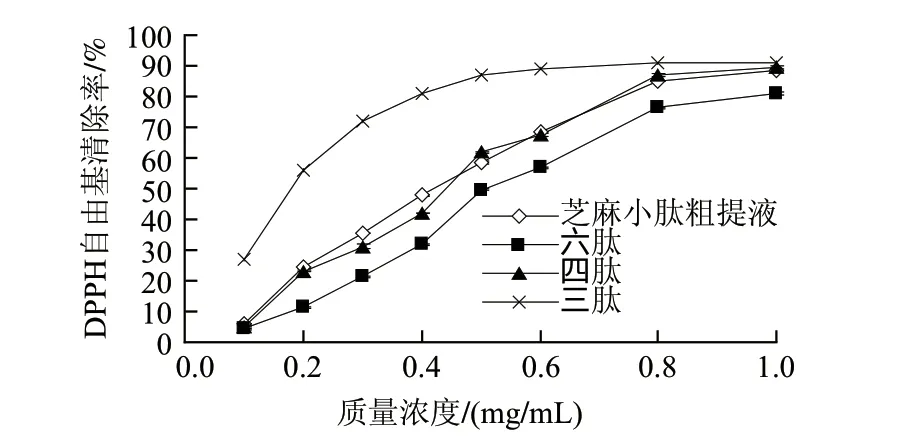
图 3 芝麻小肽清除DPPH自由基能力的比较Fig.3 Scavenging capacity of sesame peptide on DPPH free radicals
2.4 芝麻小肽对·OH的清除作用
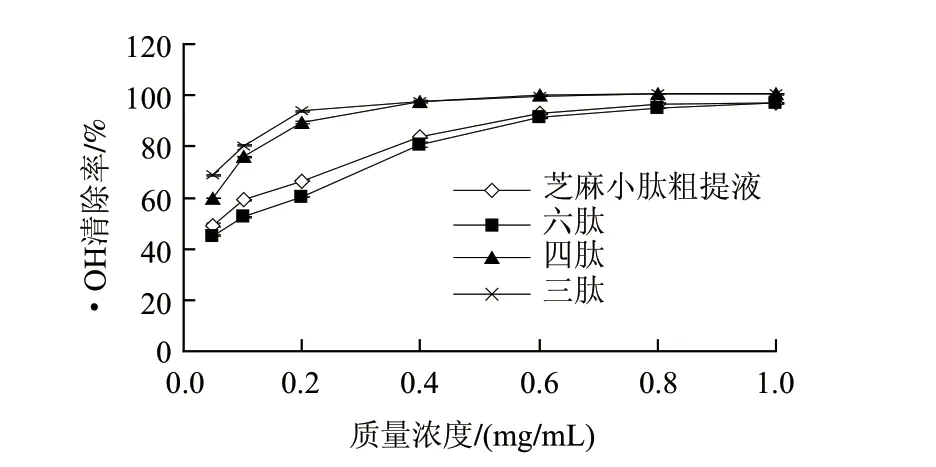
图 4 芝麻小肽清除·OH能力的比较Fig.4 Scavenging capacity of sesame peptide on hydroxyl free radicals
由图4可知,芝麻小肽在实验质量浓度(0.1~1mg/mL)范围内对·OH均有清除作用,并且随着质量浓度的增加,小肽的抗氧化活性也随之增强,小肽中含有供氢体,具有提供质子的能力,使具有高度氧化性的自由基还原,从而达到终止自由基连锁反应,起到清除或抑制自由基的目的,因此,随着质量浓度的增加,供氢体增多,提供质子的能力增强,其抗氧化性也就会随之提高。凝胶层析分离所收集的各组分中,三肽和四肽组分清除·OH最强,清除率达到100%,粗提液和六肽清除率均达到90%。
2.5 芝麻小肽还原力
样品还原力的大小可通过测定其吸光度的大小反映出来,吸光度越大则其还原力越强。由图5可知,芝麻小肽在实验质量浓度(0.5~5mg/mL)范围内总还原力与质量浓度呈线性关系。抗氧化剂是通过自身的还原作用给出电子而消除自由基的[14],因此还原力越强,其抗氧化性越强。随着小肽质量浓度的增加,小肽的抗氧化性也随之增强;凝胶层析分离所收集的各组分中,组分3(三肽)的还原力最强,这一结果与清除DPPH自由基、·OH活性一致。还原型谷胱甘肽作为对照,其总还原力高于芝麻小肽各组分。4mg/mL的小肽粗提液、四肽、六肽,2mg/mL三肽和0.5mg/mL谷胱甘肽的吸光度相同,说明这些物质的总还原力相当。
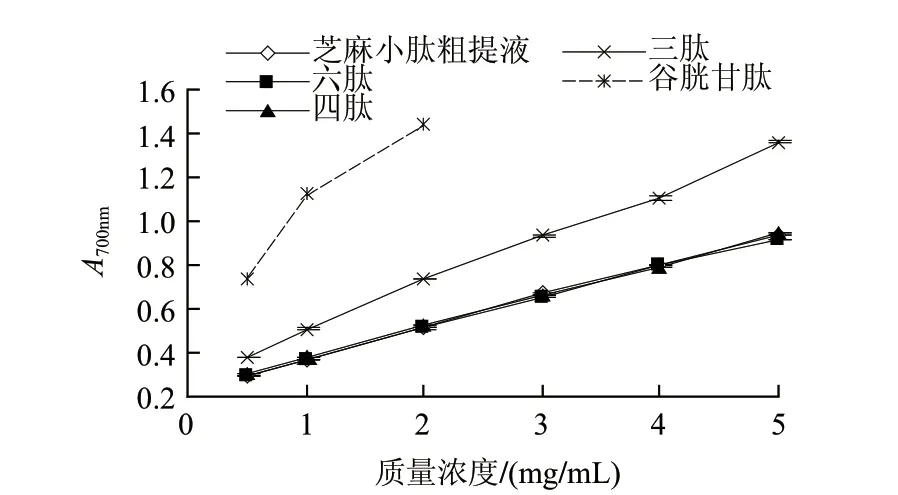
图 5 芝麻小肽总还原力的比较Fig.5 Total reducing power of sesame peptide
·OH等自由基诱导的氧化损伤被认为是引起细胞损伤、死亡、癌变,组织伤害和衰老的原因之一。因此寻找高效、低毒的抗氧化剂一直是关注的课题。目前,国内对芝麻肽的研究集中于酶解芝麻蛋白,由于使用单一的酶,得到的芝麻肽活性较低。本实验研究微生物固态发酵法产生的芝麻肽的抗氧化活性,综合以上3种抗氧化实验数据分析可以看出,在不同的实验体系中,分子质量最小的三肽抗氧化能力最强,虽然在水系中芝麻三肽总还原力低于谷胱甘肽,但在油系中芝麻小肽清除DPPH自由基活力高于BHT,因此芝麻小肽在油脂抗氧化方面值得今后深入研究。芝麻肽具有较强的还原力,对·OH和DPPH自由基均具有较强的清除作用,且抗氧化性随着芝麻肽分子质量的降低而增强,可见芝麻肽的抗氧化活性与芝麻肽的分子质量存在相关关系。抗氧化肽的抗自由基能力可能与其氨基酸组成和顺序有关[15],芝麻抗氧化肽富含供氢体,具有提供质子的能力,可以使具有高度氧化性的自由基还原,从而终止自由基链式反应,起到清除或抑制自由基的目的。这些都可能是芝麻肽具有较强抗氧化作用的原因之一,但其详细的抗氧化机理和构效关系还需要进一步研究。
3 结 论
固态发酵芝麻粕产生的三肽、四肽和六肽均具有抗氧化活性,且抗氧化性随着小肽分子量的降低而增强。芝麻小肽作为一种天然抗氧化剂,安全无毒副作用,在食品、饲料等领域有广泛的应用前景。
[1] CLEMENTE A. Enzymatic protein hydrolysates in human nutrition[J]. Trends in Food Science Technology, 2000, 11(7): 254-262.
[2] BHUYAN B J, MUGESH G. Antioxidant activity of peptide-based angiotensin converting enzyme inhibitors[J]. Organic Biomolecular Chemistry, 2012, 10(11): 2237-2247.
[3] PAN Daodong, GUO Yuxing, JIANG Xiaoyun. Anti-fatigue and antioxidative activies of peptides isolated from milk proteins[J]. Journal of Food Biochemistry, 2011, 35(4): 1130-1144.
[4] MIKAMI N, MATSUSHITA H, KATO T, et a1. Calcitonin generelated peptide is an important regulator of cutaneous immunity: effect on dendritic cell and T cell functions[J]. Journal of Immunology, 2011, 186(12): 6886-6893.
[5] BIELICKI J K, ZHANG H Y, CORTEZ Y, et a1. A new HDL mimetic peptide that stimulates cellular cholesterol effl ux with high effi ciency greatly reduces atherosclerosis in mice[J]. Journal of Lipid Research, 2010, 51(6): 1496-1503.
[6] 邵元龙, 董英. 芝麻蛋白水解工艺优化及芝麻多肽组分抗氧化活性的研究[J]. 中国粮油学报, 2010, 25(1): 69-73.
[7] 彭惠惠, 徐雅芫, 李吕木, 等. 提高芝麻粕饲用品质的发酵菌种筛选与发酵条件优化[J]. 食品与发酵工业, 2012, 38(5): 126-132.
[8] BROWN R A. An appreciation of the Folin-Lowry protein assay[J]. The Journal of Pharmacy and Pharmacology, 1992, 44(4): 369.
[9] SHYU Y S, HWANG L S. Antioxidative activity of the crude extract of lignan glycosides from unroasted Burma black sesame meal[J]. Food Reasearch International, 2002, 35(4): 357-365.
[10] SMIRNOFF N, CUMBES Q J. Hyroxyl radical scavenging activity of compatible solutes[J]. Phytochemistry, 1989, 28(4): 1057-1060.
[11] HE Yenhun, SHAHIDI F. Antioxidant activity of green tea and its catechins in a fi sh meat model system[J]. Journal of Agricultural and Food Chemistry, 1997, 45(9): 4262-4265.
[12] 刘明, 罗远栩, 倪辉, 等. 固态发酵大豆制备的抗氧化肽的活性分析[J]. 大豆科学, 2007, 26(3): 381-385.
[13] CHEN H M, MURAMOTO K, YAMAUCHI F, et a1. Antioxidant activity of designed peptides based on the antioxidative peptide isolated from digests of a soybcan protein[J]. Journal of Agricultural and Food Chemistry, 1998, 44: 49-53.
[14] SIDDHURAJU P, MOHAN P S, BECKER K. Studies on the antioxidant activity of Indian Laburnum(Cassia fistula L.): a preliminary assessment of crude extracts from stem bark, leaves, fl owers and fruit pulp[J]. Food Chemistry, 2002, 79(1): 61-67.
[15] 崔剑, 李兆陇, 洪啸吟. 自由基生物抗氧化与疾病[J]. 清华大学学报, 2000, 40(6): 9-12.
