食物源血管紧张素转化酶抑制三肽的定量构效关系
2013-08-07陈季旺刘珊珊蔡广霞吴永宁
陈季旺,刘珊珊,蔡广霞,吴永宁,2
(1.武汉工业学院食品科学与工程学院,湖北 武汉 430023;2.中国疾病预防控制中心营养与食品安全所,北京 100050)
高血压会造成脑、心、肾等重要器官损害,导致中风等,已成为一个严重的社会公共卫生问题。在发达国家,高血压患病率高达25%以上,在发展中国家,近年来其患病率也在不断增长。预计到2025年,全世界高血压病人将达到1.5亿人[1]。在高血压人群中95%以上患者是原发性高血压,通过抑制血管紧张素转化酶(angiotensinⅠ-converting enzyme,ACE)活性可降低原发性高血压[2]。食物源ACE抑制肽在温和条件下由蛋白酶水解蛋白质获得,其食用安全性高,无毒副作用;对高血压患者具有降压效果,对血压正常者无降压作用;它同时具有减肥、免疫调节等功能,有着化学合成ACE抑制剂不可比拟的优越性,其良好的安全性能以及多种生理功能吸引了众多的研究者[3]。
1979年Oshima等[4]报道了第一个从食物蛋白质中获得的ACE抑制肽。随后从乳蛋白[5]、鸡蛋蛋白[6]、油料蛋白[7]、谷物蛋白[8]、鱼蛋白[9]等中分离纯化了大量的ACE抑制肽。定量构效关系(quantitative structure-activity relationship,QSAR)研究是从一系列已知化合物中找出结构和生物学活性之间的数量依赖关系,建立数学模型,用这种数学模型可以预测新化合物的活性,并为指导和设计新化合物提供理论依据,因此对ACE抑制肽进行QSAR研究有助于深入理解肽的结构特征以及活性机理[10-11]。ACE 抑制肽的分子结构表征在QSAR 研究中非常关键,通常以物理化学参数如电性、立体和疏水等来表征结构。Hellberg等[12]首先以氨基酸侧链为基础,从29种物化参数中提取氨基酸残基的疏水性、立体性质、电荷性质3个主要参数来表征多肽结构特征。随后,许多研究者对ACE抑制肽结构与活性关系进行了研究,发现了多种潜在的ACE抑制肽和食物源[13-17]。Majumder等[18]报道采用QSAR模型预报了3种新的来源于鸡蛋蛋白的ACE抑制三肽,并通过QSAR模型证明牛奶、禽肉、鸡蛋、大豆等是良好的ACE抑制肽来源[11]。
从已报道的ACE抑制肽的QSAR模型发现,这些模型对肽的活性预测、解释能力有限,且预测结果与实测值差异较大。本实验在上述研究的基础上,收集近年发现的ACE抑制三肽,以单个氨基酸侧链的疏水值、立体性质、电性参数为自变量,三肽的lg(IC50)为因变量,利用偏最小二乘回归法(partial least squares regression,PLS)研究ACE抑制三肽的QSAR,建立数学模型,并采用“留一法”进行交叉验证,阐明三肽结构与ACE抑制活性的QSAR,并对已知氨基酸序列三肽的ACE抑制活性进行预测和验证,拟为获得高活性的ACE抑制肽提供理论基础。
1 材料与方法
1.1 样本收集
收集近年发现的ACE抑制三肽及其IC50值作为模型样本,对于不同来源的相同肽序列,报道的IC50值有差异,本实验优选较佳的IC50值,使得建立的模型具有准确性。得到101个三肽的IC50值。因IC50值的相差倍数较大,为改善分析结果,采用lg(IC50)进行数据分析。
1.2 数据处理与模型构建
根据Hellberg等[12]提出的20个天然氨基酸描述符Z-scales,从描述20个天然氨基酸的29种物化参数中,运用主成分分析法,分别提取与氨基酸的疏水性(Z1)、立体性质或者侧链氨基酸的分子大小(Z2)和电性(Z3)有关的3个参数作为自变量(表1)。模型构建(表2)以肽的lg(IC50)为因变量,引入肽的疏水性质参数为X1(计算方法参考文献[19]等),N端第一个氨基酸的疏水性、空间属性和电性参数分别为自变量X2、X3、X4,N端第二个氨基酸的疏水性、空间属性和电性参数分别为自变量X5、X6、X7,以此类推。运用PLS对多重自变量和因变量进行多元回归分析,建立QSAR模型。数据统计分析采用SIMCA-P 12.0软件在PC上完成。
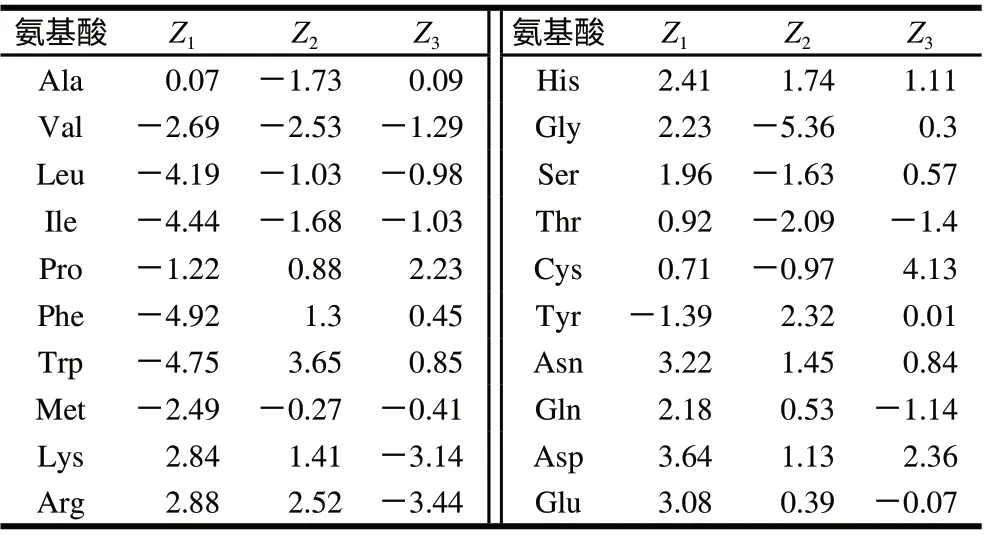
表 1 20种天然氨基酸的物理化学参数[12]Table 1 Physico-chemical parameters of twenty natural amino acids[12]
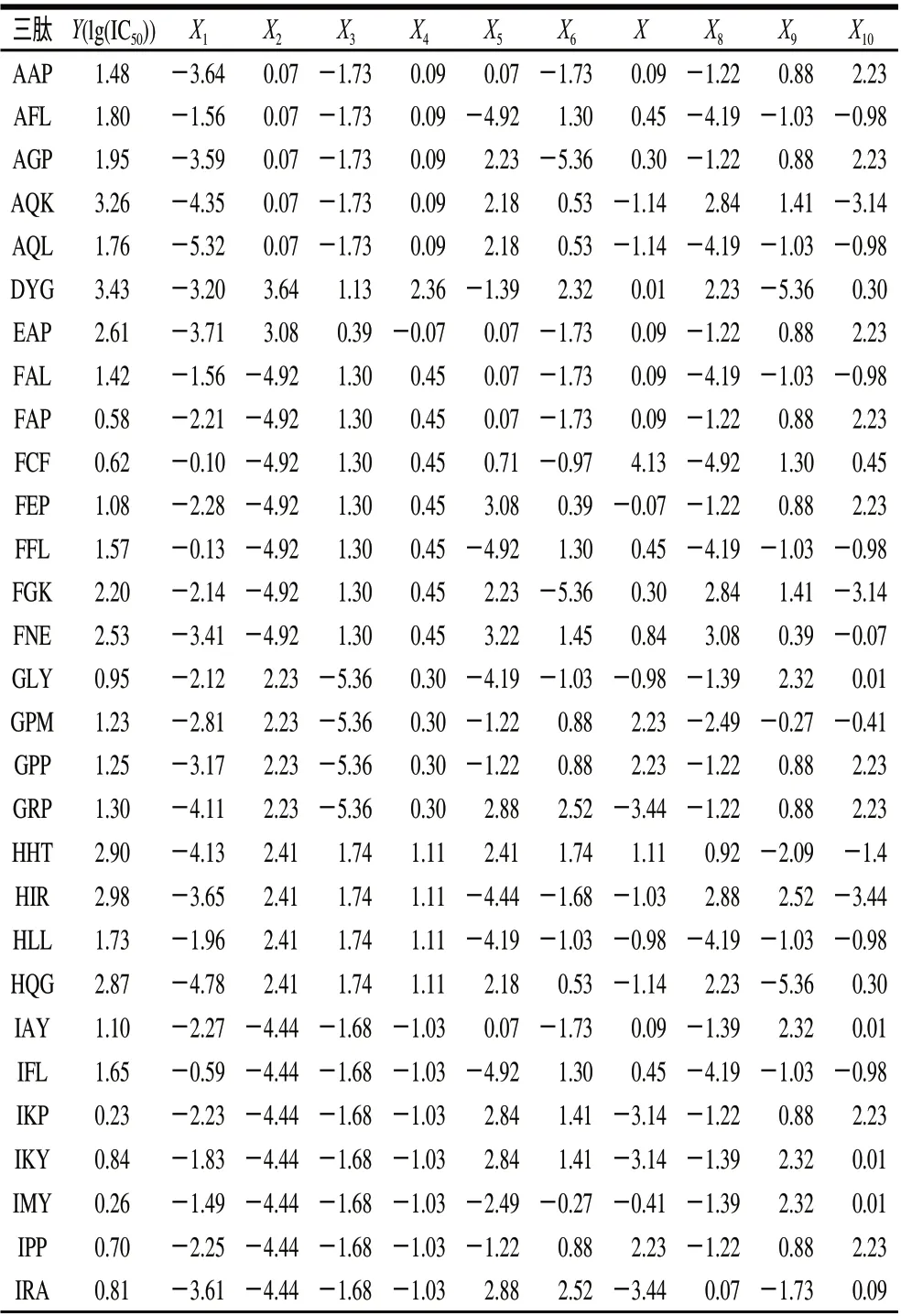
表 2 101个三肽ACE抑制活性及Z-scales描述值Table 2 ACE inhibitory activity and Z-scales of 101 tripeptides
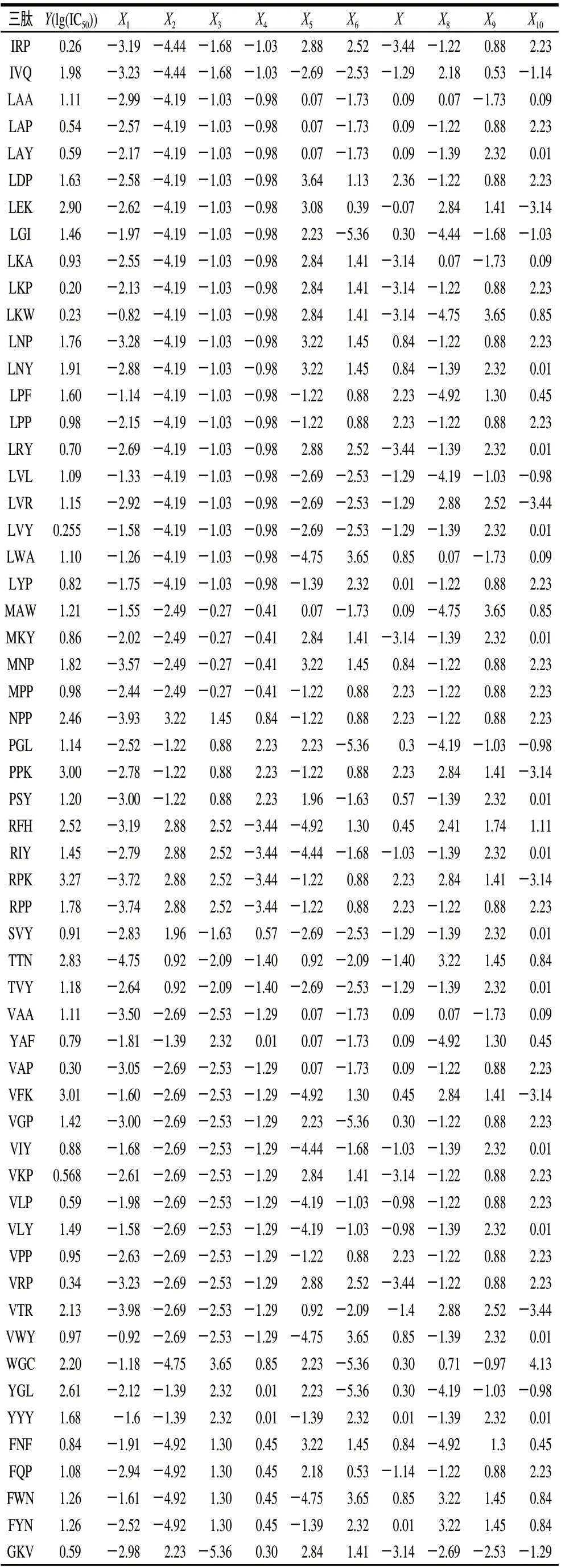
续表2
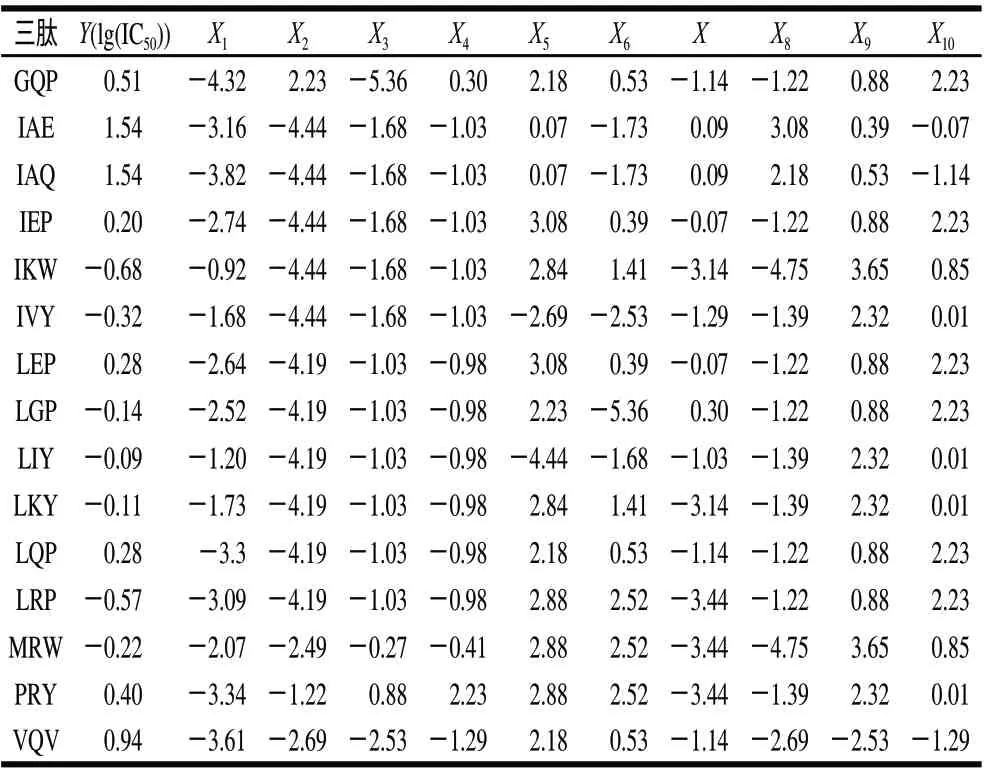
续表2
1.3 样本数据共线性分析
使用多元线性回归建模时必须要对自变量进行多重共线性检测,诊断自变量系统中是否确实存在多重相关性[20]。较为常见的诊断方法[21]是使用方差膨胀因子(VIF),若VIF≥10,表示多重共线性将严重影响回归结果的稳定性和可靠性。采用Stata 11.0软件分别计算ACE抑制三肽自变量的方差膨胀因子(VIF),对各自变量进行共线性诊断。
1.4 模型优化与ACE抑制三肽的QSAR分析
对所采集的101样本,10个自变量,1个自变量采用PLS建立数学模型,分析模型方程的标准回归系数,剔除对因变量影响不显著的自变量,重新建立数学模型,得到优化的较佳模型,分析影响ACE抑制三肽活性的关键因素及其作用效果,探讨氨基酸序列与ACE抑制三肽活性之间的关系。
1.5 模型的检验与预测
为考察模型的稳定性和预测能力,对建立的模型用“留一法(leave-one-out)”分别作交互检验(cross validation,CV),既每次从样本集中抽出一个肽,用其余的三肽建模并预测抽出的三肽的IC50值,得到各肽的IC50预测值,计算交叉验证相关系数Q2。
Q2=1-∑(yexp-ypre)2/∑(yexp-yave)2
式中:yexp表示实际测得的活性值;ypre表示交叉验证的活性预测值;yave表示所有肽平均活性值。
根据所建立模型对本课题组分离所得的VNP(Val-Asn-Pro)[23]、VWP(Val-Trp-Pro)[23]和VAP(Val-Ala-Pro)[24]的IC50值进行预测,比较实测值与预测值的差异,验证模型的预测能力。
2 结果与分析
2.1 自变量共线性诊断
采用Stata 11.0软件计算三肽10个自变量的方差膨胀因子(VIF),对各自变量进行共线性诊断。由表3可知,三肽样本集中10个自变量的VIF值在1~4之间,均小于10,表明样本自变量共线性不高,对回归模型结果的稳定性和可靠性影响较小,因此该样本变量的选取可靠。采用PLS方法建立ACE抑制三肽的QSAR模型。
2.2 PLS模型初步建立
以收集的101个ACE抑制三肽中单个氨基酸侧链的疏水性、立体性质、电性参数和肽的总体疏水性等10个自变量为自变量,以三肽的lg(IC50)值为因变量,利用PLS研究ACE抑制三肽的QSAR,建立三肽的结构与ACE抑制活性关系的QSAR模型方程,该方程10个自变量和1个因变量的回归方程标准回归系数值见表4。
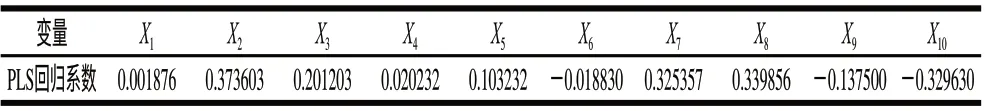
表 4 初始模型标准回归系数Table 4 PLS standard regression coeff icients of the initial model
由表4可知,自变量X1、X4、X6的标准回归系数绝对值均小于0.05,对模型的影响不显著,可解释ACE抑制三肽的总体疏水参数、第一位氨基酸的电荷性质、第二位氨基酸的立体性质对因变量lg(IC50)的影响较小,可以剔除该自变量以进一步优化模型。
2.3 模型优化与构效关系分析
在第一步模型的基础上,剔除影响不显著的自变量后,重新采用PLS方法建立模型方程,其标准化回归方程为:
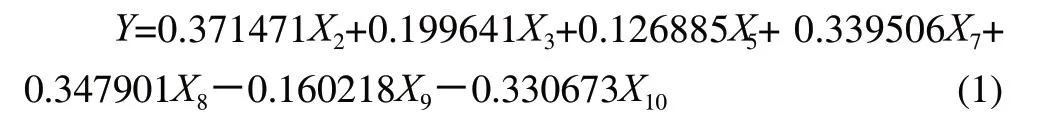
将标准化变量表示为原变量回归方程为:
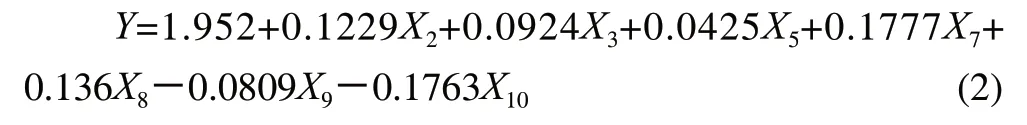
样本数101,R2(X)为0.729,R2(Y)为0.727,该模型对自变量X的解释能力为0.729,对因变量Y的解释能力为0.727,表明该模型对样本集具备良好匹配性。该模型同比Wu Jianping等[15]报道采用140样本建立的三肽模型(R2=0.4706)更精确。所得模型的自变量标准回归系数图见图1。由回归模型的相关系数可知,X2、X3、X5、X7、X8与三肽的lg(IC50)正相关,X9、X10与其负相关,且X8、X2即末、首位氨基酸的疏水值及X7中间氨基酸的电性参数对三肽的ACE抑制活性影响最大。X2、X5、X8即组成肽的单个氨基酸疏水值越小(如Val、Lys),该肽的ACE抑制活性越高。X7即中间氨基酸的电性参数对ACE抑制活性影响较大,呈正相关,而X10即末端氨基酸的电性参数对ACE抑制活性呈负相关。X3、X9即首、末位氨基酸的体积参数对ACE抑制活性亦有较大影响。由模型可得,对于ACE抑制三肽的结构组成,具较低疏水值、体积参数的氨基酸如Val、Leu和Ile倾向于处于N端第一位,较高疏水值和较低电性参数的氨基酸如Lys、Arg倾向于第二位,较低疏水值和较高体积、电性参数的氨基酸如Pro、Phe等倾向于第三位。
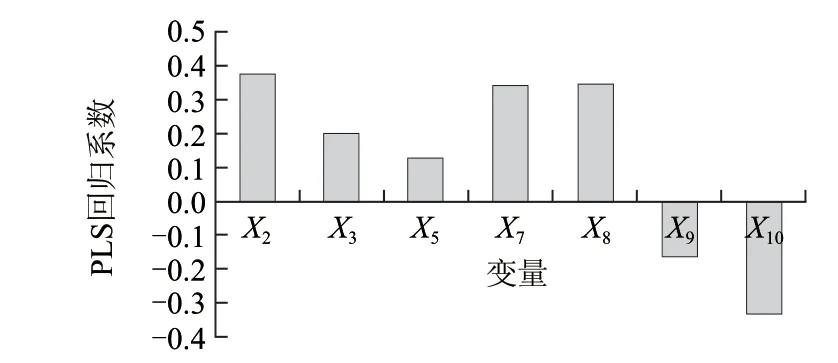
图 1 PLS 标准回归系数直方图Fig.1 Histogram of PLS standard regression coeff icients
Cheung等[22]对ACE抑制三肽的构效关系分析表明:C端为芳香族氨基酸且N端为支链氨基酸的三肽具有较高的活性。黎观红[13]以及Wu Jianping[15]等研究表明ACE抑制活性高的三肽C末端的氨基酸多为芳香族氨基酸,N端氨基酸多为疏水性氨基酸。但中间位置氨基酸分析各异,黎观红[13]指出中间位置的氨基酸倾向于电荷指数、侧链体积和疏水性较小的氨基酸,Wu Jianping等[15]报道中间位置的氨基酸为电荷指数小而侧链体积和疏水性大的氨基酸。本研究的QSAR结果中C端与N端氨基酸组成基本与报道一致,但模型表明中间位置氨基酸的体积参数对模型的影响不大,主要为电荷性质的影响,即较高疏水值和较低电性参数的氨基酸倾向于第二位如Lys、Arg。
2.4 QSAR模型的检验
为了考察模型的稳定性和预测能力,对建立的模型用“留一法”做交叉检验,计算整理出101个三肽ACE抑制活性的预测值,计算交叉验证相关系数Q2为0.549(Q2大于0.5表明模型具有较好的预测能力[15])。将三肽ACE抑制活性的预测值和实验值作图。由图2可知,模型的预测值和实验值具有较好的线性关系(R2=0.7250),表明该模型具有良好的预测能力。
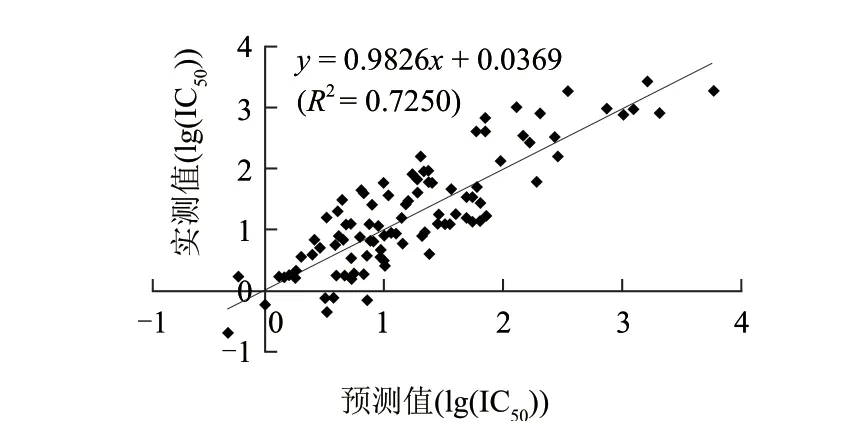
图 2 101个ACE 抑制三肽lg(IC50)实验值与预测值的相关图Fig.2 Plot of experimental lg (IC50) versus predicted lg (IC50) of 101 ACE inhibitory tripeptides
2.5 QSAR模型的预测
QSAR模型预测包括高活性ACE抑制三肽源的发现和已知三肽序列活性的预测。综合上述模型的分析和检验,该模型具有良好的匹配度和预测能力,可以利用其寻找具有较高ACE抑制活性的肽序列或预测ACE抑制活性,为后续的化学合成、体内实验提供参考。利用建立的模型对本课题组分离纯化得到的VNP、VWP和VAP的IC50值进行预测,并与实际测定值进行比较,验证模型的预测能力。

表 5 ACE抑制三肽活性预测值与实测值比较Table 5 Comparison of predicted and experimental IC50 of ACE inhibitory tripeptides
在该模型样本范围内,所选取的101个ACE抑制三肽lg(IC50)所有预测值和实测值的误差值均小于1个单位值。由表5可知,利用该模型对3种新发现的ACE抑制三肽的lg(IC50)进行预测,实测值和误差值在0.06~0.23之间,符合该模型检测范围,且对VWP的误差值最小仅为0.06,对VNP误差值最大为0.23。该结果进一步验证了模型的预测能力。
3 结 论
以采集ACE抑制三肽的氨基酸侧链的疏水性质、立体性质、电荷性质参数及三肽的总疏水参数为自变量,三肽的lg(IC50)为因变量,采用PLS方法建立三肽的组成和ACE抑制活性关系的初始数学模型,剔除对因变量影响不显著的X1、X4、X6指标,得到优化的QSAR模型的回归方程为:Y=1.952+0.1229X2+ 0.0924X3+ 0.0425X5+0.1777X7+ 0.136X8-0.0809X9-0.1763X10。
样本数101,R2(X)为0.729,R2(Y)为0.727,Q2为0.549。该模型对自变量X的解释能力为0.729,对因变量Y的解释能力为0.727,表明该模型对样本集具备良好匹配性。Q2为0.549大于0.5,表明模型具有较好的预测能力。
对模型的分析结果表明:X8、X2即末、首位氨基酸的疏水值及X7中间氨基酸的电性参数对三肽的ACE抑制活性影响最大。X2、X5、X8即组成肽的各氨基酸疏水值越小(如Val、Leu),该肽的ACE抑制活性越高。X7即中间氨基酸的电性参数对ACE抑制活性呈正相关,而X10即末端氨基酸的电性参数对ACE抑制活性呈负相关。对于ACE抑制三肽,具较低疏水值、体积参数的氨基酸如Val、Leu和Ile倾向于处于N端第一位,较低疏水值、电荷参数如Lys和Arg倾向于第二位,较低疏水值和较高体积参数、电荷参数如Pro、Phe等倾向于第三位。利用该模型预测新发现的ACE抑制三肽VNP、VWP和VAP,结果表明3种ACE抑制三肽实测值和误差值在0.06~0.23之间,均在模型样本误差范围内,进一步验证该模型具备的良好预测能力。
[1] KEARNEY P M, WHELTON M, REYNOLDS K, et al. Global burden of hypertension: analysis of worldwide data[J]. Lancet, 2005,365: 217-223.
[2] BROWN N J, VAUGHAN D E. Angiotensin-converting enzyme inhibitors[J]. Circulation, 1998, 97: 1411-1420.
[3] GUANG C, PHILLIPS R D. Plant food-derived angiotensin Ⅰconverting enzyme inhibitory peptides[J]. Journal of Agricultural and Food Chemistry, 2009, 57: 5113-5120.
[4] OSHIMA G, SHIMABUKURO H, NAGASAWA K. Peptide inhibitors of angiotensin Ⅰ-converting enzyme in digests of gelatin by bacterial collagenase[J]. Biochimica Biophysica Acta, 1979, 566: 128-137.
[5] QUIR S A, MAR CONTRERAS M, RAMOS M, et al. Stability to gastrointestinal enzymes and structure–activity relationship of β-casein-peptides with antihypertensive properties[J]. Peptides, 2009,30: 1848-1853.
[6] YU Zhiping, LIU Boqun, ZHAO Wenzhu, et al. Primary and secondary structure of novel ACE-inhibitory peptides from egg white protein[J]. Food Chemistry, 2012, 133(2): 315-322.
[7] JIMSHEENA V K, GOWDA L R. Angiotensin Ⅰ-converting enzyme(ACE) inhibitory peptides derived from arachin by simulated gastric digestion[J]. Food Chemistry, 2011, 125: 561-569.
[8] YANG Yanjun, TAO Guanjun, LIU Pi, et al. Peptide with angiotensinⅠ-converting enzyme inhibitory activity from hydrolyzed corn gluten meal[J]. Journal of Agricultural and Food Chemistry, 2007, 55:7891-7895.
[9] FUJITA H, YOSHIKAW A. LKPNM: a prodrug-type ACE-inhibitory peptide derived from fish protein[J]. Immunopharmacology, 1999,44(1/2): 123-127.
[10] PRIPPA A H, ISAKSSON T, STEPANIAK L, et al. Quantitative structure activity relationship modelling of peptides and proteins as a tool in food science[J]. Trends in Food Science & Technology, 2005,16: 484-494.
[11] GU Yuchen, MAJUMDER K, WU Jianping. QSAR-aided in silico approach in evaluation of food proteins as precursors of ACE inhibitory peptides[J]. Food Research International, 2011, 44:2465-2474.
[12] HELLBERG S, SJÖSTRÖM M, SKAGERBERG B, et al. Peptide quantitative structure-activity-relationships, a multivariate approach[J].Journal of Medicinal Chemistry, 1987, 30(7): 1126-1135.
[13] 黎观红. 食品源血管紧张素抑制肽的研究[D]. 无锡: 江南大学, 2005.
[14] PRIPP A H, ISAKSSON T, STEPANIAK L, et al. Quantitative structure-activity relationship modelling of ACE-inhibitory peptides derived from milk proteins[J]. European Food Research and Technology, 2004, 219(6): 579-583.
[15] WU Jianping, ALUKO R E, NAKAI S. Structural requirements of angiotensin Ⅰ-converting enzyme inhibitory peptides: quantitative structure- activity relationship study of di- and tripeptides[J]. Journal of Agricultural and Food Chemistry, 2006, 54: 732-738.
[16] 王毅梅. 草鱼源ACE抑制肽的分离纯化及定量构效研究[D]. 武汉:武汉工业学院, 2011.
[17] HEMMATEENEJAD B, MIRI R, ELYASI M. A segmented principal component analysis-regression approach to QSAR study of peptides[J].Journal of Theoretical Biology, 2012, 305: 37-44.
[18] MAJUMDER K, WU Jianping. A new approach for identification of novel antihypertensive peptides from egg proteins by QSAR and bioinformatics[J]. Food Research International, 2010, 43(5): 1371-1378.
[19] 陶鹏, 王任小, 来鲁华. 用氨基酸加和法计算多肽的脂水分配系数[J]. 物理化学学报, 1999, 15(5): 449-453.
[20] 王惠文. 偏最小二乘回归的线性与非线性方法[M]. 北京: 国防工业出版社, 2006: 1-133.
[21] 马雄威. 线性回归方程中多重共线性诊断方法及其实证分析[J]. 华中农业大学学报: 社会科学版, 2008(2): 78-83.
[22] CHEUNG H S, WANG Fenglai, ONDETTI E, et al. Binding of peptide substrate and inhibitors of angiotensin-converting enzyme[J].Journal of Biological Chemistry, 1980, 255: 401-407.
[23] 蔡广霞. 大米源血管紧张素转化酶抑制肽的复合酶法制备、纯化及构效关系研究[D]. 武汉: 武汉工业学院, 2012.
[24] CHEN Jiwang, WANG Yimei, ZHONG Qixin, et al. Purif ication and characterization of a novel angiotensin-I converting enzyme (ACE)inhibitory peptide derived from enzymatic hydrolysate of grass carp protein[J]. Peptides, 2012, 33(1): 52-58.
