茶叶儿茶素对肠道微生态的调节作用
2013-08-07马丽苹曾晓雄
张 鑫,马丽苹,张 芸,高 远,胡 冰,曾晓雄,*
(1.南京农业大学食品科技学院,江苏 南京 210095;2.河南科技大学食品与生物工程学院,河南 洛阳 471003)
茶是全世界最受欢迎的饮料之一。除了脍炙人口的色、香、味之外,饮茶可以有效的降低罹患各种疾病的风险,例如癌症、高血压、高血脂等,而研究发现茶的风味与保健功能正是茶叶所特有的茶多酚、茶氨酸等具有生物活性的成分所赋予的[1-3]。近年来,医药、健康研究领域开始越来越关注茶叶儿茶素体内代谢产物的化学结构与生理活性,综合目前已有的研究报道来看,茶叶儿茶素在体内的代谢主要分为两大部分,一是通过小肠壁吸收到人体内循环的儿茶素的生物转化,主要包括甲基化、糖基化和硫酸化;二是肠道中微生物对茶叶儿茶素的分解、代谢[4-5]。由于茶叶儿茶素的生物利用率低,直接被小肠吸收的茶叶儿茶素只占人体摄入的茶叶儿茶素的少部分,可以推测人体摄入的茶叶儿茶素绝大部分进入了大肠,并被肠道微生物分解、代谢,发挥生理作用[6-8]。据报道[9]富含多酚的蓝莓水提取物在体内可以发挥类似于益生元的作用,然而有关茶叶儿茶素对于肠道微生态的调节作用,目前还鲜有报道。近年来,本课题组建立了茶叶儿茶素包括有抗过敏活性的甲基化儿茶素[10-13]的分离、纯化以及高效液相色谱(HPLC)分析方法[14-15],利用体外厌氧粪样混合培养与荧光原位杂交(FISH)技术分析鹰嘴豆α-低聚半乳糖对肠道菌群的影响[16]。因此,本研究拟利用体外厌氧粪样混合培养方式对分离纯化得到的茶叶儿茶素、甲基化儿茶素进行发酵培养,通过FISH方法分析厌氧发酵过程中有益菌群(双歧杆菌、乳酸菌)、有害菌群(拟杆菌、梭状菌)以及总菌群的数量变化,研究其对于调节肠道微生态的作用,为茶叶儿茶素与甲基化儿茶素生理功能的阐明及其综合利用提供理论基础。
1 材料与方法
1.1 材料与试剂
乌龙茶购自广东广州市商场。
Toyopearl HW-40S 日本Tosoh公司;EGCG、ECG、EGC、EC标准品 日本Funakoshi公司;无水乙醇及甲醇 上海国药化学试剂有限公司;厌氧混合气体(10% H2、10% CO2和80% N2)和高纯N2南京特种气体厂;4,6-联眯-2-苯基吲哚二盐酸(DAPI)荧光染料 德国Roche公司。
表1所示的FISH专用16S rRNA寡合苷酸单链探针由生工生物工程(上海)股份有限公司合成,序列5’端所接荧光基团为吲哚二羧菁(Cy3),使用的探针是前人报道的文献[14-17]中已经成功使用、成熟的探针序列;(-)-表没食子儿茶素3-O-(3-O-甲基)没食子酸酯(EGCG3’’Me)及(-)-3-O-甲基-表儿茶素没食子酸酯(ECG3’Me)标样根据周蓓等[18]报道的方法制备。

表 1 16S rRNA探针的靶细菌种/属和探针序列Table 1 Sequences, target genera or species of 16S rRNA-based probes
1.2 仪器与设备
Agilent 1100高效液相色谱仪(包括G1328B手动进样器、G1311A四元泵、G1379A真空脱气机、G1316A柱温箱和G1315B二极管阵列检测器(DAD)) 美国安捷伦公司;中压色谱仪 瑞士Büchi公司;Laborota 4000真空旋转蒸发仪 德国Heidolph公司;冷冻干燥机 英国Labconco公司;AY-120电子精密天平、BL-220H分析天平 日本Shimadzu公司;YQX-I厌氧培养箱 上海跃进医疗器械厂;Zeiss Axio Imager A1型荧光正置显微镜系统 德国Carl Zeiss公司。
1.3 方法
1.3.1 茶叶儿茶素样品的制备
称取适量的粉碎茶样,按照料液比1:20(m/V)加入热水,在90℃恒温振荡器中振荡提取40min,室温条件下4500×g离心15min得上清液,茶渣用同样方法再次浸提,合并两次上清液并浓缩、冻干,得到茶多酚粗提物。
将茶多酚粗提物制成一定质量浓度的料液,经0.45μm滤膜过滤后上聚酰胺层析柱(1.6cm×30cm)。首先用水洗去水溶性杂质,洗脱2BV(BV为柱床体积)后换用95%的乙醇洗脱,收集2BV洗脱液,浓缩,上Toyopearl HW-40S柱(5.0cm×50cm),用70%~90%的乙醇洗脱,采用自动部分收集器收集洗脱液(10mL/管),并利用HPLC分析洗脱液中儿茶素的组成,合并合适的组分,浓缩、冻干,得到各茶叶儿茶素样品。
1.3.2 茶叶儿茶素含量的测定
采用HPLC外标法测定分离纯化得到的儿茶素样品的纯度[19]。色谱条件:TSKgel ODS-100Z色谱柱(4.6mm× 150mm,5μm),柱温40℃,检测波长280nm;梯度洗脱(流动相A:CH3COOH,pH 2.5;流动相B:CH3OH),洗脱时间15min,流动相A体积分数由82%降至40%,流动相B体积分数由18%升至60%,流速1.0mL/min;进样量20μL。
儿茶素标准曲线的制备:精确称取各茶叶儿茶素的标准品,溶解于水中,配制成一系列不同质量浓度梯度的标准溶液,经0.45μm针头式滤膜过滤后,按质量浓度从低到高的顺序进行HPLC检测,记录各个质量浓度对应的峰面积并以峰面积对质量浓度作图,得到各种儿茶素的标准曲线。
1.3.3 体外厌氧粪样混合培养
粪便样本的收集与处理:收集受试者(受试者为3人,均为25~30岁之间健康人群,且在近2个月内未服用过抗生素)的新鲜全便,置于一次性硬质无菌塑料袋中,封口后尽快存放于4℃冰箱。使用时混匀并称取0.5g,加入4.5mL经过滤、脱氧处理的PBS缓冲液,迅速置于厌氧培养箱中,经旋涡混合器振荡混匀3min,待用。体外厌氧粪样混合培养按照Manz等[16]报道的方法进行。首先称取受试的茶叶儿茶素样品溶解于高压灭菌后的含氮基础培养基(含氮基础培养基:1L超纯水含有蛋白胨2g、酵母膏2g、NaCl 0.1g、K2HPO40.04g、MgSO4·7H2O 0.01g、CaCl2·7H2O 0.01g、NaHCO32g、氯化血红素0.05g、L-半胱氨酸0.5g、胆汁酸盐0.5g、吐温-80 2mL、VK 10μL;0.025g/100mL刃天青4mL)中,得到终质量浓度为1g/1000mL的底物溶液。然后取粪便样液(10%、pH 7.3的PBS)150μL悬浮于1.35mL含有各种茶叶儿茶素样品的底物培养基溶液中,混合均匀后放入厌氧培养箱(10% H2、10% CO2、80% N2)中,37℃发酵培养。在培养时间为0、6、12、24h时分别取100μL样液,供细胞FISH计数。实验设3个重复,对照为不加任何茶叶儿茶素的处理。
1.3.4 菌体计数
菌体计数采用FISH法[15-17,20]。将300μL的多聚甲醛(pH7.2、4g/100mL)加入到100μL体外厌氧粪样混合培养发酵样液中,置于4℃冰箱中冷藏16h,离心后用PBS缓冲液冲洗两次,再用300μL PBS-酒精(体积比1:1)保存菌体。取菌体样液10μL,滴入经过铬明胶溶液包埋过的载玻片圆孔内,平铺于整个圆圈,在阴暗处自然风干3h,然后用50%、80%、96%的乙醇溶液进行连续脱水操作(各3min),自然风干。将1μL 50ng/μL的探针试剂与9μL杂交缓冲液加到载玻片的菌体试样中,然后迅速将载玻片置入含有杂交缓冲液的湿盒中,根据探针类型采用不同温度条件(探针Bif164:50℃,探针Lab158:45℃,探针Bac303:45℃,探针His150:50℃)杂交10h。杂交结束后,迅速用清洗缓冲液与超纯水冲洗载玻片,在避光条件下自然风干。测定总菌体数时,将10μL 1.25ng/μL的DAPI溶液加入到杂交后的载玻片上,保持5min,然后用超纯水冲洗与自然干燥。所有样品用Zeiss Axio Imager A1型荧光正置显微镜系统进行观测,采用AxioVision荧光成像软件对每个试样随机选择10~15个视野进行拍照,记录荧光光点。在对杂交后的各种菌体进行拍照与荧光光点计数后,根据试样质量浓度以及稀释倍数等计算出细菌总数,并取其以对数(lg(细菌总数/mL))。
1.3.5 益生指数(PI)的计算
参考Palframan等[21]的方法计算PI。
PI = (Bif/Total)+(Lac/Total)-(Bac/Total)-(His/Total)
式中:Bif代表不同时间点Bifidobacterium spp.的数量除以接种时的数量;Lac代表不同时间点Lactobacillus-Enterococcus spp.的数量除以接种时的数量;Bac代表不同时间点Bacteroides-Prevotella group的数量除以接种时的数量;His代表不同时间点Clostridium histolyticum group的数量除以接种时的数量;Total代表不同时间点总菌群的数量除以接种时的数量。
1.3.6 数据分析
实验数据采用SPSS软件进行方差分析。
2 结果与分析
2.1 茶叶儿茶素样品的制备
富含甲基化儿茶素的茶叶经热水浸提、浓缩和冻干,得到茶多酚粗提物。由于茶多酚粗提物含有一定量的多糖、咖啡碱等杂质,因此采用聚酰胺树脂层析柱对其进行分离纯化。经过聚酰胺树脂柱层析分离之后,茶多酚含量提高到90%。由于Toyopearl HW-40S对于从茶多酚中分离茶叶儿茶素单体有着很好的效果[18],所以本实验将初步纯化的茶多酚上Toyopearl HW-40S层析柱,进行高纯度EGCG和EGCG3”Me的样品制备。通过70%~90%的乙醇洗脱,分别制备得到了纯度30% EGCG3”Me的样品、50% EGCG3’’Me的样品、90% EGCG3”Me的样品和90% EGCG的样品。图1为EGCG与EGCG3”Me的结构图。

图 1 EGCG和EGCG3”Me的化学结构Fig.1 Chemical structures of EGCG and EGCG3” Me
2.2 茶叶儿茶素对肠道中有益菌群(双歧杆菌和乳酸菌)的增殖作用

图 2 EGCG和EGCG3”Me体外厌氧发酵样液FISH处理后荧光显微镜下观察的结果Fig.2 FISH results of anaerobic fermentation broth with EGCG and EGCG3”Me observed under epifluorescence microscope
图2A和图2B分别为使用Bif164探针和Lab158探针对于茶叶儿茶素样品经厌氧发酵的样液,经FISH处理后荧光显微镜下观察的结果。表2为以不同茶叶儿茶素样品为底物时,不同发酵时间有益菌群(双歧杆菌和乳酸菌)的增殖情况。可以看出,在不同的发酵时间点,与对照组相比EGCG和EGCG3’’Me样品都可以更好的促进双歧杆菌的增长,说明茶叶儿茶素对于双歧杆菌的增殖作用明显。随着发酵时间的延长,双歧杆菌的数量逐渐增多,发酵时间为6h与24h时各茶叶儿茶素样品的差异显著。当培养时间达到24h时,纯度为90%的EGCG3’’Me的效果好于同样纯度的EGCG,同时也高于相对较低纯度的EGCG3’’Me样品,它们之间的差异显著。
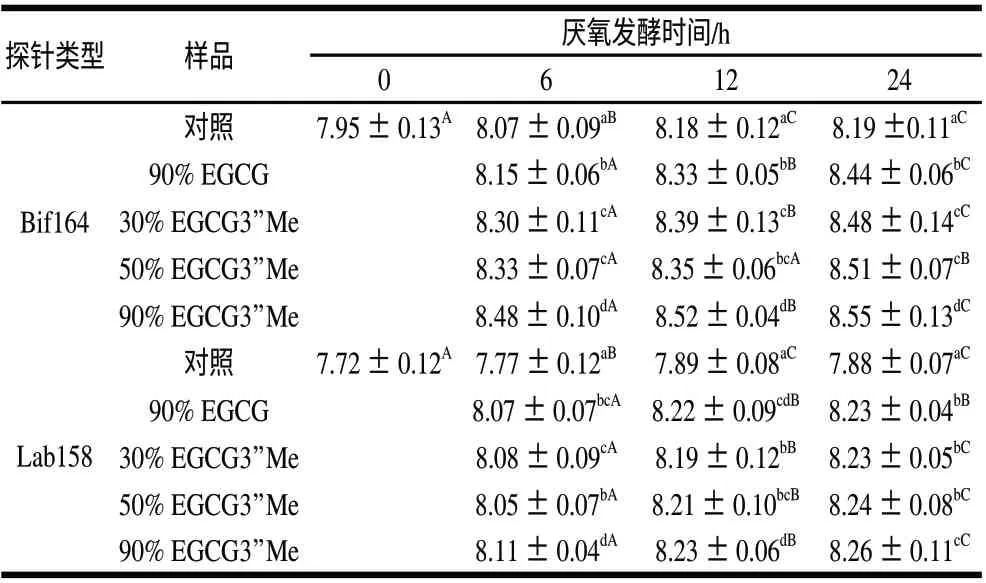
表 2 EGCG3’’Me和EGCG体外厌氧发酵0、6、12、24h后双歧杆菌和乳酸菌的数量Table 2 Number of Bifidobacterium spp. and Lactobacillus/Enterococcus spp. in anaerobic fermentation broth of EGCG3”Me and EGCG at 0, 6, 12 h and 24 h lg(细菌总数/mL)
由表2可知,与对照组相比,在不同的发酵时间点不同茶叶儿茶素样品对乳酸菌的增殖作用也呈现差异性,说明茶叶儿茶素对于乳酸菌有着较好的增殖效果。随着发酵时间的延长,乳酸菌的数量逐渐增多,发酵时间为6h与24h时各茶叶儿茶素样品的增殖效果差异显著。当培养时间为24h时,纯度为90%的EGCG与纯度分别为30%和50%的EGCG3”Me对于乳酸菌的增殖作用差异不显著,而纯度为90%的EGCG3”Me与其他样品相比差异显著,可以明显的促进乳酸菌的增殖。
2.3 茶叶儿茶素对肠道中有害菌群(拟杆菌和梭状菌)的增殖作用
图2C和图2D分别为使用Bac303和His150探针对于不同茶叶儿茶素样品经厌氧发酵的样液,经FISH处理后荧光显微镜下观察的结果,表3为以不同茶叶儿茶素样品为底物时,不同发酵时间拟杆菌和梭状菌的增殖情况。由表中可以看出,若样品中不加任何茶叶儿茶素,随着发酵时间的延长,拟杆菌的数量逐渐增多。与对照组相比,在不同的发酵时间点,不同茶叶儿茶素样品对拟杆菌增殖的抑制作用差异显著。随着发酵时间的延长,拟杆菌的数量逐渐减少,发酵时间为6h与24h的各儿茶素样品具有差异显著性,说明儿茶素样品对于拟杆菌的抑制作用明显。当培养时间达到24h时,纯度50%和90%的EGCG3”Me样品差异不显著,而纯度为90%的EGCG3”Me与同样纯度的EGCG差异也不显著。
由表3可知,与对照组相比,在不同的发酵时间点不同茶叶儿茶素样品对梭状菌增殖的抑制作用具有显著差异。随着发酵时间的延长,梭状菌的数量逐渐减少,发酵时间为6h与24h的各茶叶儿茶素样品的抑制效果具有差异显著性。可以看出,EGCG和EGCG3’’Me都可以达到抑制梭状菌增殖的效果,当培养时间达到24h时,纯度50%和90%的EGCG3’Me样品的效果差异不显著,而纯度为90%的EGCG3’’Me样品的效果好于同样纯度的EGCG样品的效果。

表 3 EGCG3”Me和EGCG体外厌氧发酵0、6、12、24 h后拟杆菌和梭状菌的数量Table 3 Number of Bacteroids-Prevotella spp. and Clostridium histolyticum in anaerobic fermentation broth of EGCG3”Me and EGCG at 0, 6, 12 h and 24 h lg(细菌总数/mL)
2.4 茶叶儿茶素对肠道总菌群数的影响
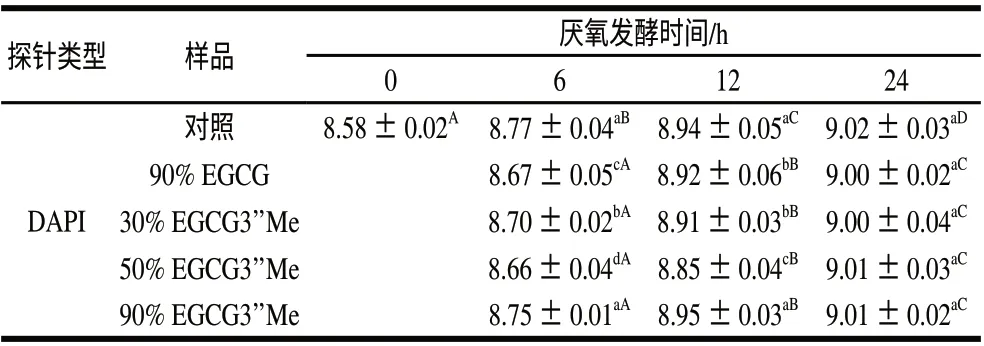
表 4 EGCG3”Me和EGCG体外厌氧发酵0、6、12、24 h后总菌群的数量Table 4 Number of total bacteria in anaerobic fermentation broth of EGCG3”Me and EGCG at 0, 6, 12 h and 24 h lg(细菌总数/mL)
图2E为使用DAPI荧光染料对不同儿茶素样品经厌氧发酵的样液,经FISH处理后荧光显微镜下观察的结果。由表4可以看出,随着发酵时间的延长,肠道内菌群的数量在慢慢增多,12h与6h具有差异显著性,而24h时不同纯度的茶叶儿茶素样品与对照组相比对肠道内总菌群的影响不显著,说明EGCG与EGCG3’’Me基本不会影响肠道内总菌群的数量。结合前面的实验数据可以得出,茶叶儿茶素只是改变了肠道内菌体的组成,对总体菌群的数量基本没有影响。
2.5 益生指数(PI)的比较
由图3可知,EGCG3’’Me的纯度越高的样品,其PI值越大,EGCG含量为90%的样品和EGCG3’’Me含量为90%、50%、30%的样品的PI值分别为1.86(24h)、2.68(6h)、2.25(6h)和2.14(6h),而对照组为0.12(12h)。在不同发酵时间点,各茶叶儿茶素样品与对照组相比,PI值都具有显著差异性(P<0.05);除了纯度为30%的EGCG3’’Me在12h和24h的PI值差异不显著(P>0.05)外,各茶叶儿茶素样品之间的PI值在各发酵时间点其差异显著(P<0.05)。对于不同纯度的EGCG3’’Me样品,其PI值在厌氧发酵6h时最大,而后降低,可能是由于一开始菌体的大量增殖使得体系中的营养物质被大量利用,后因营养的缺乏导致部分菌体死亡,而纯度为90%的EGCG样品,随着发酵时间的延长,其PI值逐渐增大。结合前面的分析可以得出,对照组对有害菌的增殖大于有益菌,而不同纯度的茶叶儿茶素样品对有益菌有较好的增殖作用,对有害菌有较好的抑制作用。在不同的厌氧发酵时间点,各种纯度的EGCG3’’Me样品的PI值都大于纯度为90%的EGCG;随着纯度的升高,EGCG3’’Me样品的PI值也在增加,且差异显著。
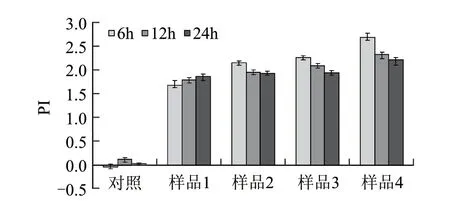
图 3 体外厌氧发酵6、12、24h时茶叶儿茶素的益生指数Fig.3 Probiotic index (PI) of anaerobic fermentation broth of tea catechins at 6, 12 h and 24 h
Molan等[9]报道蓝莓多酚提取物能促进双歧杆菌和乳酸菌在肠道内的定殖,从而竞争性的抑制病原菌在肠道内的黏附、定殖和繁殖。一般而言,肠道内双歧杆菌和乳酸菌等有益菌数量的增加可以更加有效的减少氨、粪臭素及前致癌物质的形成,增加有机酸的产生,降低结肠及粪便的pH值,抑制病原菌的生长繁殖,从而改善肠道的微环境,促进人体的健康[22-24]。研究发现茶叶儿茶素能有效促进有益菌的增长,同时抑制病原菌的增殖,因此茶叶儿茶素类物质,尤其是甲基化儿茶素,在肠道微生态的调节方面起到积极的作用。茶叶儿茶素发挥益生元功能,可能的机理是茶叶儿茶素作为抗氧化剂可以调节代谢活动中产生的氧化应激,从而为肠道中有益菌生长和繁殖提供更有利的环境[25-26]。同时,在发酵过程中产生的短链脂肪酸能够降低肠道的pH值,有效调节肠道的微生态环境,在促进有益菌生长的同时,抑制有害菌的繁殖[27]。
3 结 论
本研究以中国乌龙茶为原料,制备得到了高纯度EGCG及不同纯度的EGCG3’’Me样品。体外厌氧粪样混合培养实验结果表明,茶叶儿茶素样品对双歧杆菌、乳酸菌都有较好的增殖作用,并对拟杆菌、梭状菌的生长有一定的抑制作用。甲基化儿茶素对肠道菌群的影响只是改变了肠道内菌体的组成,对总体菌群的数量基本没有影响;90% EGCG3’’Me的样品对有益菌的增殖作用最强,对有害菌的抑制作用也最强,且具有最高的PI值(2.68)。因此茶叶儿茶素特别是甲基化儿茶素对于肠道的微生态调节作用,为茶叶儿茶素的作用机理研究及其开发利用提供参考。
[1] 毛清黎, 施兆鹏, 李玲, 等. 茶叶儿茶素保健及药理功能研究新进展[J]. 食品科学, 2007, 28(8): 584-589.
[2] KHAN N, MUKHTAR H. Tea polyphenols for health promotion[J]. Life Science, 2007, 81: 519-533.
[3] 王开荣, 邵淑宏, 叶俭慧, 等. 茶氨酸保健功能研究进展[J]. 茶叶, 35(3): 140-144.
[4] LAMBERT J D, SANG S, YANG C S. Biotransformation of green tea polyphenols and the biological activities of those metabolites[J]. Molecular Pharmaceutics, 2007, 4(6): 819-825.
[5] LEE H C, JENNER A M, LOW C S, et al. Effect of tea phenolics and their aromatic fecal bacterial metabolites on intestinal microbiota[J]. Research in Microbiology, 2006, 157: 876-884.
[6] LEE M J, MALIAKAL P, CHEN L S. Pharmacokinetics of tea catechins after ingestion of green tea and (-)-epigallocatechin-3-gallate by humans formation of different metabolites and individual variability[J]. Cancer Epidemiology Biomarkers and Prevention, 2002, 11: 1025-1032.
[7] BEVERLY A W, LAMETTA S S, GARY R B, et al. Catechins are bioavailable in men and women drinking black tea throughout the day[J]. Journal of Nutrition, 2001, 131: 1731-1737.
[8] MENG Xiaofeng, SANG Shengmin, ZHU Nanqun, et al. Identification and characterization of methylated and ring-fission metabolites of tea catechins formed in humans, mice and rats[J]. Chemical Research in Toxicology, 2002, 15(8): 1042-1050.
[9] MOLAN A L, LILA M A, MAWSON J, et al. in vitro and in vivo evaluation of the prebiotic activity of water-soluble blueberry extracts[J]. World Journal of Microbiology and Biotechnology, 2009, 25: 1243-1249.
[10] 吕海鹏, 林智, 谭俊峰, 等. 茶叶中的EGCG3”Me研究[J]. 食品与发酵工业, 2008, 34(10): 22-25.
[11] 孙业良, 吕海鹏, 林智, 等. 茶叶中EGCG3”Me的分析方法研究[J]. 茶叶科学, 2009, 29(5): 379-384.
[12] 伍妍俊, 汪小钢, 宛晓春. 甲基化EGCG的研究现状及展望[J]. 茶叶科学, 2010, 30(6): 407-413.
[13] 李银花, 李娟, 龚雪, 等. 茶叶中甲基化EGCG的研究进展[J]. 中国茶叶, 2010(8): 12-13.
[14] WILKINSON H, WELLING G W. Quantitative fluorescence in situ hybridization of Bifi dobacterium spp. with genus-specific 16S rRNAtargeted probes and its application in fecal samples[J]. Applied and Environmental Microbiology, 1995, 61: 3069-3075.
[15] HARMSEN H J M, ELFFERICH P, SCHUT F, et al. A 16S rRNAtargeted probe for detection of lactobacilli and enterococci in fecal samples by fluorescent in situ hybridization[J]. Microbial Ecology in Health and Disease, 1999, 11: 3-12.
[16] MANZ W, AMANN R, LUDWIG W, et al. Application of a suite of 16S rRNA-specific oligonucleotide probes designed to investigate bacteria of the phylum Cytophaga-Flavobacter-Bacteroides in the natural environment[J]. Microbiology, 1996, 142: 1097-1106.
[17] FRANKS A H, HARMSEN H J, RAANGS G C, et al. Variations of bacterial populations in human feces measured by fluorescent in situ hybridization with group-specific 16S rRNA-targeted oligonucleotide probes[J]. Applied and Environmental Microbiology, 1998, 9: 3336-3345.
[18] 周蓓, 王琳, 李伟, 等. 茶叶中甲基化儿茶素的分离、纯化和高效液相色谱法分析[J]. 分析化学, 2008, 36(4): 494-498.
[19] HU Bing, WANG Lin, ZHOU Bei, et al. Efficient procedure for isolating methylated catechins from green tea and effective simultaneous analysis of ten catechins, three purine alkaloids, and gallic acid in tea by high-performance liquid chromatography with diode array detection[J]. Journal of Chromatography A, 2009, 1216: 3223-3231.
[20] 贺晋艳, 张芸, 李伟, 等. 鹰嘴豆α-低聚半乳糖的肠道益生功能[J]. 食品科学, 2011, 32(15): 94-95.
[21] PALFRAMAN R, GIBSON G R, RASTALL R A. Development of a quantitative tool for the comparison of the prebiotic effect of dietary oligosaccharides[J]. Letters in Applied Microbiology, 2003, 37: 281-284.
[22] LAPARRA J M, SANZ Y. Interactions of gut microbiota with functional food components and nutraceuticals[J]. Pharmacological Research, 2010, 61: 219-225.
[23] BURNS A J, ROWLAND I R. Anti-carcinogenicity of probiotics and prebiotics[J]. Current Issues in Intestinal Microbiology, 2000, 1: 13-24.
[24] BIALONSKA D, RAMNANI P, KASIMETTY S G, et al. The influence of pomegranate by-product and punicalagins on selected groups of human intestinal microbiota[J]. International Journal of Food Microbiology, 2010, 140: 175-182.
[25] KAHKONEN M P, HOPIA A I, HEINONEN M. Berry phenolics and their antioxidant activity[J]. Journal of Agricultural and Food Chemistry, 2001, 49: 4076-4082.
[26] SCHOTSMANS W, MOLAN A L, MACKAY B. Controlled atmosphere storage of rabbiteye blueberries enhances postharvest quality aspects[J]. Postharvest Biology and Technology, 2007, 44: 277-285.
[27] BURNS A J, ROWLAND I R. Anti-carcinogenicity of probiotics and prebiotics[J]. Current Issues in Intestinal Microbiology, 2000, 1: 13-24.
