产β-葡萄糖苷酶真菌的筛选鉴定、纯化及酶学性质分析
2013-08-07郝伟伟王春梅韩学易
陈 静,郝伟伟,王春梅,陈 惠,*,吴 琦,韩学易
(1.四川农业大学生命科学与理学院,四川 雅安 625014;2.四川省华派生物制药有限公司,四川 简阳 641401)
β-葡萄糖苷酶(EC 3.2.1.21)又称纤维二糖酶,属于纤维素酶类,是一种能催化水解芳基或烃基与糖基原子团之间的糖苷键生成葡萄糖的酶[1]。作为纤维素酶水解纤维素过程中最后一步关键酶,把纤维二糖和短链的纤维寡糖分解为可利用的葡萄糖[2-3]。在水果、蔬菜、茶叶中,除含有萜烯醇类香气物质外,还有大量以无香味非挥发性的前体物——β-糖苷(单萜烯基-β-D-葡萄糖苷)的形式存在,β-葡萄糖苷酶能将其水解为具有浓郁天然风味的香气物质,以改良在加工、贮藏过程中对风味的影响。另外,β-葡萄糖苷酶可与其他风味酶协同作用释放出挥发性糖苷配基,起到增香作用,从而提高果汁品天然风味[4-6]。β-葡萄糖苷酶也可应用于生产低聚龙胆糖,低聚龙胆糖比麦芽糖浆具有更高的吸水性和较低的黏度,使食物中淀粉不易被老化;它不易被人体纤维素酶消化,并对双歧杆菌有增殖作用,可用于咖啡制品和巧克力制品中起味觉改良作用[7]。目前,食品工业中大多采用风味添加剂来增加食品的风味,β-葡萄糖苷酶可作为一种更健康更安全的食品添加剂。
1837年,β-葡萄糖苷酶首次在苦杏仁中发现。后经研究发现,β-葡萄糖苷酶普遍存在于如茶树这类植物[8]及白蚁、蚯蚓、蚂蚁这类昆虫中[9],另外在酵母、曲霉及细菌体内也广泛存在。目前,国内外用于研究的生产β-葡萄糖苷酶的微生物大多属于真菌,因为真菌和细菌以及放线菌相比较,真菌产β-葡萄糖苷酶多为胞外酶,分离纯化都更为方便,适用于固体培养和液体深层发酵。这为酶制剂的生产提供了有利的条件,也为大规模工业化生产奠定了基础。但β-葡萄糖苷酶的酶活力普遍很低,产量不高。因此,寻找一种新的产β-葡萄糖苷酶真菌是极其必要的。
1 材料与方法
1.1 样品采集
雅安市周公山海拔1500m处腐殖质土壤。
1.2 培养基
1)富集培养基:(NH4)2SO40.4g、MgSO4·7H2O 0.05g、NaCl 0.2g、CaCO30.4g、KH2PO40.1g、纤维二糖0.5g、链霉素适量。2)初筛培养基(马丁氏培养基):KH2PO41g、MgSO4·7H2O 0.5g、蛋白胨10g、葡萄糖10g、琼脂15~20g,用蒸馏水定容至1000mL,此培养液1000mL加1%孟加拉红水溶液3.3mL灭菌待用。3)复筛培养基(刚果红CMC-Na琼脂培养基)[10]:蛋白胨1g、酵母粉1g、CMC-Na 1g、NaCl0.5g、KH2PO40.1g、刚果红 0.02g、琼脂1.6g,蒸馏水定容至100mL,pH值自然。4)发酵产酶培养基[11]:麦麸粉2.0g、蛋白胨0.2g、Mandels无机盐营养液50mL。5) LB培养基:胰蛋白胨1%、NaCl 1%、酵母粉0.5%,pH7.0~7.5;配制固体培养基时需加入1.6%的琼脂粉。6) LB-Amp培养基:在LB培养基基础上加入100μg/mL的氨苄青霉素钠。
1.3 方法
1.3.1 菌株筛选
1.3.1.1 富集
称取5g土样至无菌三角瓶中,加入10倍无菌水振荡混匀,取5mL悬浮液于50mL富集培养基中,30℃、180r/min培养48h。
1.3.1.2 平板初筛
将富集后的培养液按10-2、10-3、10-4、10-5共4个梯度稀释,各取400μL涂布于初筛培养基上,30℃倒置恒温培养,直至出现单菌落。
1.3.1.3 平板复筛
将单菌落转接至刚果红CMC-Na琼脂培养基上,30℃倒置恒温培养96h,挑选有透明水解圈的菌落继续于刚果红CMC-Na琼脂培养基上划线培养,得到纯培养。
1.3.1.4 菌种保存
保存纯培养的菌株于PDA斜面培养基中,待进一步筛选。
1.3.1.5 酶活力测定
各挑取一环已筛选到的菌株于10mL发酵产酶培养基中,30℃、180r/min培养24h后,分别转接5mL种子液于50mL(250mL三角瓶)发酵产酶培养基中,30℃、180r/min培养96h。将发酵液于4℃、4000r/min离心10min,取上清测定β-葡萄糖苷酶酶活力[12]。
酶活力单位定义:1mL酶液在lmin内使底物产生1μmol还原糖(以葡萄糖计)所需的酶量为1个酶活力单位(U)。
1.3.2 菌株鉴定
1.3.2.1 菌株形态观察
在PDA固体培养基中30℃培养3d,观察其外部形态;采用插片培养法,显微镜下观察菌丝体形状、大小,孢子大小、形状、类型、颜色。
1.3.2.2 菌株分子生物学鉴定
采用r D N A I T S 基因序列分析,以提取的真菌的总DNA[13]为模板,采用ITS通用引物(ITS1:5’-TCCGTAGGTGAACCT-3’;ITS4:5’-TCCTCCGC TTATTGATATGC-3’)通过PCR扩增其ITS序列,反应程序为95℃预变性5min;95℃变性45s,50℃退火45s,72℃延伸2.5min,30个循环;72℃延伸5min。
PCR反应产物经琼脂糖凝胶电泳分离后,用Omega公司胶回收试剂盒回收目的DNA片段,DNA片段与pMD19-T Vector连接,并转化至DH5α感受态细胞,挑取阳性克隆送至北京诺赛生物技术有限公司测序。将测序结果通过BLAST程序与GenBank中核酸数据进行比对分析,选取同源性高的模式菌株的ITS rDNA序列,利用Clustal X和MEGA 4.0软件进行多序列比对,用Neighbor-Joining法构建系统发育树。
1.3.3 酶的分离纯化
发酵液经离心去沉淀,上清液用饱和度为60%的饱和硫酸铵沉淀,置于4℃,静置12h后,4℃、5000r/min离心10min,去上清。用醋酸盐缓冲液(pH4.8)溶解沉淀,溶解后的酶溶液放入透析袋经透析除盐,用Ba2+检验是否盐离子已除尽,使用聚乙二醇20000将酶溶液浓缩至1~2mL。上经20mmol/L、pH 4.8醋酸缓冲液平衡好的Sephadex G-100柱(45.0cm×Φ3.5cm),用平衡缓冲液洗脱,流速为1mL/min,每管收集3mL。收集活性峰,用透析袋除盐,聚乙二醇20000浓缩。在上以20mmol/L、pH4.8醋酸缓冲液预先平衡的DEAE Cellulose 52弱阴离子交换柱(28.0cm×Φ3.0cm),把20mmol/L、pH4.8醋酸缓冲液和0.5mol/L NaCl溶液分别置于磁力搅拌梯度混合器的A、B容器,形成0~0.5mol/L NaCl溶液,进行梯度洗脱,流速为1mL/min,每管收集3mL。收集活性峰,以透析袋除盐,聚乙二醇20000浓缩,放置4℃中保存,用于酶学性质研究。
1.3.4.1 蛋白含量测定
采用考马斯亮蓝G-250法测定。
1.3.4.2 β-葡萄糖苷酶酶活力测定
按1.3.1.5节所提方法进行测定[12]。
1.3.4.3 酶分子质量测定
采用SDS-PAGE法,4%浓缩胶,12%分离胶。
1.3.5 酶学性质分析
腊肉是一种腌制食品,具有较强的防腐能力,能长时间保存。壮族人喜欢制作和食用腊肉,每到春节前夕,各家各户都将刚宰杀好的新鲜猪肉制作成腊肉。对于住在偏远山区且条件艰苦的人们来说,腊肉既方便又实惠,逢年过节或招待客人时买些新鲜肉类配合腊肉,平时的荤食常以腊肉为主。
1.3.5.1 最适反应温度的测定
将适当稀释的酶液0.5mL与0.5mL水杨苷(0.5g/100mL、pH4.8)分别在30、40、50、60、70、80、90℃环境下反应20min,并测定各组酶活力。
1.3.5.2 热稳定性的测定
将适当稀释的酶液分别在30、40、50、60、70、80、90℃环境下保温1h,取0.5mL与0.5mL水杨苷(0.5g/100mL、pH4.8)混合,于55℃环境下反应20min,并测定各组酶活力。
1.3.5.3 最适反应pH值的测定
将适当稀释的酶液0.5mL与0.5mL 0.5g/100mL pH值分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0的水杨苷在55℃反应20min,测定各组酶活力。
1.3.5.4 pH值稳定性的测定
将酶液用pH值分别为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0的缓冲液稀释一定倍数,放置1h后,调节pH值至7.0,取0.5mL与0.5mL水杨苷(0.5g/100mL、pH4.8)在55℃反应20min,测定各组酶活力。
1.3.5.5 金属离子对β-葡萄糖苷酶活力的影响
粗酶液用含1mmol/L的K+、Ca2+、Na+、Mg2+、Mn2+、Ba2+、Fe3+、Fe2+、Zn2+、Li+、Ag+、Cu2+、Co2+醋酸缓冲液(0.1mol/L、pH4.8)稀释到一定倍数,以不加金属离子的缓冲液为空白对照。取0.5mL与0.5mL水杨苷(0.5g/100mL、pH4.8)在55℃反应20min,测定各组酶活力。
1.3.5.6 β-葡萄糖苷酶活力底物特异性
分别以羧甲基纤维素、微晶纤维素、纤维二糖、水杨苷为底物,溶解于0.1mol/L pH4.8醋酸缓冲液中为底物,质量浓度为0.5g/100mL。将适当稀释的酶液0.5mL与0.5mL底物缓冲液在55℃反应20min,测定各组酶活力。
1.3.5.7 动力学参数
将底物纤维二糖和水杨苷终浓度分别分别调到0.2、0.4、0.6、0.8、1.0mmol/L,按酶活力测定方法测定还原糖以计算酶反应的初速率。以底物浓度的倒数(1/[S])为横坐标,酶反应初速率的倒数(1/[V])为纵坐标,作Lineweaver-Burk双倒数图。
2 结果与分析
2.1 产纤维素酶菌株的筛选
经刚果红染色后,得到3株有透明光圈的菌株,命名为giF-2、giF-7、giF-10。经测定,其酶活力分别为0.903、0.714、2.522U/mL,其中菌株giF-10产纤维素酶活力最高,故下面选择菌株giF-10进行鉴定。
2.2 菌种鉴定
2.2.1 菌株菌落形态鉴定
菌株在PDA培养基上培养,生长很快,菌落质地疏松,初白色、黄色,后变为淡绿褐色,出现轮状的菌丝密实产孢区,见图1A。背面褐色。分生孢梗分枝较少,末端放射状,顶囊近球状,产生绿色孢子,孢子呈卵圆形。分生孢子壁光滑,菌丝体透明,如图1B。
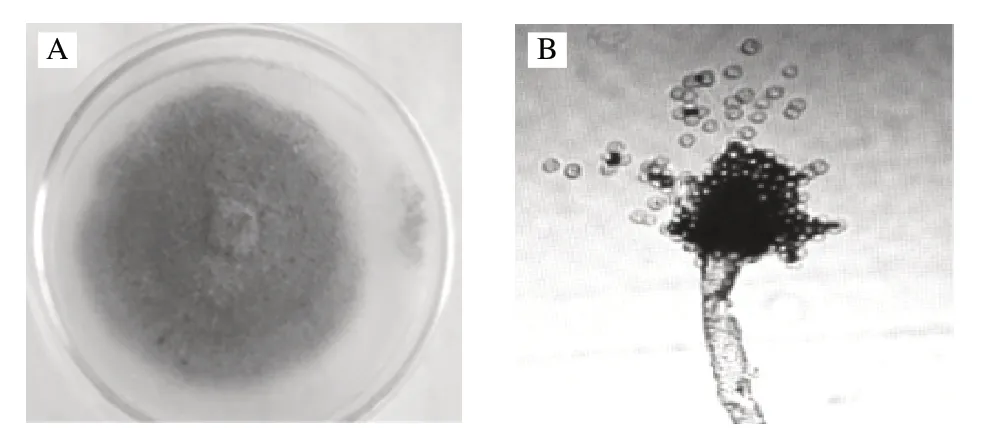
图 1 菌株giF-10的培养性状和形态Fig.1 Morphology and cultural characteristics of strain giF-10
2.2.2 分子生物学鉴定
PCR扩增得到长度为594bp的ITS序列,在NCBI上进行BLAST比对,giF-10 Aspergillus oryzae strain UPM A22同源性达99%,参考在GenBank的比对结果,利用MEGA4.0软件以Neighbor-Joining计算方式生成系统发育进化树,如图2所示,结合形态学观察结果与ITS分析结果,将真菌giF-10初步鉴定为米曲霉(Aspergillus oryzae)。

图 2 菌株giF-10的ITS系统发育树Fig.2 Phylogenetic tree of stain giF-10 and corresponding strains based on ITS sequence
2.3 酶的分离纯化
由图3可知,粗酶液经硫酸铵沉淀、Sephadex G-100凝胶层析、DEAE Cellulose 52离子交换层析得到了纯的β-葡萄糖苷酶,分子质量大约为90kD。从表1可以看出,活力损失较大的是在硫酸铵沉淀这一步,可能是因为在硫酸铵沉淀过程中局部盐饱和度过高造成酶蛋白失活,或者在蒸馏水中脱盐时间过长的缘故。β-葡萄糖苷酶最终纯化倍数为11.31。
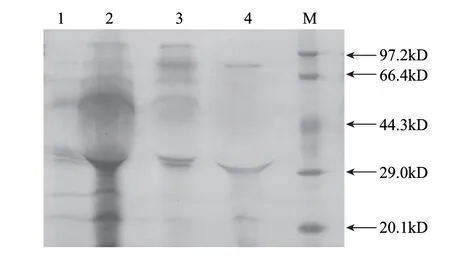
图 3 纯化产物的SDS-PAGE分析Fig.3 SDS-PAGE analysis of purified products
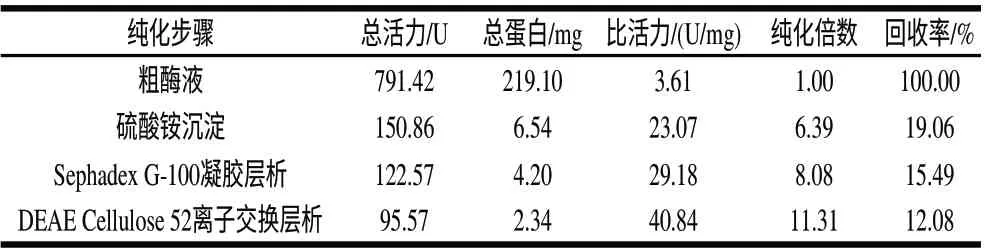
表 1 菌株giF-10产β-葡萄糖苷酶纯化结果Table 1 Purification of β-glucosidase from strain giF-10
2.4 酶学性质
2.4.1 酶的最适温度
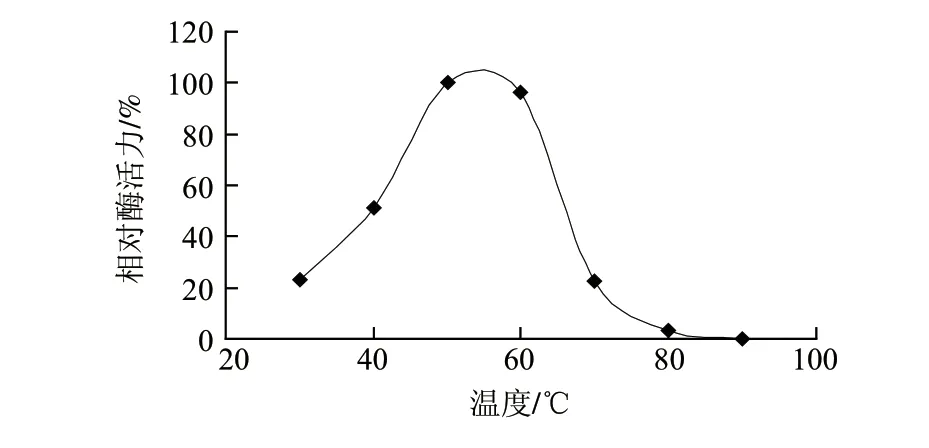
图 4 β-葡萄糖苷酶的最适温度Fig.4 Optimal reaction temperature of β-glucosidase
由图4可知,β-葡萄糖苷酶的最适温度约为55℃。温度低于55℃时,酶活力随温度的升高而增大;温度高于60℃时,酶活力随温度的升高而降低。温度高于80℃时酶已近全部失活。
2.4.2 酶的热稳定性
由图5可知,β-葡萄糖苷酶在30~50℃稳定性最好,温度超过50℃,酶活力急剧下降,60℃时酶活仅为最高酶活力的9%。
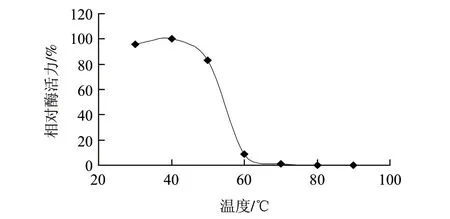
图 5 β-葡萄糖苷酶的热稳定性Fig.5 Thermal stability of β-glucosidase
2.4.3 酶的最适pH值
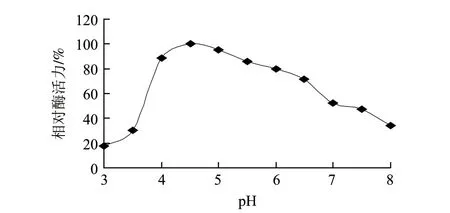
图 6 β-葡萄糖苷酶的最适pH值Fig.6 Optimal pH of β-glucosidase
由图6可知,β-葡萄糖苷酶的最适pH值为4.5。在pH4.0~6.0范围内,酶活性较好;当pH值低于4.0时,酶活力迅速降低;pH3.0环境下,β-葡萄糖苷酶活力仅为最适pH值条件下的17.8%;pH值高于6.0时,酶活力随pH值的升高而降低;当pH值升至8.0时,酶活力降为最高酶活力的34.1%。
2.4.4 酶的pH值稳定性
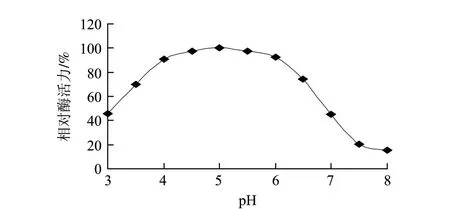
图 7 β-葡萄糖苷酶的pH值稳定性Fig.7 pH stability of β-glucosidase
由图7可知,β-葡萄糖苷酶的pH值稳定性较好,在pH4.0~6.0范围内酶活力可达最高酶活的90%以上。当pH值低于4.0时,酶的稳定性随着pH值的降低而降低,在pH3.0的缓冲液中处理1h,酶活力还有最高酶活力的49.5%;当pH值高于6.0时,酶稳定性随着pH值的升高而降低,在pH8.0的缓冲液中处理1h,酶活力仅为最高酶活力的15.2%。
2.4.5 金属离子对β-葡萄糖苷酶活力的影响
缓冲体系中加入1mmol/L的离子后,对β-葡萄糖苷酶酶活性产了一定影响。由表2可知,Mn2+对β-葡萄糖苷酶活力有很强的激活作用,加入Mn2+后,β-葡萄糖苷酶活力为对照的238%。Fe2+、Ag+、Zn2+、Co2+对酶活力也有一定的激活作用。而Fe3+、Cu2+对β-葡萄糖苷酶活力有较强的抑制作用,使得酶活力仅为对照的6%、39%。K+对β-葡萄糖苷酶也有一定的抑制作用。Ca2+、Mg2+、Ba2+、Li+、Co2+、Na+对酶活力影响不明显。
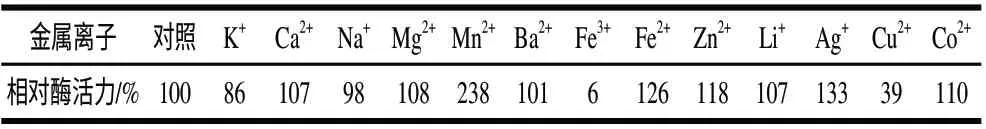
表 2 金属离子对β-葡萄糖苷酶活力影响Table 2 Effect of metal ion on β-glucosidase activity
2.4.6 酶的底物特异性
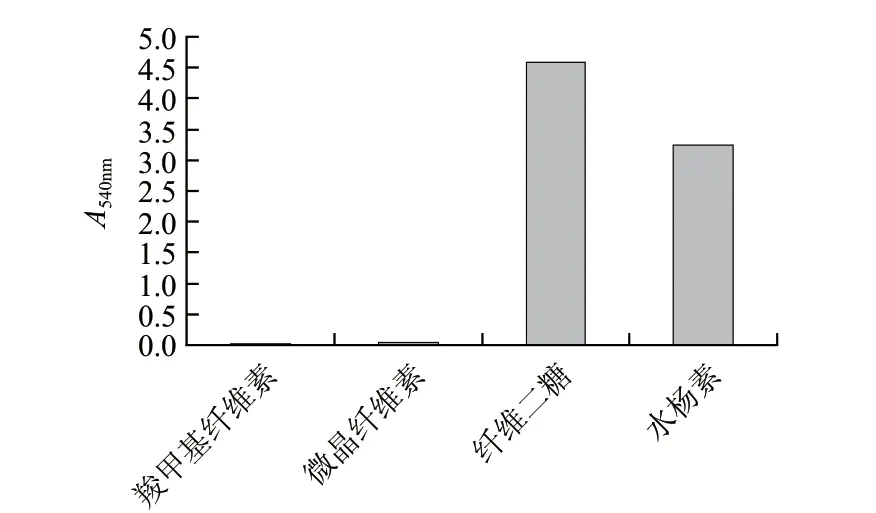
图 8 β-葡萄糖苷酶的底物特异性Fig.8 Substrate specificity of β-glucosidase
由图8可知,β-葡萄糖苷酶对不同纤维素底物具有不同的分解能力。它不能分解羧甲基纤维素和微晶纤维素。但对纤维二糖和水杨素的特异性很高。
2.4.7 动力学参数
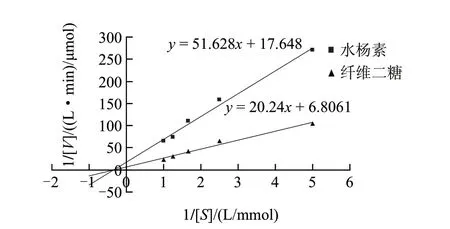
图 9 β-葡萄糖苷酶的双倒数图Fig.9 Lineweaver-Burk plot of β-glucosidase
由图9可知,利用双倒数作图法,分别测得该β-葡萄糖苷酶对水杨素的动力学参数:Km为0.676mmol/L,Vmax为0.0206μmol/(L·min);对纤维二糖的动力学参数为:Km为2.906mmol/L,Vmax为0.138μmol/(L·min)。
3 结论与讨论
本研究采用以CMC-Na为唯一碳源的选择培养基富集,并利用刚果红平板染色法进行高效纤维素降解细菌的初筛,可以根据菌落周围透明晕圈迅速捕获目的菌株。β-葡萄糖苷酶的酶活力确证筛选菌株,获得了1株高效纤维素降解菌giF-10,其酶活力为2.522U/mL。该酶酶活力高于一般报道[14],具有研究价值。
菌株giF-10的形态特征与曲霉相似,通过ITS序列分析,构建系统发育树可确定菌株giF-10为米曲霉(Aspergillus oryzae)。目前国内以米曲霉为纤维素酶的产生菌的报道较少。米曲霉是美国食品与药物管理局和美国饲料公司协会在1989年公布的40余种安全微生物菌种之一[15],由于高安全性,其产物酶的应用范围将非常广范,尤其在食品领域将具备较大应用前景。目前,对该酶的研究多以木霉(Trichoderma)为主,但木霉产酶慢,酶系比活力不高,普遍存在β-葡萄糖苷酶酶活力很低的缺陷[16]。有研究者[17]在木霉纤维素酶中添加曲霉的β-葡萄糖苷酶,极大地提高了纤维素酶的降解能力。并且,曲霉中β-葡萄糖苷酶具有更高的活性和稳定性。
本研究表明,纯化后的β-葡萄糖苷酶最终纯化倍数为11.31,纯化酶的比活力为40.84U/mg。相比黑曲霉中β-葡萄糖苷酶的最终纯化倍数8.42,酶的比活力65.06U/mg[18],本研究的纯化倍数较高,但酶活力较低,可能是在硫酸铵沉淀过程中β-葡萄糖苷酶损失较多。经SDS-PAGE分析,β-葡萄糖苷酶分子质量约为90kD,菌株A.oryzae sp.100的β-葡萄糖苷酶分子质量为77kD[19],分子质量的不同可能是表达调控的不同造成的。该酶最适pH值为4.5,在pH4.0~6.0稳定性较好,活力均可达最高酶活的90%以上。说明β-葡萄糖苷酶在酸性条件下活性高且较为稳定,因此该酶适合在酸性介质中应用,如添加在果汁、果酒等果制品中作为风味剂。但其热稳定性较差,需进一步运用基因工程手段对其进行改造,以获得热稳定性提高的工程菌。
酶是一种蛋白质,它的催化效果受诸多因素影响。本研究中Mn2+、Fe2+、Ag+、Zn2+、Co2+对β-葡萄糖苷酶有不同程度的激活作用,特别是Mn2+可以使酶活提高1.38倍,这些激活剂可能是作为酶的辅酶存在,或者形成共价物,使底物更加易参加反应;Fe3+、Cu2+对β-葡萄糖苷酶活力有抑制作用,可能是这些金属离子引起了酶构象的改变,使酶丧失了部分生物活性。根据文献[20]报道来源于曲霉N0.5.1的β-葡萄糖苷酶,K+、Na+、Mg2+和Zn2+对其有激活作用,而Ag+和Fe2+对其具有明显的抑制作用。来自黑曲霉(Aspergillus sp. NL-1)的β-葡萄糖苷酶,Ag+对该酶具有强的抑制作用,其他金属离子对酶的活性影响不大[21]。不同金属离子对酶活力的影响不同,离子对酶活力的影响作用可应用于酶制剂的加工和处理中,用以保持酶的稳定性。
[1] Edwin Clifford Webb. Enzyme nomenclature: recommendations of the nomenclature committee of the international Union of biochemistry and molecular biology on the nomenclature and classification of enzymes[M]. San Diego: Academic Press, 1992: 310.
[2] 曾青兰. 纤维素酶研究进展[J]. 现代农业科学, 2007(6): 42-46.
[3] 邬敏辰, 郑建丰. 黑曲霉液体发酵纤维素酶的研究[J]. 酿酒科技, 1998(3): 25-28.
[4] 宛晓春, 汤坚, 丁霄霖. 黑曲霉β-葡萄糖苷酶的提纯与性质[J]. 菌物系统, 1998, 17(2): 154-159.
[5] 陶宁萍. 苦杏仁酶在纯天然青梅果汁中的应用[D]. 南京: 南京农业大学, 1993.
[6] 李平, 宛晓春, 丁霄霖, 等. 黑曲霉β-葡萄糖苷酶的食品增香应用[J] . 食品与发酵工业, 2000, 26(2): 5-6; 32.
[7] 陈士华, 耿瑞凡, 雪珍, 等. 黑曲霉bgl基因在毕赤酵母中的研究表达[J]. 河南工业大学学报: 自然科学版, 2010, 31(5): 42-45.
[8] 赵丽萍, 陈亮, 王新超, 等. 茶树新梢不同叶片中β-葡萄糖苷酶和β-樱草糖苷酶基因表达的实时定量PCR[J]. 茶叶科学, 2006, 26(1): 11-16.
[9] MORA P, MIAMBI E, JIMENEZ J J, et al. Functional complement of biogenic structures produced by earthworms, termites and ants in the neotropical savannas[J]. Soil Biology & Biochemistry, 2005, 37: 1043-1048.
[10] 张苏龙, 吕淑霞, 林英, 等. 一株产纤维素酶真菌的筛选、鉴定及酶学性质初步研究[J]. 微生物学杂志, 2009, 29(3): 72-76.
[11] 朱凤妹, 杜彬, 刘长江, 等. β-葡萄糖苷酶产生菌摇瓶发酵条件的研究[J]. 食品科学, 2008, 29(8): 422-424.
[12] WANG Fengchao, LI Fan, CHEN Guanjun, et al. Isolation and characterization of novel cellulase genes from uncultured microorganisms in different environmental niches[J]. Microbiological Research, 2009, 164(6): 650-657.
[13] 孙立夫, 张艳华, 裴克全. 一种高效提取真菌总DNA的方法[J]. 菌物学报, 2009, 28(2): 299-302.
[14] 赵林果, 周潭澈, 盂鹏. β-葡萄糖苷酶产生菌的筛选及其所产纤维素酶酶系组成分析[J]. 工业微生物, 2007, 37(5): 47-50.
[15] 朱婧, 覃拥灵, 陈桂光, 等. β-葡萄糖苷酶高产菌株的选育及酶法转化葡萄糖生产龙胆低聚糖[J]. 食品与发酵工业, 2010, 36(4): 21-25.
[16] WEN Zhiyou, LIAO Wei, CHEN Shulin. Production of celluloae/β-glucosidase by the mixed fungi culture and on dairy manure[J]. Precess Biochemistry, 2005, 40: 3087-3094.
[17] 潘利华, 罗建平. β-葡萄糖苷酶的研究及应用进展[J]. 食品科学, 2006, 27(12): 803-807.
[18] 郑淑霞, 沈志扬, 刘树滔, 等. 黑曲霉发酵粉中一种β-葡萄糖苷酶的分离纯化与表征[J]. 福州大学学报: 自然科学版, 2004, 32(1): 101-105.
[19] ZHANG Chunzhi, LI Dai, YU Hongshan, et al. Purification and characterization of piceid-β-D-glucosidase from Aspergillus oryzae[J]. Process Biochemistry, 2007, 42: 83-88.
[20] 谢宇, 尚晓娴, 胡金刚. β-葡萄糖苷酶纯化及酶学性质研究[J]. 江西农业大学学报, 2008(3): 521-524.
[21] 赵林果, 游丽金, 孟鹏, 等. 黑曲霉胞外耐高糖β-葡萄糖苷酶的分离纯化及部分特性研究[J]. 林产化学与工业, 2007, 27(6): 41-47.
