脐橙新型壳聚糖水凝胶抑菌保鲜研究
2013-08-07李瑶瑶李喜宏邓玉璞刘丹舟
李瑶瑶,李喜宏,* ,邓玉璞,刘丹舟,李 琪
(1.天津科技大学食品工程与生物技术学院,天津300457;2.北京林业大学,北京100083)
脐橙含有丰富的维生素、黄酮类化合物等防癌物质,是优良的营养保健绿色食品,是鲜食品种中的“柑桔之王”[1]。但是在贮藏期间,脐橙极易被青霉菌所感染[2-3]而造成腐烂,严重影响果实品质和商品价值,大大降低了脐橙的利用率,制约了我国脐橙鲜果供应及果汁加工产业的发展。目前,虽然可以采用化学方法对青霉菌引起的病害进行有效控制,但果实的食用安全性却倍受争议[4]。水凝胶是一类具有三维网络结构的高分子聚合物,由亲水性的高分子化合物交联而成,能在水中溶胀并保持原有结构而不被溶解[5]。壳聚糖(chitosan,简称CTS),又称几丁聚糖,其化学结构与纤维素类似,广泛存在于真菌的细胞壁及虾、蟹等甲壳类动物的外壳中[6]。由于原料来源广泛,廉价易得,且具有良好的生物相容性、安全性和生物降解性,被广泛应用于果蔬的贮藏保鲜领域。然而,纯壳聚糖凝胶性质很不稳定,随介质变化而变化。聚乙烯醇(polyvinyl alcohol,简称PVA)溶于水,且具有高度的生物相容性,其粘连机制也被Paradossi 等人[7]所证实。壳聚糖水凝胶综合了壳聚糖和聚乙烯醇二者的优点[8],作为吸附蛋白质的药物[9]及软骨组织工程支架材料[10]被广泛应用。目前,壳聚糖及水凝胶被广泛应用于果蔬贮藏保鲜领域,然而,有关二者的混合体壳聚糖水凝胶在该领域的报道却很罕见。本研究通过分析比较不同浓度的壳聚糖水凝胶对脐橙采后青霉菌的抑制作用,得出最佳抑制浓度,以期在达到脐橙保鲜效果、延长货架期的同时为脐橙采后生理及贮藏技术提供理论依据。
1 材料与方法
1.1 材料与仪器
供试脐橙 采摘于云南省建水县,由红河州和源农业开发有限公司提供。2012 年11 月25 日运抵天津科技大学农产品保鲜实验室。果实呈椭圆形,果皮浅黄色,色泽均匀,果面光滑。挑选七八成熟、大小均匀、无病虫害且无机械损伤的果实进行实验;壳聚糖(脱乙酰度≥85%) 济南海得贝细胞生物工程有限公司;PVA(聚合度:1750 ±50) 天津元丽化学试剂有限公司;50%戊二醛 青岛正浩化学试剂股份有限公司。
电子天平奥豪斯仪器(上海)有限公司;C21-SN216多功能电磁炉 广东美的生活电器制造有限公司;HHS-6S 电子恒温不锈钢水浴锅 上海宜昌仪器纱筛厂;WH7401-50B 型电动搅拌器 天津市威华仪器设备有限公司;WH-3 微型漩涡混合仪 上海沪西分析仪器厂有限公司;TEZ-PS-100W荧光倒置显微镜 北京中翰仪器有限公司。
1.2 实验方法
1.2.1 溶液配制 PDA 培养基:去皮马铃薯300g,切成小块加水煮沸30min,双层纱布过滤,滤液加葡萄糖20g,琼脂20g,定容至1000mL,121℃灭菌20min。
壳聚糖水凝胶的制备:壳聚糖水凝胶的制备参考杨旭东等的方法[11]并加以修改,将壳聚糖经2%醋酸溶解配制成1.0%、1.5%、2.0%、2.5%、3.0%溶液,过滤掉不溶杂质;将PVA 在80~85℃溶解成5%溶液;电动搅拌并加热至40 ~50℃,使100mL 1.0%、1.5%、2.0%、2.5%、3.0%壳聚糖和5mL 5%PVA 混合均匀,然后加入1.12mL 3% 戊二醛搅拌均匀,并在40~45℃静置交联,室温下静置24h 成膜。
1.2.2 菌种分离、纯化与鉴定及回接 参考杨韦杰等的方法[12]并加以修改,选择具有典型发病症状的脐橙,根据病健交界处分离原则,以75%酒精清洗患处,用无菌刀片切取病健交界处5mm ×5mm2的组织,于超净台转入PDA 平板培养基上,于28℃恒温恒湿培养箱中倒置培养。当培养出的菌落直径生长至1cm 时,用灭菌后的接种针挑取前缘菌丝植入另一培养基内培养,重复上述操作3 次即可获得纯化菌株。将纯化菌株回接到果实,按照柯赫氏法则(Koch’s postulates),通过肉眼观察致病菌菌落特征和培养特征,包括菌落大小、颜色、质地、边缘、渗出物等,显微镜下观察分生孢子及分生孢子梗形态特征,参照植物病原真菌学[13]、普通真菌学[14]及真菌鉴定手册[15]进行病原菌的鉴定。按上述方法将青霉菌分离出来,继续培养后,取健康脐橙表皮,采用针刺法,在超净工作台内用灭菌针刺伤表皮0.5 ~1.0cm2,待PDA 培养基上长满菌丝后,用无菌打孔器打下菌块,使菌丝面贴在刺伤处,然后将其放入底层有吸水纸、中间有载玻片的灭菌培养皿中,加适量无菌水,28℃恒温培养。待观察出现症状后再按原方法分离、纯化返接后的病原菌,观察是否与原致病菌一致。
1.2.3 离体抑菌实验 参考刘锋等[16]方法并加以修改,取1.0%、1.5%、2.0%、2.5%、3.0%的壳聚糖水凝胶溶液1mL 分别加入9mL 加热融化后约50℃的PDA 培养基中,混匀后倒入培养皿中制成含体积分数为10%的壳聚糖水凝胶平板,以等量未加入壳聚糖的水凝胶作为对照。将长势均匀的病原菌沿菌落边缘用直径为5mm 的打孔器打大小相同的菌块,分别接种于上述培养基中,每皿放置1 块,将培养皿置28℃恒温恒湿培养箱中培养。每个处理重复三次。每天观察记录(共5d),并用十字交叉法测量各皿中菌落直径,计算抑菌率。参照张悦等的方法[17]计算抑菌率。

1.2.4 牛津杯法抑菌实验 参照刘冬梅等的方法[18]并加以调整,将受试菌体分别接种于含有马铃薯葡萄糖液体培养基的试管中,每个受试菌种接种3 支。100r/min 震荡摇床中37℃恒温活化24h,得到一定浓度的菌液。将活化后的菌种先用无菌水洗下菌苔,用血球计数板计数孢子浓度,制成2.4 ×106 个/L孢子悬浮液,备用。于无菌操作条件下,在平皿中心放置灭菌过的直径为8mm 的牛津杯,用无菌移液枪吸取0.5mL 菌悬液置于平皿中涂布均匀,再倒入10mL PDA 培养基,待培养基凝固后,用无菌移液枪分别移取50μL 含量为1.0%、1.5%、2.0%、2.5%、3.0%的壳聚糖水凝胶抑菌液置于牛津杯中,注意不要将菌悬液溢出牛津杯外。以无菌水为对照,将制好的平板置于恒温恒湿培养箱中28℃下培养5d 后用十字交叉法测量抑菌部分直径大小。每个处理重复三次。抑菌圈计算公式:

1.2.5 涂膜实验 参照胡云峰等的方法[19]并加以调整,将浓度为1.0%、1.5%、2.0%、2.5%、3.0%的壳聚糖水凝胶均匀涂于健康脐橙表皮,置于(4 ±0.1)℃的温度梯度箱中贮藏,相对湿度为85%~90%,每个处理15kg,90d 后观察脐橙外观品质并测定失重率、还原糖、可溶性固形物等指标。
可溶性固形物(SSC)含量:用ATAGO 袖珍数字式白利度折光仪(Digital Pocket Brix Refractometer(cat.No.3840 PAL-α))测定,重复5 次,取平均值;可滴定酸(TA)含量:用酸碱滴定法测定,采用苹果酸当量值表示;还原糖含量:采用3,5-二硝基水杨酸法测定;失重率:采用直接称量法测定;好果率:采用观察法测定(实验以果实表皮出现水渍斑定为腐烂果)。
失重率(%)= (贮藏前的重量-贮藏后的重量)/贮藏前的重量×100

1.3 统计分析
全部实验数据用Microsoft Excel 2007 进行统计处理,计算标准偏差(¯X ±SE);并使用DPS7.55 数据处理系统进行方差分析。
2 结果与分析
2.1 青霉菌的鉴定及回接
青霉菌菌落呈绒状,生长较快,初期菌丝体为白色,有粘性,随培养时间的延长,呈同心环状青绿色霉层,边缘白色(图1)。在显微镜下观察,营养菌丝体呈透明,分生孢子梗(图2)和菌丝(图3)均有横隔,较光滑。分生孢子梗先端有1~3 个分枝,呈扫帚状。分生孢子无色,近球形,呈念珠状串生。对照《植物病原真菌学》、《普通真菌学》、《真菌鉴定手册》等,初步鉴定该病原菌为子囊菌亚门(Ascomycotina),不整囊菌纲(Plectomycetes),散囊菌状目(Eurotiales),散囊菌科(Eurotiaceae),青霉属(Penicillium)。将菌种回接,该病原菌侵染健康脐橙表皮后,最初在菌侵部位周围形成深褐色水渍状,边缘不明显,之后长出白色菌丝,慢慢形成青色霉层,边缘有白边环,不整齐,水渍斑不断扩展,最终浸染整块表皮。将该病原菌分离、纯化,也得到与回接实验前相同的病原菌。

图1 PDA 培养基上青霉菌菌落Fig.1 Colony of Penicillium italicum on PDA medium
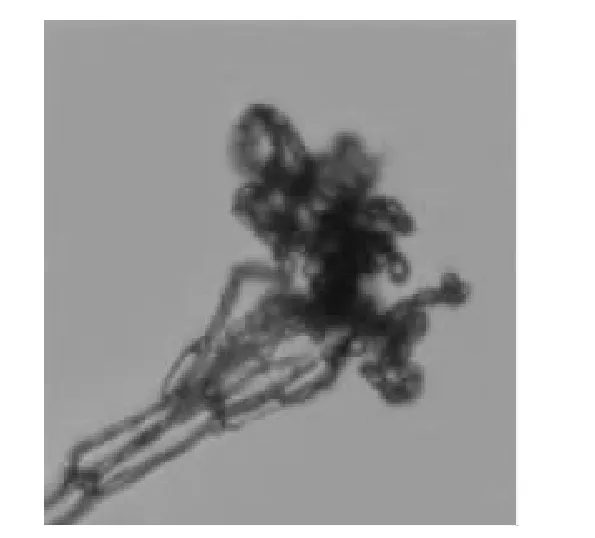
图2 青霉菌分生孢子梗和分生孢子Fig.2 Conidiophore and seminula of Penicillium italicum
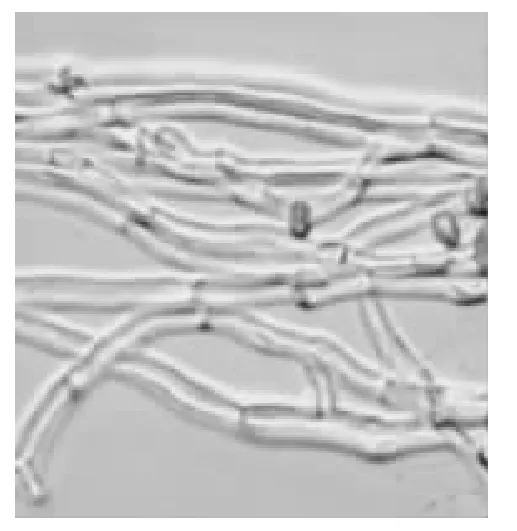
图3 青霉菌菌丝Fig.3 Hyphae of Penicillium italicum
2.2 不同浓度壳聚糖水凝胶对青霉菌菌落直径大小的影响
菌落直径的大小直接反映了壳聚糖水凝胶对青霉菌的抑制情况。壳聚糖水凝胶明显抑制了青霉菌的生长。青霉菌边缘白色菌丝变短,菌落直径变小。由图4 可看出,在培养的第5d,CK 菌落直径为22mm,大于其它处理,差异显著(p <0.05)。当壳聚糖水凝胶浓度由1.0%逐渐增大时,青霉菌的菌落直径逐渐减小,当增至2.0% 时菌落直径达到最小值15mm,然后随其浓度的增加,菌落直径又逐渐增大。由于壳聚糖具有生物降解性,且其代谢产物可被生物体完全吸收[20]。当壳聚糖水凝胶浓度增大时,壳聚糖降解后促进了青霉菌的生长,使菌落直径增大。说明当壳聚糖水凝胶浓度为2.0%时,对青霉菌的抑制效果最好。
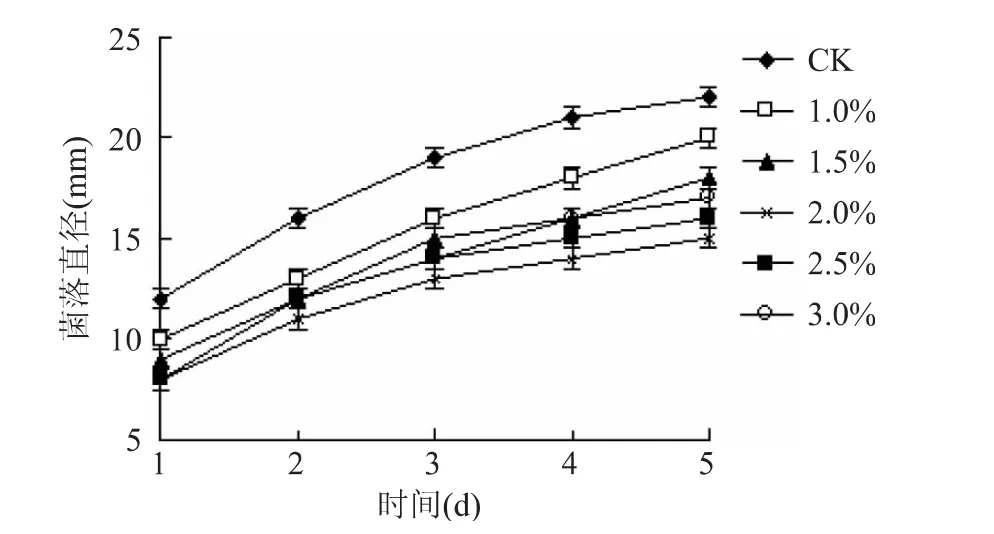
图4 不同浓度壳聚糖水凝胶对青霉菌菌落直径的影响Fig.4 Effect of different concentrations of chitosan hydrogel on the colony diameter of Penicillium italicum
2.3 不同浓度壳聚糖水凝胶对青霉菌抑菌率的影响
由图5 可以看出,将接种菌饼后的培养基置于恒温恒湿培养箱中培养1d 后,1.0%壳聚糖水凝胶抑菌率最低,仅为30%,随浓度增大,抑菌率增大,但当浓度大于2.0%时,抑菌率不再提高。培养2d 后,从图中可以明显看出,1.0%壳聚糖水凝胶抑菌率最低,2.0%抑菌率最高。培养前两天,1.5%、2.5%和3.0%这三组差异不显著(p >0.05),但随着培养时间的增长,差异性逐渐显著(p <0.05)。当壳聚糖水凝胶浓度为2.0%时抑菌率最高,但随着培养时间的增长,抑制效果减弱。这是由于随着时间的延长,青霉菌对生长环境逐渐适应,对壳聚糖水凝胶的抵抗力逐渐增大。

图5 不同浓度壳聚糖水凝胶对青霉菌抑菌率的影响Fig.5 Effect of different concentrations of chitosan hydrogel on the inhibiting rate of Penicillium italicum
2.4 不同浓度壳聚糖水凝胶对青霉菌抑菌圈大小的影响
当向牛津杯中加入壳聚糖水凝胶后,一方面青霉菌开始生长,另一方面,抑菌物质就随溶剂向培养基内呈球形扩散,离杯越近,抑菌物质浓度越大,离杯越远,抑菌物质浓度越小。图6 表明,CK 没有抑菌圈,与壳聚糖水凝胶处理组呈显著差异(p <0.05)。当壳聚糖水凝胶浓度为1.0% 时,抑菌圈直径为5mm,1.5%时直径为19mm,随着浓度增大,抑菌圈增大,当浓度为2.0%时,抑菌圈达到最大值65mm,然后随其浓度的增大,抑菌圈减小,且当浓度大于2.0%时,抑菌圈内部长满青霉菌。这可能是由于当壳聚糖水凝胶浓度增大时,壳聚糖含量增加,醋酸含量相对减少,使得其pH 升高,抑菌作用降低[21]。同时,由于壳聚糖本身溶解性较差,浓度多高时导致其自身絮凝,使壳聚糖水凝胶有效抑菌物质浓度降低,达不到理想的贮藏保鲜效果。说明当壳聚糖水凝胶浓度为2.0%时,有效抑菌物质浓度最高,时效最长,抑制效果最好。

表1 壳聚糖水凝胶浓度对脐橙品质及外观的影响Table1 Effect of chitosan hydrogel on the quality and appearance of Navel orange

图6 不同浓度壳聚糖水凝胶对青霉菌抑菌圈大小的影响Fig.6 Effect of different concentrations of chitosan hydrogel on the inhibiting zone of Penicillium italicum
2.5 不同浓度壳聚糖水凝胶对脐橙贮藏效果的影响
由表1 可知:五种不同浓度的壳聚糖水凝胶处理的脐橙果实表面饱满,颜色鲜亮。1.0%时果皮锈斑较多,1.5%时较少,2.5%果实出现白斑点,3.0%时白斑点增多,而浓度在2.0% 时能够较好地保持外观,不出现锈斑和白斑点,且失重率降低30%,好果率提高80%左右。相比之下,对照组果皮皱缩且无光泽,有锈斑。结果表明,当壳聚糖水凝胶浓度为2.0%时对脐橙的贮藏效果最好。
3 结论
以纽荷尔脐橙为试材,分离纯化青霉菌,分析比较1.0%、1.5%、2.0%、2.5%、3.0%壳聚糖水凝胶对脐橙采后青霉菌的抑制效果。离体抑菌实验表明,当用壳聚糖水凝胶处理后,青霉菌的菌落直径明显减小,且当浓度为2.0%时,菌落直径达到最小值,抑菌率达到最大值。牛津杯法抑菌实验表明,壳聚糖水凝胶的浓度决定了抑菌圈的大小,当浓度为2.0%时,抑菌圈最大。涂膜实验中,综合失重率、好果率、可溶性固形物、可滴定酸、还原糖及脐橙外观各项指标确定,当浓度为2.0% 时,脐橙的贮藏品质较好。通过以上实验,可以确定当壳聚糖水凝胶浓度为2.0%时,可以较好的抑制青霉菌的生长,减少脐橙的腐烂率,进而延长其保鲜期。
[1]张倍宁,王迎,刘建南,等.姜黄素对脐橙保鲜作用的研究[J].农业机械·粮油加工,2012(18):143-145.
[2]胡佳羽,李鹏霞,王炜,等.我国脐橙生产发展现状及保鲜技术研究概况[J].江苏农业科学,2008(3):10-13,85.
[3]胡正月,李民全,胡美蓉,等.几种防腐剂对脐橙贮藏防腐保鲜效应研究[J].江西园艺,2000(5):16-17.
[4]张维一,毕阳.果蔬采后病害与控制[M].北京:农业出版社,1996,3.
[5]江磊,林宝凤,梁兴泉,等.壳聚糖及其衍生物水凝胶的研究进展[J].化学通报,2007(1):47-51.
[6]马鹏鹏,何立千.壳聚糖对植物病害的抑制作用研究进展[J].天然产物研究与开发,2001,13(6):82-85.
[7]G Paradossi,R Lisi,M Paci,et al.New chemical hydrogels based on poly(vinyl alcohol)[J].Journal of Polymer Science Part A:Polymer Chemistry,1996,16(34):3417-3425.
[8]Krishna N,Brow F. Polyvinyl alcohol as an ophthalmic vehicle:effect on regenerationof corneal epithelium[J].Am J Ophthalmol,1964,57:99-106.
[9]Wan Ngah,W S,Kamari,et al.Equilibrium and kinetics studies of adsorption of copper(II)on chitosan and chitosan/PVA beads[J].International Journal of Biological Macromolecules,2004,34:155-161.
[10]郝彤,刘暾,吕双红,等.采用温敏性壳聚糖水凝胶体外构建组织工程化软骨的实验研究[J].解放军医学杂志,2007,32(5):500-502.
[11]杨旭东,吴国杰,林玩金.壳聚糖水凝胶的制备及性能研究[J].化工新型材料,2005,33(12):48-50.
[12]杨韦杰,徐玉娟,唐道邦,等.荔枝干微生物菌落分析及其霉菌的分离鉴定[J].食品工业科技,2012,33(5):152-155.
[13]张中义,冷怀琼,张志铭,等.植物病原真菌学[M].成都:四川科学技术出版社,1988:347-378.
[14]邢来君,李明春.普通真菌学[M].北京:高等教育出版社,1999:416-426.
[15]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[16]刘锋,陈明,陈金印.壳聚糖对纽荷尔脐橙果实采后青霉病菌的抑制作用研究[J].江西农业大学学报,2010,32(3):0489-0492.
[17]张悦,陈子牛,李丹,等.6 种植物粗提物对海棠花灰霉菌的抑制效果[J].安徽农业科学,2012,40(1):259-260.
[18]刘冬梅,李理,杨晓泉,等.用牛津杯法测定益生菌的抑菌活力[J].食品研究与开发,2006,27(3):110-111.
[19]胡云峰,邢亚阁,封丽,等.含纳他霉素天然保鲜果蜡的制备与应用[J].农业机械学报,2009,40(3):139-142.
[20]冯小强,杨声,苏中兴,等.低聚壳聚糖降解制备、分离、纯化、鉴别的研究进展[J].高分子通报,2006(7):82-89.
[21]吴小勇,曾庆孝,阮征,等.壳聚糖的抑菌机理及抑菌特性研究进展[J].中国食品添加剂,2004(6):46-49,68.
