汉麻叶总黄酮提取工艺研究
2013-08-07郝利民张国君王宗臻郝新敏鲁吉珂张建春
郝利民,张国君,王宗臻,郝新敏,鲁吉珂,3,张建春
(1.总后军需装备研究所军用汉麻材料研究中心,北京100027;2.宁波宜科科技实业股份有限公司,浙江宁波315153;3.郑州大学生命科学学院,河南郑州450001)
汉麻(China-hemp)为木兰纲(Magnoliopsida)荨麻目(Rosales)大麻科(Cannabaceae)大麻属(Cannabis)大麻种(Cannabis sativa L.)一年生草本植物,又称大麻,线麻,火麻等[1]。汉麻可在丘陵、山坡、滩涂等荒地种植,不与粮、棉、油争地,其抗自然灾害能力强,各种气候均可实现稳产[2]。汉麻全身都是宝,主要有纺织、食用和药用三大功能。汉麻皮富含纤维,可用于服装及各种饰品加工;汉麻杆芯是极佳的木材替代品,还可用来生产超微粉;汉麻籽富含优质蛋白以及人体必需脂肪酸,可应用于食品、保健品等领域[3-5];汉麻叶中富含多种活性物质[1,6],如大麻酚类、胆碱、齐墩果酸、齐墩果烯和黄酮类等。其中黄酮类化合物具有免疫激活、抗氧化、抗肿瘤、抑菌抗病毒、抗心脑血管疾病、降血压等作用,具有较高的药用价值[7-8]。目前总黄酮提取主要以银杏叶为原料,前期初步分析表明,汉麻叶中总黄酮的含量也较高。从汉麻叶中提取总黄酮既可拓展植物黄酮的来源,也可提升汉麻加工品的附加值,完善汉麻产业链并有利于汉麻资源的综合利用。目前,黄酮类化合物的提取方法主要有溶剂提取法、微波辅助提取法、超声辅助提取法、酶解法、超临界流体萃取法、双水相萃取分离法等[9]。超临界流体萃取等方法虽然具有提取效率高、无溶剂残留、无毒等优点,但存在设备要求高,成本高等问题[10]。微波辅助提取法要考虑微波穿透物质内部时衰减的问题;溶剂萃取法选择性高,产品收率高,但其提取时间较长,提取效率不高。本文分别采用乙醇溶剂法和超声辅助法,对汉麻叶总黄酮的提取工艺进行优化,以探寻汉麻叶总黄酮的最适提取条件。
1 材料与方法
1.1 材料与仪器
干燥汉麻叶 来自云南工业大麻股份有限公司;芦丁标品 购于中国药品生物制品检定所;乙醇、亚硝酸钠、硝酸铝、氢氧化钠 均为分析纯。实验动物 ICR 小鼠(20~24g),雌雄各半(6 周龄),由南京市江宁区青龙山动物繁殖场提供。
KQ-500B 型超声波清洗器 昆山市超声仪器有限公司;UV-2450 型紫外可见分光光度计 日本岛津公司;SHZ-D(Ⅲ)型循环水式多用真空泵 巩义市予华仪器有限责任公司。
1.2 实验方法
1.2.1 汉麻叶浸膏急性毒性实验 汉麻叶浸膏制备:称取50g 汉麻叶干粉,沸水提取两次,每次提取1h,第一次400mL 水,第二次300mL 水,合并浸提液,过滤除渣,收集滤液后减压浓缩,得汉麻叶浸膏。
急性毒性实验以健康成年小鼠为实验对象,将汉麻叶浸膏以蒸馏水配制成0.2g/mL 的溶液。以12g/kg 剂量,最大浓度(0.2g/mL)、最大给药容积(0.3mL/10 g 体重)进行最大给药量实验。小鼠给药前禁食不禁水12h,灌胃给予汉麻叶浸膏,一日2 次给药,间隔6h,观察动物异常情况,连续观察14d。实验结束时,将动物称重、解剖并观察其主要脏器有无异常变化。
1.2.2 乙醇溶剂法 精确称取一定量的汉麻叶干粉,加入一定体积的乙醇溶液,在不同温度、料液比等条件下浸提,提取液过滤除渣,滤液稀释定容待测。
在单因素优化结果的基础上,以乙醇体积分数、提取时间、提取温度和料液比为影响因素,各取3 个水平,采用L9(34)正交表进行正交实验设计,以汉麻叶总黄酮含量为指标,确定其最适提取工艺。因素水平表见表1。
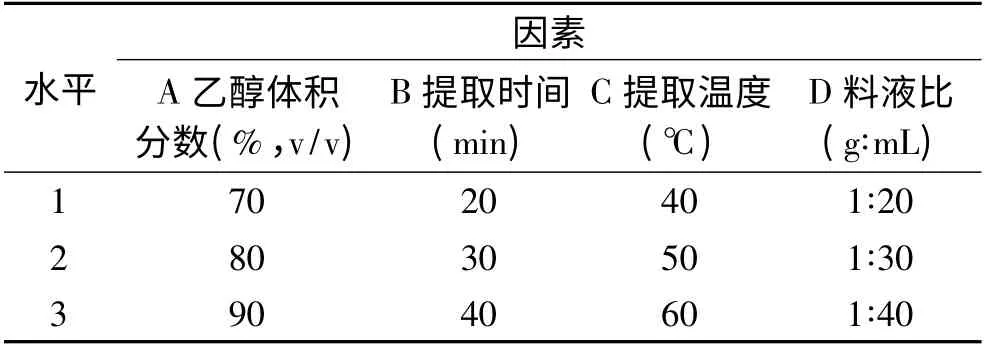
表1 乙醇溶剂法因素水平表Table 1 Factors and levels for orthogonal experiment design with ethanol solvent extraction
1.2.3 超声辅助提取法 精确称取一定量的汉麻叶干粉,加入一定体积的乙醇溶液,在乙醇体积分数、料液比等条件下,超声辅助浸提,提取液过滤除渣,滤液稀释定容待测。
在单因素优化结果的基础上,以乙醇体积分数、料液比和提取时间为影响因素,各取3 个水平,采用L9(34)正交表进行正交实验设计,以汉麻叶总黄酮含量为指标,确定其最适提取工艺。因素水平表见表2。
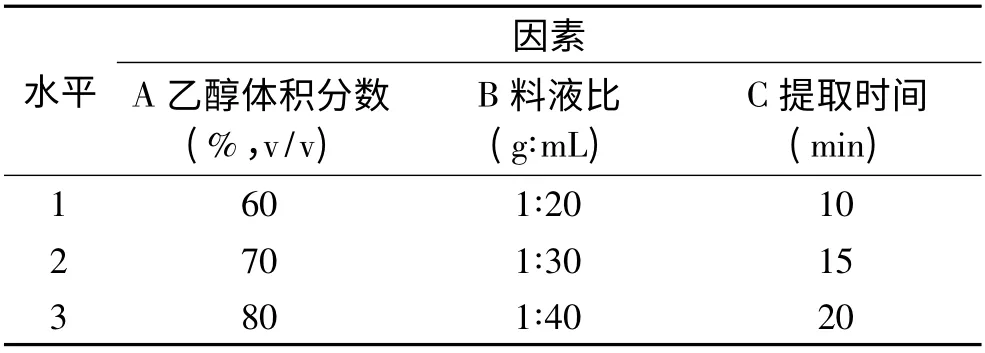
表2 超声辅助提取法因素水平表Table 2 Factors and levels for orthogonal experiment design with ultrasonic-assisted extraction
1.2.4 标准曲线绘制 分别精密吸取芦丁对照液(0.13mg/mL)0.00、0.50、1.00、2.00、3.00、4.00、5.00mL于10mL 容量瓶中,分别加入5% 亚硝酸钠溶液0.30mL,摇匀后静置6min;再加10% 硝酸铝溶液0.30mL,摇匀后静置6min;再加4% 氢氧化钠溶液4.00mL,用60%乙醇定容,摇匀后静置12min,以芦丁标准液加入量为0 的样品作空白参比液,于510nm处测定吸光度A,做标准曲线。
1.2.5 样品测定精密吸取样品液0.20mL,置于10mL 容量瓶,按1.2.4 的步骤,测定其吸光度A,根据标准曲线计算样品中总黄酮的含量,并计算每克汉麻叶中总黄酮含量(mg/g)和总黄酮得率(Y)。
汉麻叶中总黄酮得率(Y,%)=提取液中总黄酮质量(g)/汉麻叶质量(g)×100
2 结果与讨论
2.1 急性毒性实验
以汉麻叶浸膏对ICR 小鼠进行急性毒性实验,给药剂量12g/kg,连续观察14d,12 只小鼠均健康,生长正常,体重增长明显(表3)。观察发现,小鼠摄食、饮水、大便、黏膜、皮毛、呼吸等均未发生异常,且2 组小鼠均无死亡。解剖发现小鼠的心、肝、脾、肺、肾等各种器官没有肉眼可见的病变,表明汉麻叶浸膏急性毒性较小,使用较安全。

表3 汉麻叶浸膏对小鼠体重变化的影响(¯x±SD,n=6)Table 3 The effect of China-hemp leaves extract on the body weight of mice (¯x±SD,n=6)
2.2 乙醇溶剂法工艺优化
以芦丁浓度为横坐标,吸光度为纵坐标,绘制标准曲线,结果如图1 所示。
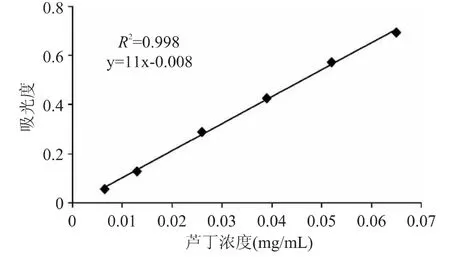
图1 芦丁标准曲线Fig.1 Standard curve of rutin
影响乙醇溶剂法提取汉麻叶中总黄酮的主要影响因素有:乙醇体积分数、料液比、提取时间和提取温度等。在单因素实验结果的基础上(结果未列出),设计L9(34)正交实验,以确定乙醇溶剂法提取汉麻叶总黄酮的最佳工艺,结果见表4。
由表4 可以看出,极差分析结果RA>RC>RB>RD,因此各因素对汉麻叶总黄酮提取得率影响的主次顺序依次为:乙醇体积分数(A)>提取温度(C)>提取时间(B)>料液比(D)。最优提取条件为:A1B3C3D1,即乙醇体积分数70%,料液比1 ∶20(g∶mL),在60℃温度下提取40min。验证实验表明,在此条件下,提取物的总黄酮含量为28.32mg/g(干基),提取得率为2.83%。

表4 乙醇溶剂法提取汉麻叶总黄酮正交实验结果Table 4 Results of orthogonal experiment for total flavonoids extraction from China-hemp leaves with ethanol solvent extraction
2.3 超声辅助提取法工艺优化
影响超声辅助提取汉麻叶总黄酮的因素有:超声波频率、超声波强度、乙醇体积分数、料液比、超声提取时间等。固定超声波和强度,根据单因素实验结果(结果未列出),设计L9(34)正交实验,以确定超声辅助提取汉麻叶总黄酮的最佳工艺,结果如表5 所示。
由表5 可知,极差分析结果RA>RB>RC,因此,各因素对超声辅助提取汉麻叶总黄酮提取得率影响的主次顺序依次为:乙醇体积分数(A)>料液比(B)>提取时间(C),最优提取条件为:A1B3C1,即乙醇体积分数60%,料液比1∶40(g∶mL),提取10min。经验证,在此条件下,所得提取物的总黄酮含量为30.52mg/g(干基),提取得率为3.05%。
通过对上述两种方法进行比较,超声辅助提取法最优提取时间只有乙醇溶剂法的1/4,所需乙醇体积分数(60%)也比乙醇溶剂法(70%)略低,提取温度为室温。提取时间缩短有利于提高生产效率,提取温度降低有助于降低能耗,更重要的是,低温快速提取可有效保持汉麻叶中黄酮物质的生物活性[11]。利用超声辅助提取技术可有效地提高汉麻叶中总黄酮的提取得率,该方法目前已经得到了广泛的应用[12-13]。汉麻叶总黄酮的提取得率达到3.05%,表明汉麻叶中总黄酮含量较高,同目前常用的银杏叶等植物原料相比,汉麻叶来源广泛,其成本上的特殊优势显示了良好的开发前景[14-15]。

表5 超声辅助提取汉麻叶总黄酮正交实验结果Table 5 Results of orthogonal experiment for total flavonoids extraction from China-hemp leaves with ultrasonic-assisted extraction
3 结论
急性毒性实验表明,汉麻叶浸膏大剂量给予小鼠未见明显毒性反应。汉麻叶中含有丰富的黄酮类化合物,超声辅助法能对其进行有效提取。最佳工艺条件为:乙醇体积分数60%,料液比1∶40(g∶mL),提取10min。在此条件下,提取的汉麻叶总黄酮含量为30.52mg/g(干基),提取得率为3.05%,与文献报道银杏叶中提取得率相当。超声辅助法是一种有效的提取过程强化方法,可大大缩短提取时间,降低提取温度,有助于提高汉麻叶总黄酮提取效率。
由于汉麻来源广泛,汉麻叶中的黄酮类化合物值得进一步开发利用。本研究可拓展植物黄酮的来源,并为汉麻叶的综合利用提供了新的技术支撑。
[1]何锦风,杜军强,陈天鹏.汉麻叶的生物活性成分研究现状[J].中国食品学报,2011,11(8):133-140.
[2]张建春,何锦风.汉麻籽综合利用加工技术[M].北京:中国轻工业出版社,2010:1-2.
[3]杜军强,何锦风,蒲彪,等.汉麻籽营养成分及其在食品工业中的应用[J].食品工业科技,2011,32(11):522-524.
[4]张华,张建春,张杰.汉麻-一种高值特种生物质资源及应用[J].高分子通报,2011(8):1-7.
[5]周徐慧,钱平,卢蓉蓉,等.酶法制备汉麻籽蛋白抗氧化肽[J].食品与发酵工业,2008,34(5):76-81.
[6]杜军强,何锦风,何聪芬,等.汉麻叶活性成分及其药理特性的研究概况[J].中国医药导报,2011,8(31):9-11.
[7]李婷婷,蔡光明,朱若华,等.汉麻果胶中总黄酮提取工艺研究[J].中南药学,2011,9(9):672-675.
[8]Biesaga M.Influence of extraction methods on stability of flavonoids[J].Journal of Chromatography A,2011,1218(18):2505-2512.
[9]李凤林,李青旺,冯彩宁,等.天然黄酮类化合物提取方法研究进展[J].中国食品添加剂,2008(5):60-64.
[10]刘峙嵘,俞自由,方裕勋,等.微波萃取银杏叶黄酮类化合物[J].东华理工学院学报,2005,28(2):151-154.
[11]Huang W,Xue A,Niu H,et al.Optimised ultrasonic-assisted extraction of flavonoids from Folium eucommiae and evaluation of antioxidant activity in multi- test systems in vitro[J]. Food Chemistry,2009,114(3):1147-1154.
[12]Pan G,Yu G,Zhu C,et al.Optimization of ultrasoundassisted extraction (UAE)of flavonoids compounds (FC)from hawthorn seed (HS)[J].Ultrasonics Sonochemistry,2012,19(3):486-490.
[13]Zhang H F,Yang X H,Zhao L D,et al.Ultrasonic-assisted extraction of epimedin C from fresh leaves of Epimedium and extraction mechanism[J].Innovative Food Science & Emerging Technologies,2009,10(1):54-60.
[14]Zhang G,He L,Hu M. Optimized ultrasonic - assisted extraction of flavonoids from Prunella vulgaris L.and evaluation of antioxidant activities in vitro[J].Innovative Food Science &Emerging Technologies,2011,12(1):18-25.
[15]张玉祥,邱蔚芬.银杏叶超声波提取工艺研究[J].时珍国医国药,2006,17(5):784-785.
