商用大豆分离蛋白乳化活性的优化
2013-08-07黄行健章肇敏黎扬帆徐晓云王可兴潘思轶
黄行健,高 丽,章肇敏,黎扬帆,徐晓云,王可兴,潘思轶,*
(1.华中农业大学食品科技学院,湖北武汉430070;2.华中农业大学楚天学院,食品与生物科技学院,湖北武汉430205;3.江西金源农业开发有限公司,江西宜春336100)
人们对蛋白质的物化特性、营养性和生物活性了解越来越多。作为许多配方食品的功能性成分,蛋白质加工和应用学科变得越来越重要[1]。许多研究通过酶改性方法改进分离蛋白的功能性。天然大豆蛋白具有乳化性、起泡性、保水性、凝胶性等物化性质。但是其物化性质离人类实际应用的要求还有一定差距,这主要有两方面原因:a.一种天然的大豆蛋白难以兼具多种优良的物化性质;b.天然大豆蛋白的物化性质离人类要求的水平经常还有差距,难以实际应用于产品中,酶解改性是目前很常用的手段,不同的酶有特定的水解多肽构架中的肽键,水解生成许多中等和小分子量大豆肽,由于暴露出更多的氨基和羧基,提高天然蛋白质的亲水性[2]和分散性[3]。限制性水解也伴随其他功能特性的改变,亚基解离,蛋白质致密结构展开,内部的疏水区域暴露,墒增加,表面活性增强[4]。目前植物蛋白质利用的主要瓶颈是水解过程中的抵抗作用,这也是导致蛋白质组分氨基酸可利用性不高的主要原因[5]。像许多植物蛋白质一样,大豆蛋白对于许多水解蛋白酶也有抵抗作用。与其他常用酶制剂比较,胰蛋白酶的专一性强,水解的重复性高,能显著地提高酶解蛋白的乳化性能[6]。胰蛋白酶的催化位点是赖氨酸、精氨酸中的酰胺键,水解蛋白中只有少数的酰胺键被水解,产物主要是由离解的亚基、部分水解的蛋白和一些分子量较大的大豆肽组成[7]。胰蛋白酶在动物蛋白(鱼下脚料,蛋黄蛋白、猪骨蛋白)和植物蛋白(大豆蛋白,豌豆蛋白,米蛋白、乳清蛋白,甘薯蛋白、棉籽蛋白、小米蛋白、核桃蛋白)都得到了很好的应用和尝试,但是即使是同一种底物蛋白,由于提取,纯化,生产蛋白等过程的不同,所得的酶解参数和产品乳化活性存在差异性。大豆蛋白具有优良的功能性质,包括持水性、吸油性、增稠性、乳化性、起泡性[8]。乳化活性是大豆蛋白重要的物化特性之一,乳化活性指的是蛋白质作为乳化剂,单位质量的蛋白质在油水共存体系中能够稳定油水界面的面积。本文选定目前主要市售美国杜邦、山东禹王和以色列索宝的商业大豆分离蛋白粉作为供试蛋白。探索酶解时间、酶解pH、酶解温度、酶与底物的质量比四种因素作为影响酶解反应的自变量,选择乳化活性作为因变量,确定酶解大豆蛋白的最佳优化工艺条件,对商业大豆分离蛋白的乳化活性进一步优化。
1 材料与方法
1.1 材料与仪器
大豆分离蛋白 分别购买于山东临邑禹王植物蛋白有限公司(样品1)、云梦杜邦蛋白有限公司(样品2)和以色列索宝工业公司(样品3);胰蛋白酶 酶活250u/mg,美国AMRESCO 生物公司;氢氧化钠、盐酸、十二烷基磺酸钠等 均为市售分析纯。
ZD-3A 自动电位滴定仪 上海羽通仪器仪表厂;DF-101S 恒温加热磁力搅拌器 巩义市科瑞仪器有限公司;1-4LD 冷冻干燥机 德国CHRIST 公司;OPTIMA LE - 80K 超速冷冻离心机美国BECKMAN COULTER 公司;Nicolet NEXUS 470 傅里叶红外光谱仪 美国尼高力公司。
1.2 实验方法
1.2.1 粗蛋白质含量测定 凯氏半微量定氮法[9]。
1.2.2 氮溶解指数的测定 称取1g 左右样品,溶于50mL 纯水中,在磁力搅拌器中缓慢搅拌30min 后在4000r/min 转速下离心,取上清液5mL。凯氏定氮法测定可溶性蛋白质含量,然后计算氮溶解指数(NSI)[10]:

1.2.3 傅里叶变换红外光谱 样品粉末与KBr 按1∶100比例混合后充分研磨,接着在27MPa 条件下压2min,每个样品压3~5 个,压好的片放进FT-IR 光谱仪,密闭条件下扫描得样品红外光谱图。扫描范围为4000~400cm-1,分辨率4cm-1,累计32 次,以空气为背景,每个样品扫描前扣除背景[11]。
1.2.4 胰蛋白酶酶解大豆分离蛋白 制备5.0%浓度的大豆分离蛋白溶液,沸水浴中加热处理10min,然后放入恒温水浴锅中按照表1 控制反应温度、pH、反应时间、胰蛋白酶与蛋白底物比,水解过程中不断加入0.30mol/L NaOH 溶液维持反应体系pH 恒定。反应到规定时间后取出溶液,立即置于100℃水浴中加热10min 灭酶活,然后冷却到室温,将酶解液置入离心机中于8000r/min 离心12min,取上清液,调节pH 至中性,将溶液转移到透析袋中,于2℃下透析48h,透析完成后,冷冻干燥样品,冻干样品研磨成粉状密封保存在玻璃瓶中,在4℃环境中密封储存待用。
1.2.5 乳化活性的测定 准确称取0.0180g 酶解大豆蛋白,加入18mL 水,6mL 油,中等转速下均质1min,分别于均质后0min 和10min 取底层乳液100μL 加入到10mL 的0.1%十二烷基磺酸钠(SDS)溶液中。以0.1%SDS 液为空白,在500nm 波长下测定吸光值。采用Tang 的方法[13]测定乳化活性,公式如下:

EAI-单位质量蛋白质的乳化表面积(m2/g);c-样品溶解液中蛋白质浓度(g/mL);φ-油相所占的分数,本实验为1/4;L-比色皿的光径(10-2m)。

表1 实验因素与水平对照Table 1 Experimental factors and levels in control
2 结果与分析
2.1 三种不同来源大豆分离蛋白粉分析
2.1.1 粗蛋白含量和氮溶解指数 商业化的大豆分离蛋白是调节脱脂大豆粉萃取液至pH4.3~4.8 而沉淀出来的[14]。大豆蛋白主要是由β-伴大豆球蛋白(7S)和大豆球蛋白(11S)组成,但是其中也包含一些与卵磷脂连接的亲脂性蛋白质,三者比例约为23%、46%和31%。这三者的比例随着大豆蛋白的氮溶解指数(NSI)变化而变化。不像7S 球蛋白和11S 球蛋白,亲脂性蛋白质的含量与大豆蛋白的NSI 值成正相关[15]。大豆蛋白是球蛋白,肽链上亲水性侧链基团大部分在分子表面,形成亲水区域;而肽链侧链上的疏水基团埋藏在内部,形成疏水区。所以当大豆蛋白的亲水性盐键和酯键处于分子表面,则具有较好的亲水性[16]。但是蛋白质容易受物理或化学因素的影响而变性,蛋白质四维结构由致密的球状变为疏松的棒状,内部的疏水侧链残基暴露出来,导致溶解性下降[17]。氮溶解指数主要用来评价蛋白质在水中的溶解性,被广泛地应用于评价大豆蛋白的品质和变性程度[18]。
如表2 所示,不同来源大豆分离蛋白中蛋白质含量和NSI 值存在一定的差异。美国杜邦、山东禹王和以色列索宝产的大豆分离蛋白中的蛋白质含量分别为86.1%、89.8% 和88.8%,NSI 值分别为47.6%、66.1%和42.7%。结果表明:山东禹王产的大豆分离蛋白的蛋白质含量和NSI 值最高。大豆蛋白的乳化性与表面疏水性、溶解性、分子量、空间构型、分子柔性等有关。较好的溶解性是良好乳化性能的必要条件之一,并且NSI 值高,有利于进行酶修饰改变蛋白质功能性质。
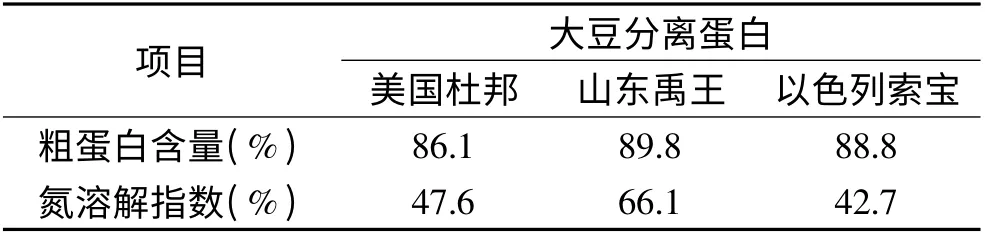
表2 粗蛋白含量和氮溶解指数Table 2 Crude protein content and nitrogen solution index
2.1.2 傅里叶红外图谱分析 在蛋白质分子酰胺Ⅰ带中,波数1650~1658cm-1为蛋白质分子的α-螺旋特征谱带,峰积分面积为α-螺旋含量;波数1610~1640cm-1为蛋白质分子的β-折叠。在蛋白质分子酰胺Ⅲ带中,波数1290 ~1340cm-1为蛋白质分子的α-螺旋特征谱带,1181~1248cm-1为β-折叠特征谱带,1255 ~1288cm-1为无规卷曲特征谱带[19]。如图1~图3所示,经过Peakfit 软件分析红外数据,三种不同大豆分离蛋白的α-螺旋结构所占比例大于β-折叠,二级结构组成大体相似,其中α-螺旋结构含量多少依次为:山东禹王>云梦杜邦>以色列索宝,许多学者研究表明大豆蛋白质的α-螺旋结构含量与溶解性能存在正比关系[20],而溶解性能大小是乳化特性高低一个很重要的基础,溶解性高,有利于乳化性的提高。

图1 美国杜邦大豆分离蛋白Fig.1 SPI of DuPont Co.,Ltd
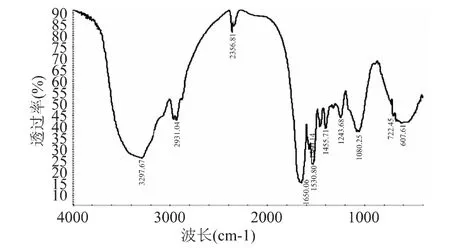
图2 山东禹王大豆分离蛋白Fig.2 SPI of Shandong Yuwang Industrial Co.,Ltd
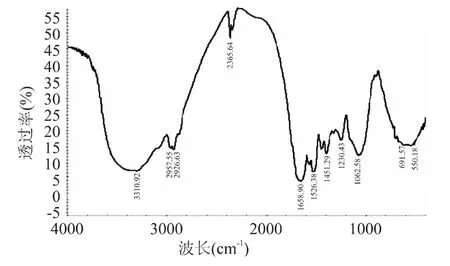
图3 以色列索宝大豆分离蛋白Fig.3 SPI of Solbar Industrial Co.,Ltd
综合以上分析,后期实验采用山东禹王公司生产的商用大豆分离蛋白作为后续实验的供试蛋白。
2.2 四元二次回归正交旋转组合实验
采用四元二次回归正交旋转组合实验研究加酶量、温度、时间和pH 对酶解大豆分离蛋白乳化活性的影响。酶解工艺条件及实验结果见表3。
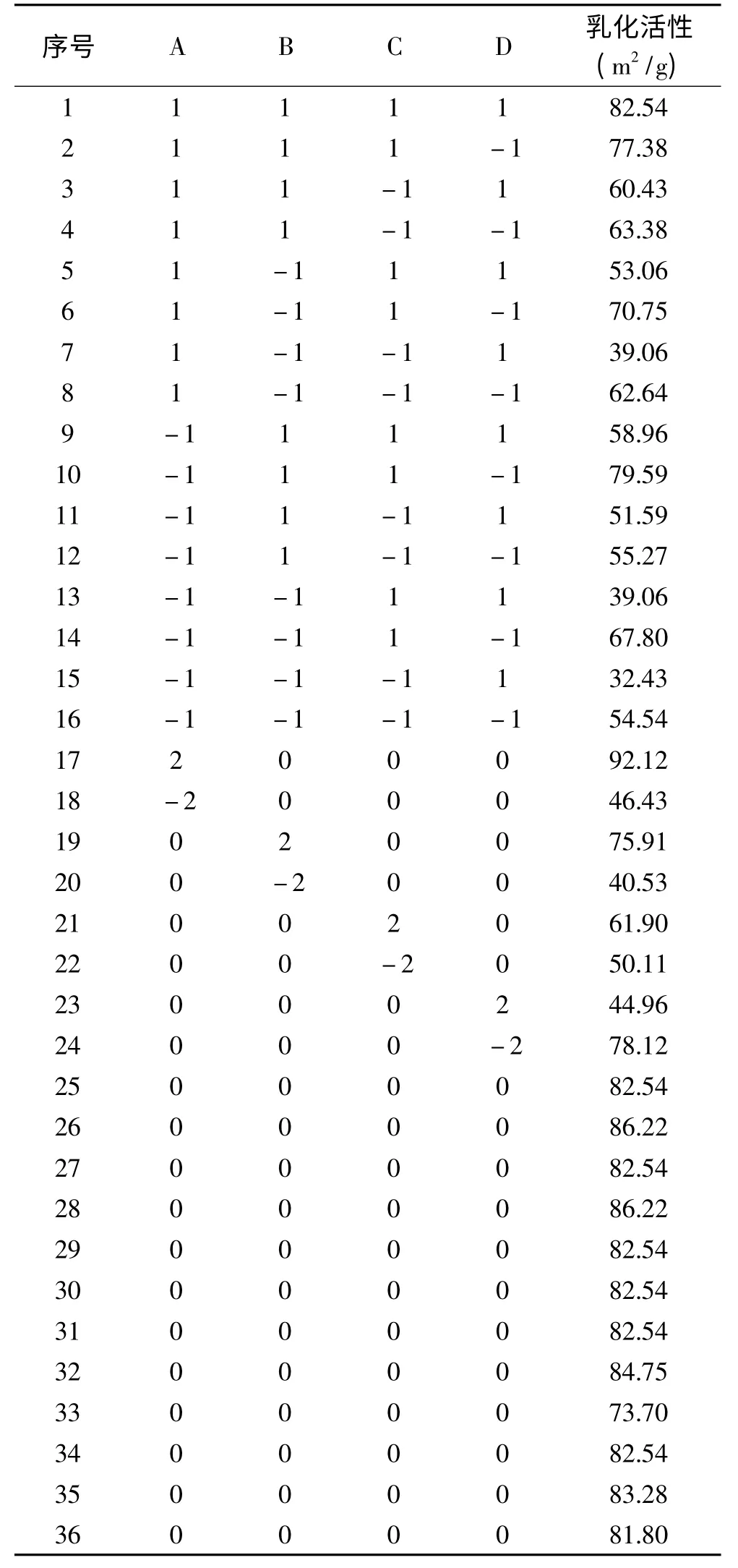
表3 实验安排与结果Table 3 Experimental arrangements and results
2.3 回归方程分析与最优酶解条件确定
回归方程的方差分析、方程各项方差及显著性分析、最大乳化活性的酶解工艺参数及其结果如表4~表7所示。
各因素对水解产物乳化特性的影响程度从大到小的依次排列为:温度>pH >时间>加酶量。胰蛋白酶水解大豆分离蛋白,以乳化活性为因变量的回归方程为:EAI = -842.619 + 46.526A + 14.090B +17.759C + 108.685D-14.647A2-0.111AB-0.114B2-0.553AC + 0.143BC-3.10C2+ 4.514AD-0.538BD +0.399CD-5.596d2。由方程的显著性分析得F 为22.23,p 小于0.0001,方程具有良好的回归性。
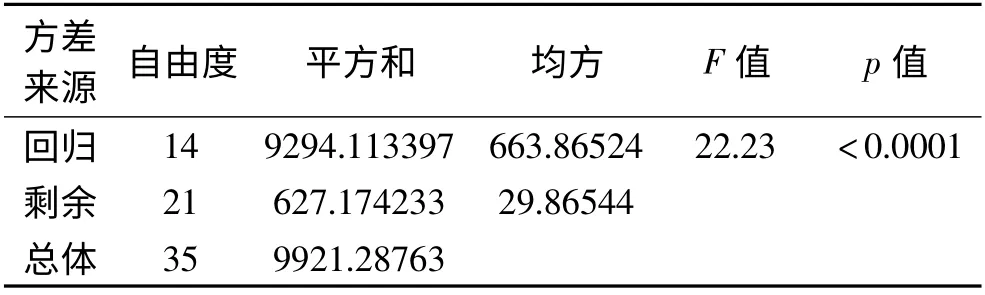
表4 回归方程的方差分析Table 4 Analysis of variance in regression equation
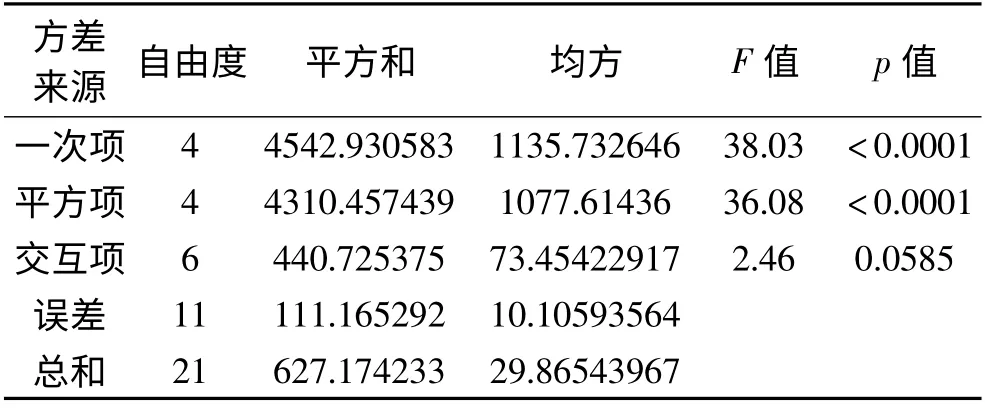
表5 回归方程各项的方差分析Table 5 Variance analysis of regression equation
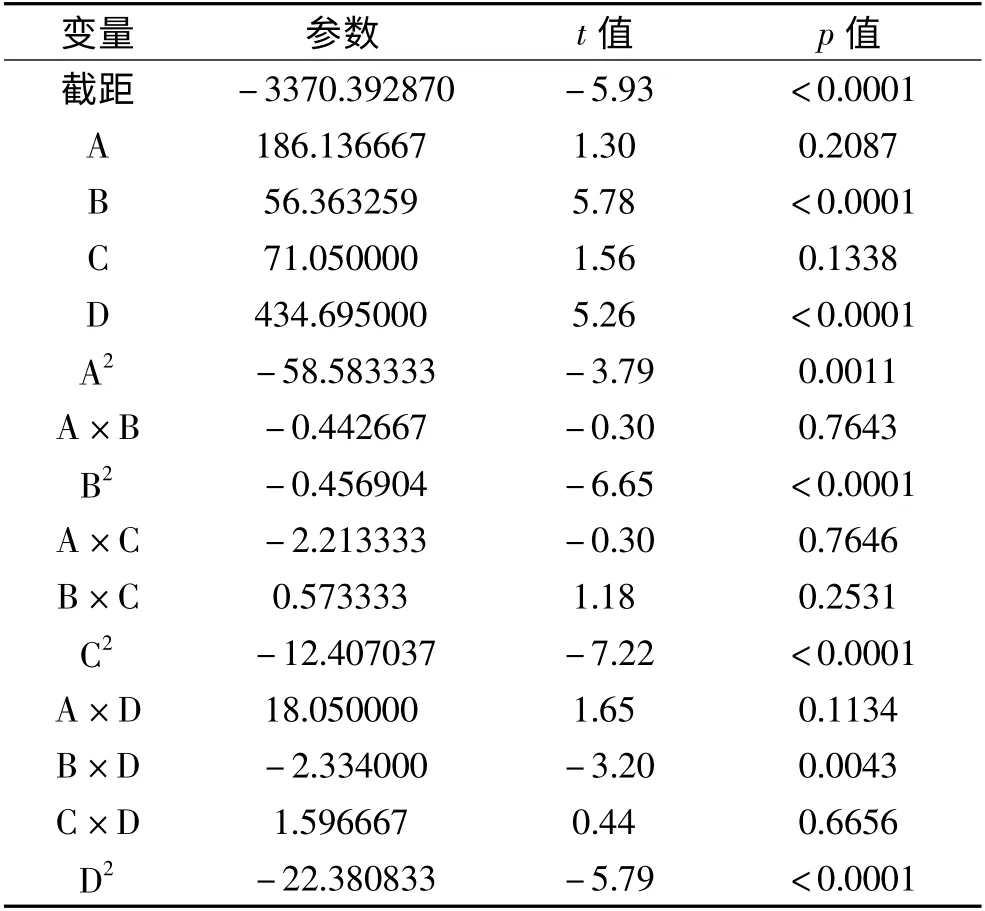
表6 二次回归模型参数Table 6 Parameters of regression equation

表7 酶解条件优化值及最优条件下最大的乳化活性Table 7 Optimizations of enzyme digestion and maximal emulsifying activity index
原始大豆分离蛋白的乳化活性为12.82m2/g。如表7 所示,当加酶量、温度、时间与pH 分别为2.72%、40℃、4.12h、8.85 时,该条件下水解得到的酶解大豆蛋白乳化活性最大,为22.57m2/g。
3 结论
当加酶量、温度、时间与pH 分别为2.72%、40.34℃、4.12h、8.85 时,SPI 水解物的EAI 最大,为22.57m2/g。1 号大豆蛋白水解物乳化活性得到很大的改善,酶解大豆蛋白的最大乳化活性比大豆分离蛋白的乳化活性上升76%。
[1]陈振家,贾彦军.大豆蛋白质的研究进展[J].畜牧兽医科技信息,2005(10):62-63.
[2]Song K B,Damodaran S.Structure function relationship of proteins:adsorption of structural intermediates of bovin serum albumin at air water interface[J].J Agric Food Chem,1987(35):236-241.
[3]Chobert J M,Bertrand H C,Nicholas M G.Solubility and emulsifying properties of caseins and whey proteins modified enzymatically by trypsin[J].J Agric Food Chem,1988(36):883-892.
[4]Huang Y T.Effects of phosphorylation on emulsifying and foaming properties and digestibility of yeast protein[J].J Food Sci,1987(52):1684-1688.
[5]Faustinus K Y,Inteaz A B K.Tryptic fragments of phaseolin from protein isolates of phaseolus beans[J].Food Chem,1999(67):105-112.
[6]徐红华,刘欣,温其标.复合酶法改善大豆分离蛋白乳化性的实验[J].农业机械学报,2008,39(2):103-106.
[7]赵新淮,侯瑶.大豆蛋白限制性酶解对乳化性质和吸油性的影响[J].农业机械学报,2009,40(12):159-163.
[8]Lienier I E,Thompson R M.In vivo and in vitro studies of the digestibility of the major storage protein of the navy bean(phaseolus vulgaris)[J].Qual Plant Plant Foods Hum Nutr,1980(30):13-25.
[9]王肇慈.粮油食品品质分析[M].北京:中国轻工业出版社,2000:127-129.
[10]殷军,华欲飞,陆健.大豆蛋白乳化性能比较及机理探讨[J].中国油脂,2005,30(5):35-38.
[11]Zaleska H,Ring S G.Apple pectin complexes with whey protein isolate[J].Food Hydrocolloids,2000,14:377-382.
[12]Josafat M E,Fernando L,Garcia C,et al.pH-stat method to predict protein digestibility in white shrimp(penaeus vannamei)[J].Aquaculture,1997,157:251-262.
[13]Tang C H,Yang X Q,Chen Z,et al.Physicochemical and structural characteristics of sodium caseinate biopolymers induced by microbial transglutaminase[J].Journal of Food Biochemistry,2005,29(4):402-421.
[14]朱尚全.蛋白质化学改性及应用[J].生物化学与生物物理进展,1979(2):7-18.
[15]Mashahiko S,Motohiro M,Chiaki M H K.Abundant proteins associated with lecithin in soy protein isolate[J].Food Chem,2007,102:317-322.
[16]沈蓓英,唐年初.影响蛋白质PDI 和NSI 因素[J].中国油脂,1997,22(3):9-11.
[17]Chun L,Wang X S,Hao M Z Z.Functional properties of protein isolates from soybeans stored[J].Food Chem,2008,111:29-37.
[18]Marsman G J P,Gruppen H Z D.The influence of screw configuration on the in vitro digestibility and protein solubility of soybean and rapeseed meals[J].J Food Eng,1995,26:13-28.
[19]周瑞宝,沈永嘉.蛋白质二级结构的红外光谱[J].华东理工大学学报,1997,23:422-425.
[20]王辰,江连洲,魏冬旭,等.不同品种大豆分离蛋白结构与表面疏水性的关系[J].食品科学,2012,33(9):54-57.
