PCR 技术区分液体麦精和玉米糖浆
2013-08-07吴申懋邓志瑞
吴申懋,邓志瑞,陈 沁
(上海大学生命科学学院,上海200444)
液体麦精又称为麦芽提取物,它以大麦和麦芽淀粉为原料,经过粉碎、酶解、提取、过滤、真空浓缩等步骤制取。麦精制作过程主要是利用麦芽中所含的酶,对大麦中的淀粉和蛋白质进行分解,产生一系列的单糖、双糖和多糖、小分子蛋白肽和氨基酸等物质,所以麦精作为一种源自谷物的天然食品含有丰富的麦芽糖、果糖、葡萄糖、蛋白质、小分子肽、人体必须的氨基酸等营养成分[1-2],广泛用作饮料、果冻、糖果、冰激凌和调味食品的甜味剂及啤酒的发酵生产中[3]。玉米糖浆是采用优质玉米淀粉,经过磨浆,糖化,冷却,过滤,熬煮后制得的以麦芽糖为主的糖浆。因为玉米糖浆产量大,价格相对麦精低廉许多,而且现在市场上的玉米糖浆多为果葡糖浆。一些不法商贩为追求巨大的商业利益,将相对便宜玉米糖浆掺入麦精中,极大地扰乱了市场秩序,侵害了消费者的合法权益。目前学术界对于果葡糖浆的作用没有定论,还处于激烈的讨论过程。有些研究表明,大量的果糖摄入和代谢会造成胰岛素作用的靶器官对胰岛素作用的敏感性下降,引发其他疾病[4-5]。玉米糖浆与麦精均含有各种糖类,理化性质在一定程度上较为相似,一些传统的检测方法对可溶性固形物、总糖、总酸等常规物质的检测很难区分两者的区别,而一些新型的检测技术如红外光谱,淀粉酶活性测定,碳同位素测定等方法存在检测步骤繁琐、仪器昂贵、工作量大等缺点,而且其方法也有一定的应用限制[6-7]。通过PCR 技术检测两种糖中的DNA 可以避免上述的问题,而且较为快捷,准确性较高。鉴于此,本文试图建立区分液体麦精和玉米糖浆PCR 方法。以两种糖浆中的DNA 为研究对象,采用PCR 技术有关结果,将为食品中液体麦精和玉米糖浆的直接检测和区分奠定基础。
1 材料与方法
1.1 材料与仪器
液体麦精、玉米糖浆 上海金啤生物科技有限公司;阳性对照的“花22”、“西引2 号”大麦种子 上海崇明种子公司;“中糯2 号”、“申糯2 号”玉米种子 上海瑞奇种子公司;Taq 酶(5U/μL) 宝生物工程(大连)有限公司;高纯dNTP(2.5mmol/L)北京康为世纪生物科技有限公司。

表1 引物序列及产物大小Table 1 Primer sequences and product sizes
S1000TM Thermal Cycler PCR 仪 美国Bio-Rad公司;ND - 1000 微量紫外分光光度计美国NanoDrop 公司;GIS-1000 凝胶成像系统 上海天能科技有限公司。
1.2 实验方法
1.2.1 DNA 的提取
1.2.1.1 改良CTAB 法 参照Chen[8],Moller[9]等的方法并稍作修改。TES 缓冲液:100mmol/L Tris(pH8.0),10mmol/L EDTA,2% SDS,2% PVP。
a.取2g 样品装入离心管中,加8mL TES、15μLProteinaseK,55℃孵育1h,每15min 涡旋混匀;
b.加5mol/L NaCl 溶液调节盐浓度至2mol/L,加500μL 10%CTAB,65℃水浴10min;12000r/min 离心10min,取上清液至离心管中。
c.加入等体积 Tris 饱和酚∶氯仿∶异戊醇(25∶24∶1),颠倒混匀,4℃,12000r/min 离心10min,取上清液至离心管中。加入等体积氯仿∶异戊醇(24∶1),颠倒混匀,4℃,12000r/min 离心10min,取上清液至离心管中。
d.加0.25 倍体积无水乙醇,0.1 倍体积5mol/L 醋酸钾,-20℃放置1h,4℃,12000r/min 离心10min,取上清。
e.加入0.75 倍体积的预冷异丙醇,-20℃放置30min;4℃,12000r/min 离心15min,弃异丙醇;
f.加700μL70% 乙醇,轻轻涡旋混匀,4℃,12000r/min 离心5min,弃乙醇;重复一次。
g.室温晾干至无乙醇味,加100μL ddH2O 熔解,-20℃冻存待用。
1.2.1.2 SDS 法 参照朱振雷等[10]并稍作修改,SDS提取液:200mmol/L Tris-HCl(pH7.5),250mmol/L NaCl,25mmol/L EDTA,0.5%SDS,0.1%β-巯基乙醇。
a.称取3g 左右的样品置于50mL 的离心管中,向管中加入10mL 65℃预热的SDS 提取液,65℃水浴30min。
b.加入等体积 Tris 饱和酚∶氯仿∶异戊醇(25∶24∶1),颠倒混匀,4℃,12000r/min 离心10min,取上清液至离心管中。加入等体积氯仿∶异戊醇(24∶1),颠倒混匀,4℃,1000r/min 离心10min,取上清液至离心管中。
c.加入0.8 倍体积的异丙醇,-20℃放置10 ~20min,12000r/min 离心10min。
d.加1000μL,轻轻涡旋混匀,4℃,12000r/min 离心5min,弃乙醇。
e.室温晾干,至无乙醇味,加100μL ddH2O 熔解,-20℃冻存待用。
1.2.1.3 试剂盒法 使用深加工食品试剂盒(天根生化科技北京有限公司),按试剂盒说明书操作。
1.2.2 引物设计与合成 参考徐亚维[11]和闫永荣[12]等的研究,根据大麦B1 醇溶蛋白基因(X03103.1)和玉米淀粉分支酶基因(AF072725.1)序列设计引物,植物18S rRNA 通用引物参考文献[13]设计,由生工生物工程(上海)有限公司合成,引物序列见表1。
1.2.3 18S rRNA 通用引物PCR 采用植物18S rRNA通用引物对提取的DNA 进行扩增,确定DNA 质量。PCR 反应总体系20μL,含2μL 10 × Buffer(Mg2+plus),3.2μL dNTP(2.5mmol/L),0.2μL Taq 酶(5U/μL),2μL DNA 模板,1μL 引物(3μmol/L),ddH2O 补齐至20μL。PCR 反应条件:94℃预变性3min,反应35 个循环,每个循环包括94℃变性30s,55℃退火30s,72℃延伸35s,循环结束后,72℃延伸10min;反应产物经1.5%琼脂糖凝胶电泳后用GIS-1000 凝胶成像系统观察。
1.2.4 退火温度对PCR 的影响 PCR 反应体系如1.2.3,根据合成Barley 引物和Corn 引物的TM 值±5℃设置退火温度为55~65℃,进行梯度温度PCR。
1.2.5 PCR 反应的引物特异性 PCR 反应体系如1.2.3,分别用Barley 引物和Corn 引物扩增玉米和大麦种子DNA,引物终浓度均为0.1μmol/L。
1.2.6 PCR 方法的重复性 PCR 反应体系如1.2.3,用Barley 引物扩增大麦种子DNA;Corn 引物扩增玉米种子DNA,以上实验在S1000TM Thermal Cycler PCR 仪和Techne Touchgene Gradient PCR 仪上重复进行。
1.2.7 PCR 方法的应用 PCR 反应体系如1.2.3,用Barley 引物扩增大麦提取物DNA;Corn 引物扩增玉米糖浆DNA,引物终浓度均为0.1μmol/L。
2 结果与分析
2.1 液体麦精和玉米糖浆DNA 提取
用改良CTAB 法,SDS 法,试剂盒法提取液体麦精和玉米糖浆DNA,结果见表2。OD260/OD280常用来评估核酸的质量,纯度高的DNA 其OD260/OD280一般在1.6~1.8 之间。由表2 可知,用改良CTAB 法提取的液体麦精DNA OD260/OD280在1.6 左右;玉米糖浆DNA OD260/OD280在1.90,说明污染较少,因此后续实验采用改良CTAB 法提取的DNA 进行。SDS 法提取液体麦精DNA 时未能彻底去除色素,吸光度测定误差过大,故数据未给出。
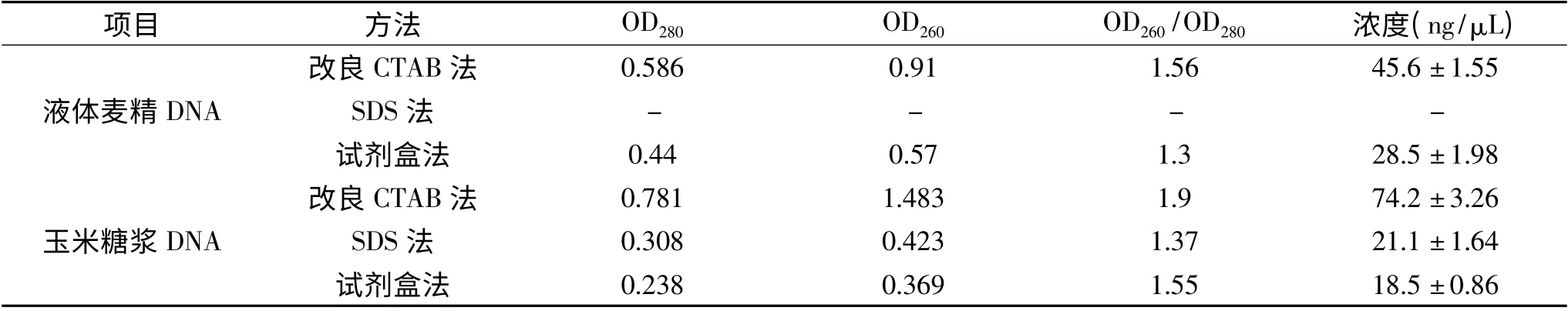
表2 液体麦精与玉米糖浆DNA 提取Table 2 DNA extraction from liquid malt extract and corn syrup
2.2 18S rRNA 通用引物PCR
用18S rRNA 通用引物PCR 扩增改良CTAB 法提取的DNA,电泳结果如图1 所示,两种DNA 均能扩增出250bp 的目的条带。结果表明改良CTAB 法提取的液体麦精和玉米糖浆基因组DNA 可以用于后续实验的PCR 扩增。
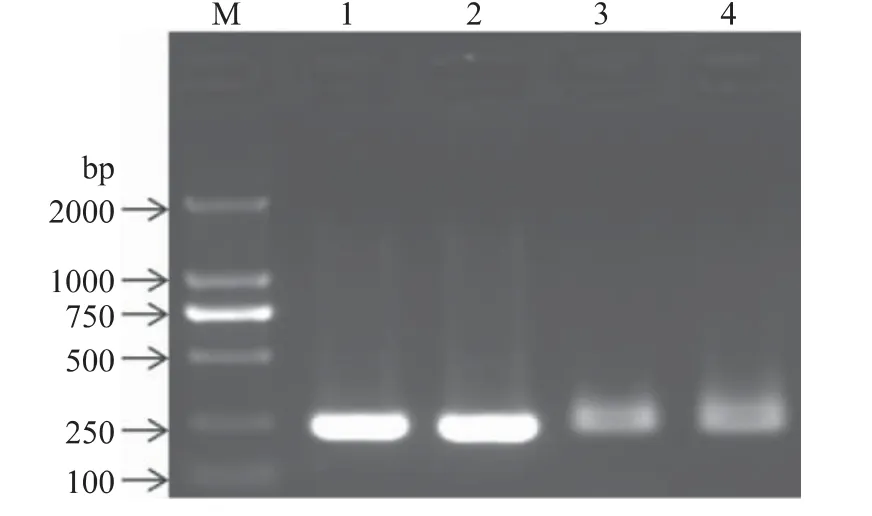
图1 18SrRNA 通用引物PCR 产物电泳Fig.1 Electrophoresis of PCR products using 18S rRNA universal primer
2.3 PCR 检测方法的建立
2.3.1 退火温度对PCR 的影响 以大麦种子和玉米种子DNA 作为扩增模板,温度梯度PCR 确定合适的退火温度。电泳结果如图2 所示。由图2 可知,在55~61.4℃随着退火温度的升高,扩增产物的非特异性条带逐渐减少。在61.4~65℃条带没有明显变化,考虑到温度过高时扩增效率下降,本实验选择61.4℃作为后续实验的退火温度。
2.3.2 引物的特异性 以大麦和玉米种子DNA 作为扩增模板,进行特异性引物PCR,电泳结果如图3 所示。由图3 可知,大麦引物扩增玉米DNA 和玉米引物扩增大麦DNA 均无法得到条带,表明引物具有较好的特异性。
2.3.3 PCR 方法的重复性 为了验证上述PCR 方法的重复性和可靠性,分别在两台PCR 仪上进行PCR,结果如图4 所示。由图4 可知,2 次重复实验的DNA条带位置一致,且重现性好,说明此方法具有较好的稳定性。

图2 退火温度对PCR 扩增的影响Fig.2 Effect of annealing temperature on PCR amplification

图3 PCR 扩增的特异性Fig.3 Primer specificity for PCR amplification
2.3.4 PCR 方法的应用 以上述建立的方法对液体麦精和玉米糖浆DNA 进行PCR 扩增,结果如图5 所示。由图5 可知,两种样品的PCR 扩增片段大小与预期一致(分别是500、919bp),说明液体麦精和玉米糖浆的DNA 通过特异性引物PCR 可以区分开来。

图4 PCR 方法的重复性Fig.4 Repeatability of PCR method
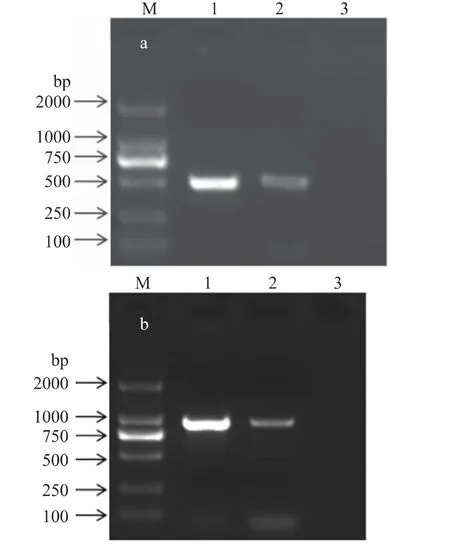
图5 PCR 方法的应用Fig.5 Application of PCR method
3 结论与讨论
DNA 提取的纯度直接影响到PCR 结果,进而影响检测的可行性和准确度。多糖、色素、盐和酚类物质都会影响DNA 的质量。在植物DNA 的提取过程中多糖的去除始终是一个难点,由于多糖的许多理化性质与DNA 相似,因此使用酚氯仿抽提、选择性沉淀等方法无法有效地分离多糖和核酸[14]。去除多糖有多种方法,但常用有两种:一是在DNA 提取过程中以低浓度乙醇沉淀多糖;二是在沉淀DNA 时,加入高盐溶液,使多糖不随DNA 沉淀。Hammar[15]等认为提高CTAB 缓冲液中的NaCl 浓度能有效去除多糖,因为高浓度的盐离子增加了不带电荷的多糖物质离子间作用力,使非极性作用力减弱,多糖物质的极性增加,溶解度也随之上升了,使得多糖与核酸可有效地分离[16]。Su[17]等在提取褐藻的RNA 时在用异丙醇沉淀前加入0.25 倍体积的无水乙醇沉淀多糖。Bahloule[18]和Ainsworth[19]等在各自的实验中在上清液中加入0.3 倍体积5mol/L 的醋酸钾以去除多糖。本实验参考了上述文献对CTAB 法加以修改,将缓冲液的NaCl 浓度提高到2mol/L,并在异丙醇沉淀DNA 前加0.25 倍体积无水乙醇和0.1 倍体积5mol/L醋酸钾去除多糖,取得到了较好的结果。相比SDS法和试剂盒法,改良CTAB 法所提取到的DNA 无论质量和浓度都较高。因此改良CTAB 法比较适用于液体麦精等糖浆类物质DNA 的提取。
影响PCR 扩增的因素很多,包括退火温度,引物浓度,模版量,循环数等,退火温度是其中最重要的因素之一,不恰当的退火温度往往会导致PCR 结果呈假阴性或出现非特异性扩增。非特异性扩增是与目的片段长度不符的DNA 条带或大片弥散状拖带[20]。根据发生机制,非特异性扩增可大致分为两类:第一类非特异性扩增是由引物与模板的非特异性结合引起的,第二类非特异性扩增是由引物与引物之间连接引起的。提高退火温度能降低引物与模板间的非特异性结合,也能抑制引物间的自连接,对两类非特异性扩增均有减少的作用。但有时过高的退火温度会影响引物与目的片段的匹配,从而降低PCR 反应扩增效率导致产物量下降甚至得不到产物[21]。本实验尝试了55 ~65℃的退火温度,结果表明在61.4℃时,可以得到较为清晰、分辨率较高的条带。
影响PCR 扩增的因素很多,包括退火温度,引物浓度,模版量,循环数等,本文主要对其中最重要的退火温度进行了优化。本实验发现玉米DNA 退火温度范围较宽,当退火温度在57℃以上时,PCR 产物条带均为明亮的单一条带;但大麦DNA 在55~59℃时非特异性扩增较多,直至61.4℃时,条带单一性较好。此外,当退火温度为65℃时,条带强度明显减弱。考虑到较高的退火温度会导致扩增效率下降,因此综合考虑,选择61.4℃作为本研究的退火温度。
PCR 的特异性决定检测结果的可靠性和准确性。而特异性主要体现在引物与模板DNA 专一性的结合上,理想的引物只和目的序列两侧的序列结合。韩建勋[22]等根据梨类甜蛋白基因,设计梨特异性引物,鉴定果汁中的梨成分。杨冬燕[23]等根据大豆特异性Lectin 基因设计引物,成功鉴别出了食用植物油中的掺假。本实验针对大麦B1 醇溶蛋白基因和玉米的淀粉分支酶基因设计特异性引物,用玉米和大麦种子的DNA 进行了PCR 对照实验,结果表明引物特异性良好,实验结果可靠。
区分糖浆类食品掺假的方法很多,Padovan[24]等利用碳同位素比值法测定商品蜂蜜的掺假,根据掺入的蔗糖溶液和高果糖浆来确定检测限,但是当掺入的糖浆低于10% 时会被认定为合格范围内。Kerkvliet 等[25]利用显微镜法检测蜂蜜中掺假的蔗糖、酸水解甘蔗糖浆或饲喂蜜蜂的糖,添加的蔗糖具有很多特征颗粒如来自甘蔗茎的蔗糖碎片(薄壁细胞、单细胞环和表皮细胞等),该方法虽然简便,但是现代工业糖浆常通过过滤减少掺假蔗糖中的细胞碎片,给镜检法扫描蔗糖掺假带来一定难度,只能作为蜂蜜掺假与否的辅助检测手段。纳文娟等[26]利用淀粉酶活性变化测定蜂蜜中添加的蔗糖和淀粉,原理是掺入的蔗糖和淀粉转化为还原糖时需要消耗淀粉酶,造成淀粉酶降低,缺点是单纯依靠酶活性测定很容易出现假阳性和假阴性结果。本实验采用分子生物学手段直接检测糖浆中的DNA,只需要20ng 的DNA 就可以进行PCR,操作步骤简便,成本较低,流程较短,而且能有效避免检测中常见的假阳性结果。
本文建立了提取液体麦精,玉米糖浆DNA 的方法,并以特异性引物PCR 扩增得到了较好的结果,能够明显区分液体麦精和玉米糖浆,为以分子生物学手段检测液体麦精的掺假奠定了基础。
[1]李雁勤.大麦的利用价值及开发前景[J].中国食物与营养,1997(4):17-20.
[2]陈海华,董海洲.大麦的营养价值及在食品业中的利用[J].西部粮油科技,2002(2):34-36.
[3]王海明,丁长河.糖浆在啤酒行业中的应用[J].酿酒科技,2004,123(3):58-60.
[4]Gaby A R.Adverse effects of dietary fructose[J].Alternative Medicine Review,2005,10(4):294-306.
[5]Fadel J G,Newman C W,Newman R K,et al.Effect of pelleting and beta-glucanase supplementation on the ileal and fecal digestibility of a barley-based diet in the pig[J].Journal Animal Science,1989,67(5):1293-1298.
[6]马利,孙长华,张宝,等.红外光谱技术在食品掺假检验中的应用进展[J].生命科学仪器,2010(8):3-5.
[7]袁玉伟,张志恒,叶雪珠,等.蜂蜜掺假鉴别技术的研究进展与对策建议[J].食品科学,2010,31(9):318-321.
[8]Qin Chen,Shasha Wei,Zhirui Deng,et al.Optimization of DNA extraction from seeds of Sorghum sudanense(Piper)Stapf[J].Notulae Botanicae Horti Agrobotanici Cluj-Napoca,2009,37(1):256-260.
[9]E M Moller,G Bahnweg,H Sandermann,et al.A simple and efficient protocol for isolation of high molecular weight DNA from filamentous fungi,fruit bodies,and infected plant tissues[J].Nucleic Acids Research,1992,20(22):6115-6116.
[10]朱振雷,束永俊,李勇,等.大豆种子DNA 快速提取方法的改良及应用[J].东北农业大学学报,2009 40(10):60-63.
[11]徐亚维,柴晓杰,王丕武.玉米淀粉分支酶sbeIIb 基因启动子的克隆和表达载体构建[J].玉米科学,2006,14(2):84-87.
[12]闫永荣,张正英,李静雯,等.大麦醇溶蛋白基因片段克隆和RNAi 植物表达载体构建[J].科技导报,2010,28(12):52-55.
[13]张海燕,李国田,王晓杰,等.小麦过氧化物还原酶基因TaPrx 的克隆与功能初步分析[J].中国农业科学,2009,42(4):1222-1229.
[14]徐伟丽,李启明,汪家琦,等.麦芽糊精基因组DNA 不同提取方法的比较[J].食品工业科技,2011,32(9):217-219.
[15]Fang G,Hammar S,Grumet R.A quick and inexpensive method for removing polysaccharides from plant genomic DNA[J].Bio Techniques,1992,13:52-56.
[16]郭大龙,吴正景.一种简单有效的去除植物DNA 中多糖等杂质的方法[J].生物技术,2008,18(5):31-33.
[17]Su X,Gibor A.A method for RNA isolation from marine macro-algae[J].Anal Biochem,1988,174:650-657.
[18]Bahloul M,Burkard G.An improved method for the isolation of total RNA from spruce tissues[J].Plant Mol Biol Reptr,1993,11:212-215.
[19]Ainsworth C.Isolation of RNA from floral tissue of Rumex acetosa(sorrel)[J].Plant Mol Biol R eptr,1994,12:198-203.
[20]申志勇,张成岗.PCR 引物特异性评估体系及多重PCR引物设计系统的构建与应用[D].北京:中国人民解放军军事医学科学院,2009.
[21]刘阳,杨淑霞,李敏惠,等.引物浓度与退火温度不当导致巢式PCR 非特异性扩增[J].成都医学院学报,2008,3(2):111-114.
[22]韩建勋,黄文胜,吴亚君,等.果汁中梨成分分子生物学鉴伪-实时荧光PCR 方法研究[J].中国食品学报,2010,10(1):207-212.
[23]杨冬燕,杨永存,杨小柯,等.物种特异性基因扩增鉴别掺假食用植物油[J].中国卫生检验杂志,2011,21(9):2120-2125.
[24]Padovan G J,De Jong D,Rodrigues L P,et al.Detection of adulteration of commercial honey samples by the 13C/12C isotopic ratio[J].Food Chemistry,2003,82(4):633-636.
[25]Kerkvliet J D,Shrestha M,Tuladha K,et al.Microscopic detection of adulteration of honeywith cane sugar and cane sugar products[J].Apidologie,1995,26(2):131-139.
[26]纳文娟,张云霞.掺假蜂蜜和市售蜂蜜的检测分析[J].中国食物与营养,2008(6):47-49.
