一株章鱼肠道共生菌的筛选鉴定及抑菌谱研究
2013-08-07邓加聪陈文韬
邓加聪,郑 虹,陈文韬
(福建师范大学福清分校,福建福清350300)
微生物资源及其产生的活性化合物是地球上最为丰富的自然资源之一,是药物发现的重要来源。在目前陆地微生物发现新药几率急剧下降的形势下,海洋微生物次生代谢产物特别是海洋稀有放线菌已成为作用机制新颖、化学结构多样化的新药先导化合物的来源[1-3]。目前我国对海洋稀有放线菌及其产生的活性化合物研究不多,总体水平较低。但是,有关海洋生物产生新的生物活性物质的报道逐渐增多,已经从海洋微生物中发现了许多结构新颖的化合物,这些化合物具有较高的抗肿瘤活性。海洋放线菌是海洋细菌抗肿瘤活性物质的重要来源,最先成为海洋微生物研究的热点[4-6]。动物肠道微生物对于特定的动物生长发育而言是一种整体的、全面的、平衡的群体。近年来,随着对肠道共生菌研究的不断深入,肠道共生菌的多种生物学功能不断被发现,如肠道共生菌产生的多种抗生素对多种植物及人类病原菌有广泛的抑菌活性;产生的杀虫毒素对许多害虫有较强的致死作用等,体现出广阔的开发利用前景[7-9]。因此,对动物肠道中海洋微生物的研究具有很好的发展前景,为寻求新的药物或者抑菌物,本文对无脊椎动物章鱼肠道中的共生菌进行筛选、观察、16S rDNA 鉴定、抑菌譜研究等,来了解章鱼肠道中共生菌的抑菌情况,以便进一步开发研究。
1 材料与方法
1.1 材料与仪器
活章鱼 购买自自福清市东壁岛海产品市场;大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、藤黄八叠球菌(Sarcina lutea)、白色念珠菌(Monilia albicans)、短小杆菌(Bacillus pumilis)、青枯病菌(Bacterial wilt)、枯草芽孢杆菌(Bacillus subtilis)、青霉、木霉、根霉、黑曲霉、黄曲霉、玉米病菌 福建师范大学福清分校生化系微生物实验室提供;Taq 酶、dNTP、琼脂糖、DNA 纯化试剂盒等药品 购自上海生物工程有限公司;牛肉膏蛋白胨培养基、PDA 蔗糖培养基、高氏I 号培养基 购自上海国药集团化学试剂有限公司;分离培养基、发酵培养基、燕麦粉琼脂培养基、无机盐淀粉培养基、酵母膏-麦芽糖培养基、查氏培养基 参照文献《微生物学实验教程》[10]配方自主配制。
生化培养箱SPX-150B-Z 上海博讯实业有限公司医疗设备厂;超净工作台SW-CJ-IFD 苏州安泰空气技术有限公司;立式压力蒸汽灭菌器LDZX-50KB 上海申安医疗器械厂;大容量恒温振荡器THZ-25 太仓市华美生化仪器厂;台式低速大容量离心机L-550 湘仪离心机有限公司;PCR 仪 美国Bio-rad 公司;水平电泳槽 北京六一仪器厂;电热恒温鼓风干燥箱DHG-9070A 上海精宏实验设备有限公司。
1.2 实验方法
1.2.1 海洋肠道抗菌性放线菌的筛选 章鱼表面用75%酒精消毒,在超净工作台上进行解剖,取其肠道作为样品,将样品剪碎、混合,备用;称取1g 样品放入装有9mL 无菌水的试管中,稀释度即为10-1,按10倍稀释法进行梯度稀释,稀释度为10-2、10-3、10-4、10-5、10-6、10-7;分别吸取不同梯度的稀释液0.2mL,涂布于装有分离培养基的平板,每个稀释度涂布3个平板,于28℃培养箱中倒置培养5~7d;挑取菌落大的菌株划线分离培养基,挑取单菌落接种于试管斜面28℃培养,并于4℃冰箱保存,备用。
1.2.2 抗菌性放线菌的复筛 将初筛得到的菌株接种于发酵培养基,30℃150r/min 振荡培养72h,以金黄色葡萄球菌为指示菌,采用双层平板透明圈法测定发酵液的抑菌作用。
每株菌重复3 个平行实验。
1.2.3 菌株D-8 的培养与生理生化特征的确定 参考《伯杰氏细菌鉴定手册》[11]、《放线菌快速鉴定与系统分类》[12]等相关文献对菌株的形态、培养及生理生化特性进行鉴定。
1.2.4 16S rDNA 基因序列测定和分析
1.2.4.1 菌株基因组DNA 的提取 将活化后的菌株采用碱提取法提取菌株D-8 基因组DNA[13-14]。
1.2.4.2 16S rDNA 的PCR 扩增和测序 根据16S rDNA 的保守区设计扩增引物,正向引物16s-F:5'-AGAGTTTGATCATGGCCTCAG-3';反向引物16s-R:5'-GGTTACCTTGTTACGACTT-3'。PCR 反应体系(50μL)为:10 ×Tap Buffer 5μL、dNTP 1μL、PCR 引物各1μL、Taq 酶1μL、DNA 模板1μL,加无菌双蒸水至50μL。PCR 反应条件为:94℃预变性5min,94℃30s,55℃ 30s,72℃延伸1min,循环 35 次,72℃10min。16S rDNA 扩增产物用0.8%琼脂糖凝胶进行电泳检测,产物用试剂盒纯化后进行测序。
1.2.4.3 系统进化树的构建 测序结果与Ncbi 的GenBank 中已知序列进行比对,用MAGE5.2 软件以N-J 法构建进化树,进行系统发育分析。
1.2.5 菌株抑菌性实验及其抑菌谱实验1.2.5.1 抑菌性实验 采用双层平板透明圈法[15]。培养皿中加入10mL 牛肉膏蛋白胨培养基(下层),摇匀铺平,再加入7mL 牛肉膏蛋白胨培养基(60℃左右含有指示菌终浓度为106个/mL),之后迅速放入灭过菌的牛津杯,完全凝固后备用。每个杯中加入200μL 样品,36℃下培养24h,观察并测量透明圈的直径。
1.2.5.2 抑菌谱实验 抗细菌活性实验:双层平板透明圈法(同上);抗丝状真菌活性实验:采用滤纸片法[16-17],将指示菌点接于PDA 平板培养基上,28℃下培养24~36h,待菌落长到约5cm 左右,将浸泡有样品的滤纸片(直径:5mm)放至菌落外围0.5cm 处,以无菌蒸馏水为对照,28℃培养24h,观察结果。
2 结果与分析
2.1 章鱼肠道放线菌的筛选及菌株形态观察
2.1.1 章鱼肠道放线菌的筛选 经过稀释涂布及划线分离等方法,从新鲜章鱼肠道中筛选到12 株菌落大、抑菌活性较高的放线菌,结果见图1。

图1 不同菌株抑菌性的比较Fig.1 The compare of different strains’antibacterial
由图1 可见,菌株8 的透明圈直径最大,为2.61cm,说明菌株8 的抑菌活性最高。不同菌株间抑菌性的高低如下:D-8 >D-6 >D-10 >D-12 >D-2>D-1 >D-11 >D-3 >D-5 >D-9 >D-7 >D-4,因此选择菌株8 进行下列实验。
2.1.2 放线菌菌株形态观察及生理生化鉴定 参见文献《放线菌快速鉴定与分类系统》对菌株D-8 进行菌株形态及生理生化实验。结果见图2、表1、表2。

图2 放线菌D-8 的形态特征Fig.2 Actinomycetes’(D-8)morphological characteristics
由图2 可见,该菌株在高氏Ⅰ号固体培养基上菌落较小,乳白色,干燥,不透明,难挑取。在显微镜下观察,菌株菌丝不断裂、无横隔、具有良好的分枝菌丝。
菌株D-8 部分生理生化鉴定结果见表1、表2,该菌株革兰氏染色为阳性,硫化氢实验阳性,能水解明胶、几丁质、酪蛋白、纤维素及淀粉,糖发酵实验中不利用棉子糖;该菌株在不同培养基上的菌落形态有所差别,在无机盐淀粉培养基上生长会产生黄色可溶性色素,其他培养基上均不产可溶性色素。参考《伯杰氏细菌鉴定手册》和《放线菌快速鉴定与分类系统》中放线菌的分类方法,根据菌株的生理生化特性及在不同培养基上的菌丝特征初步判断该菌株属于链霉菌属(Streplomyces)。

表1 菌株D-8 部分生理生化特性Table 1 Strain’s(D-8)part physiological and biochemical features

表2 菌株D-8 在不同培养基上的形态特征Table 2 Strain’s(D-8)morphological characteristics in different mediums
2.2 放线菌D-8 的16S rDNA 的测序和分析
测序获得菌株16S rDNA 的序列大小为1542bp,将测序所得的16S rDNA 序列通过NCBI 的BLAST进行在线比对,结果表明该菌株的序列与链霉菌属的多个链霉菌具有99%以上的同源性。根据同源性高低,随机挑取若干个序列,采用MAGE5.2 软件构建菌株系统进化树,结果见图3。

图3 菌株D-8 的系统进化树Fig.3 Strain’s(D-8)phelogenetic tree
从图3 可见,菌株D-8 与链霉菌菌属聚为一类,且与登陆号等链霉菌16S rDNA 序列的同源性最高达到99%。因此,在细菌系统发育分类学上,初步将该菌株归属为链霉菌。
2.3 菌株抑菌谱的测定
2.3.1 放线菌D-8 对细菌的抑菌谱 放线菌D-8 30℃150r/min 振荡培养72h,发酵液4℃8000r/min离心10min 得上清液,采用双层平板透明圈法测定上清液对各种细菌的抑菌性。结果见图4。

图4 放线菌D-8 对各种细菌的抑制作用Fig.4 The inhibiting effect of Actinomycetes’(D-8)to different bacterias
由图4 可见,放线菌D-8 对革兰氏阴性菌和革兰氏阳性菌均有明显的抑菌作用,对各种指示菌抑菌作用的强弱如下:金黄色葡萄球菌>藤黄八叠球菌>大肠杆菌>白色念珠菌>枯草芽孢杆菌>青枯病菌>短小杆菌,其中对金黄色葡萄球菌的抑菌性可达到2.63cm。表明该菌株是一株具有广谱抑菌作用的菌株。
2.2.2 放线菌D-8 对真菌的抑菌谱 放线菌D-8 30℃150r/min 振荡培养72h,发酵液4℃8000r/min离心10min 得上清液,采用滤纸片法测定上清液对各种真菌的抑菌性,以滤纸片周围的透明圈大小为判定该菌株对指示菌抑菌作用的强弱。结果见表3。
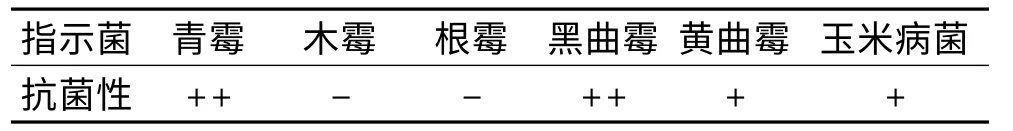
表3 放线菌D-8 对各种真菌的抑制作用Table 3 The inhibiting effect of Actinomycetes’(D-8)to different fungus
由表3 可见,放线菌D-8 对部分真菌有抗性,而对一些真菌无抗菌性。
3 结论
本文从章鱼肠道中筛选得到一株具有抗菌活性的链霉菌菌株D-8。抑菌实验结果显示,该菌株对革兰氏阴性菌和革兰氏阳性菌均有明显的抑菌作用,对各种指示菌抑菌作用的强弱如下:金黄色葡萄球菌>藤黄八叠球菌>大肠杆菌>白色念珠菌>枯草芽孢杆菌>青枯病菌>短小杆菌,具有广谱的抑菌活性。常规生理生化测试结果表明,菌落较小,乳白色,干燥,不透明,难挑取。在显微镜下观察,菌株菌丝不断裂、无横隔、具有良好的分枝菌丝,革兰氏染色为阳性。
从16S rDNA 基因序列相似性和系统发育树上看,该菌株与链霉菌有99%以上的同源相似性,表明该菌株与链霉菌菌属的亲缘关系最近。综上所述,从形态、生理生化、16S rDNA 基因序列同源性、系统发育学等方面分析,菌株D-8 可鉴定为海洋放线菌中的链霉菌,具有广谱的抑菌活性。本研究为新化合物的寻找打下基础。
[1]王海雁,刘健,赵淑江.海洋放线菌多样性及其代谢产物研究进展[J].中国海洋药物,2010,29(1):67-75.
[2]曾湘,郑天凌.海洋活性肽研究的回顾与展望[J].世界科技研究与发展,2009,31(6):1012-1016.
[3]姜怡,唐蜀昆,王永霞,等.海洋放线菌分离方法[J].微生物学通报,2006,33(6):153-155.
[4]田新朋,张偲,李文均.海洋放线菌研究进展[J].微生物学报,2011,51(2):161-169.
[5]Saadoun I,Wahiby L,Ababneh Q,et al.Recovcry of soil streptomycetes from arid habitats in Jordan and their potential to inhibit multi-drug resistant Pseudomonas aeruginosa pathogens[J].World Journalof Microbiolog Y and Bioteehnology,2008,24(2):157-162.
[6]Gupta J C,Pandey G,Mukherjee K J.Two-stage cultivation of recombinant Saccharomyces cerevisiae to enhance plasmid stability under non-selective conditions:experimental study and modeling[J].Enzyme and Microbial Technology,2008,28(1):89-99.
[7]李鹏,苗增良,王健鑫,一株产黑褐色色素海洋放线菌的研究[J].海洋环境科学,2011,30(5):689-693.
[8]Zhao Jian,Lan Xiao - jun,Su Jun,et al.Isolation and identification of an alkaliphilic Bacillus flexus XJU - 3 and analysis of its alkaline amylase[J].Acta Microbiologica Sinica,2008,48(6):750~756.
[9]Gazi M R,Kanda K,Yasuda M,et al.Optimisation of culturalcoditions and some properties of radical scavenging substance from Sporobolomyces salmonicolor[J].Pakistan Joumal of Biological Sciences,2010,7(8):1365-1370.
[10]周德庆. 微生物学实验教程[M].北京:高等教育出版社,2011.
[11]布瑞德.伯杰氏鉴定细菌学手册[M]. 第8 版. 北京:科学出版社,1984.
[12]阮继生,黄英.放线菌快速鉴定与系统分类[M].北京:科学出版社,2011.
[13]莎姆布鲁克. 分子克隆实验指南[M]. 黄培堂(译).北京:科学出版社,2005.
[14]刘炳辉,曹远银,闫建芳,等.6 种链霉菌基因组DNA 提取方法比较[J].河南农业科学,2008(10):86-89.
[15]满德慧,邓尚贵,唐艳,等.竹荪等4 种植物提取物的抑菌效果及复配研究[J].浙江海洋学院学报:自然科学版,2011,30(2):137-141.
[16]沈硕,王舰.青海盐湖地区嗜盐菌的分离纯化及抑制植物病原菌的活性初探[J].广东农业科学,2013(1):79-81,88.
[17]王静,杨澄然,郭芳芳,等.一株放线菌的分子鉴定与抗菌谱研究[J].安徽农业科学,2011,39(34):20964-20967.
