利妥昔单抗免疫化疗联合自体外周血干细胞移植治疗CD20+B细胞性非霍奇金淋巴瘤的临床研究
2013-08-07陈永升孔佩艳曾东风李杰平陈幸华张曦李佳丽尹晓林张诚王庆余孔祥敬何圆圆
陈永升,孔佩艳,曾东风,李杰平,陈幸华,张曦,李佳丽,尹晓林,张诚,王庆余,孔祥敬,何圆圆
利妥昔单抗免疫化疗联合自体外周血干细胞移植治疗CD20+B细胞性非霍奇金淋巴瘤的临床研究
陈永升,孔佩艳,曾东风,李杰平,陈幸华,张曦,李佳丽,尹晓林,张诚,王庆余,孔祥敬,何圆圆
目的分析和探讨利妥昔单抗联合自体外周血造血干细胞移植(APBSCT)序贯维持治疗对CD20+B细胞非霍奇金淋巴瘤(NHL)的疗效。方法搜集2005年1月-2011年1月诊断为侵袭性和(或)难治复发性CD20+B细胞NHL并接受APBSCT治疗的60例患者的临床资料。分为2组:治疗组(n=25),APBSCT前应用利妥昔单抗3~4次,采集自体干细胞前1d加用利妥昔单抗治疗1次(375mg/m2)体内净化干细胞,移植后每3~6个月应用利妥昔单抗联合白细胞介素-2(100万U/次,缓慢静滴)维持治疗3~4次;对照组35例,除未用利妥昔单抗以外,其他处理与治疗组相同。结果利妥昔单抗在移植前、干细胞采集前及移植后巩固治疗中均未发现明显不良反应。治疗组和对照组采集单个核细胞数分别为(8.2±2.9)×108/kg和(8.4±3.9)×108/kg(P=0.822),CD34+细胞数分别为(12.3±12.7)×106/kg和(13.2±13.9)×106/kg (P=0.799)。治疗组均顺利完成造血重建,对照组3例造血重建失败。两组中性粒细胞恢复时间和血小板恢复时间差异无统计学意义。移植后所有病例均达完全缓解(CR),中位随访22(2~81)个月,治疗组2例复发,对照组6例复发。治疗组3年总体生存率有高于对照组的趋势(91.6%vs69.5%,P=0.060)。结论侵袭性和(或)难治复发性CD20+B细胞NHL患者APBSCT前后应用利妥昔单抗不影响造血干细胞的采集和造血重建,且有望提高治疗效果、改善总体生存。
利妥昔单抗;造血干细胞移植;CD20+B细胞淋巴瘤
自体造血干细胞移植(autologous peripheral blood stem cell transplantation,APBSCT)支持下的高剂量治疗(high-dose therapy,HDT)已被公认为难治复发性和(或)侵袭性非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)的一线治疗[1-3],但40%~60%的NHL患者在接受APBSCT治疗后仍复发并最终死亡[4],复发根源主要在于移植物中残留的淋巴瘤细胞,或高剂量预处理未能清除的体内残存淋巴瘤细胞,即微小残留病变(m inimal residual disease,MRD)[5]。利妥昔单抗(rituximab,R)是针对CD20的特异性抗体,95%的B系淋巴瘤细胞表达该抗原。APBSCT前使用利妥昔单抗可改善侵袭性或难治复发性CD20+B细胞NHL患者的预后,提高生存率[6];移植后使用利妥昔单抗维持治疗,有改善淋巴瘤患者无事件生存率(event free survival,EFS)的趋势[7]。国内已有利妥昔单抗联合化疗(或利妥昔单抗免疫化疗)和APBSCT治疗侵袭性NHL的研究[8-9],但既往报道纳入的病例数均较少。为此,本研究纳入2005年1月-2011年1月采用利妥昔单抗免疫化疗联合APBSCT治疗60例侵袭性或难治复发性CD20+B细胞NHL,获得了较满意的疗效,现报告如下。
1 资料与方法
1.1病例资料 60例NHL患者,年龄5~64(平均38)岁,中位年龄41岁,男性38例,女性22例。所有患者均经病理诊断为B细胞NHL,同时经免疫组化证实为CD20阳性或强阳性,结合Ki67表达水平、病史及既往治疗确定为侵袭性或难治复发性。将本组病例分为治疗组(APBSCT+利妥昔单抗组,n=25)和对照组(APBSCT,n=35)。治疗组中,初诊侵袭性Ⅲ-Ⅳ期22例(22/25),复发难治3例(3/25);对照组中,初诊26例(26/35),复发7例(7/35),难治2例(2/35)。两组患者在初诊和复发率方面差异均无统计学意义(P=0.190,P=0.412)。两组年龄、性别、疾病构成、临床分期、国际预后指数(international prognostic index,IPI)、移植前疾病状况等临床基线情况相比差异无统计学意义(P>0.05,表1),两组病例基线情况差异无统计学意义,具有可比性。
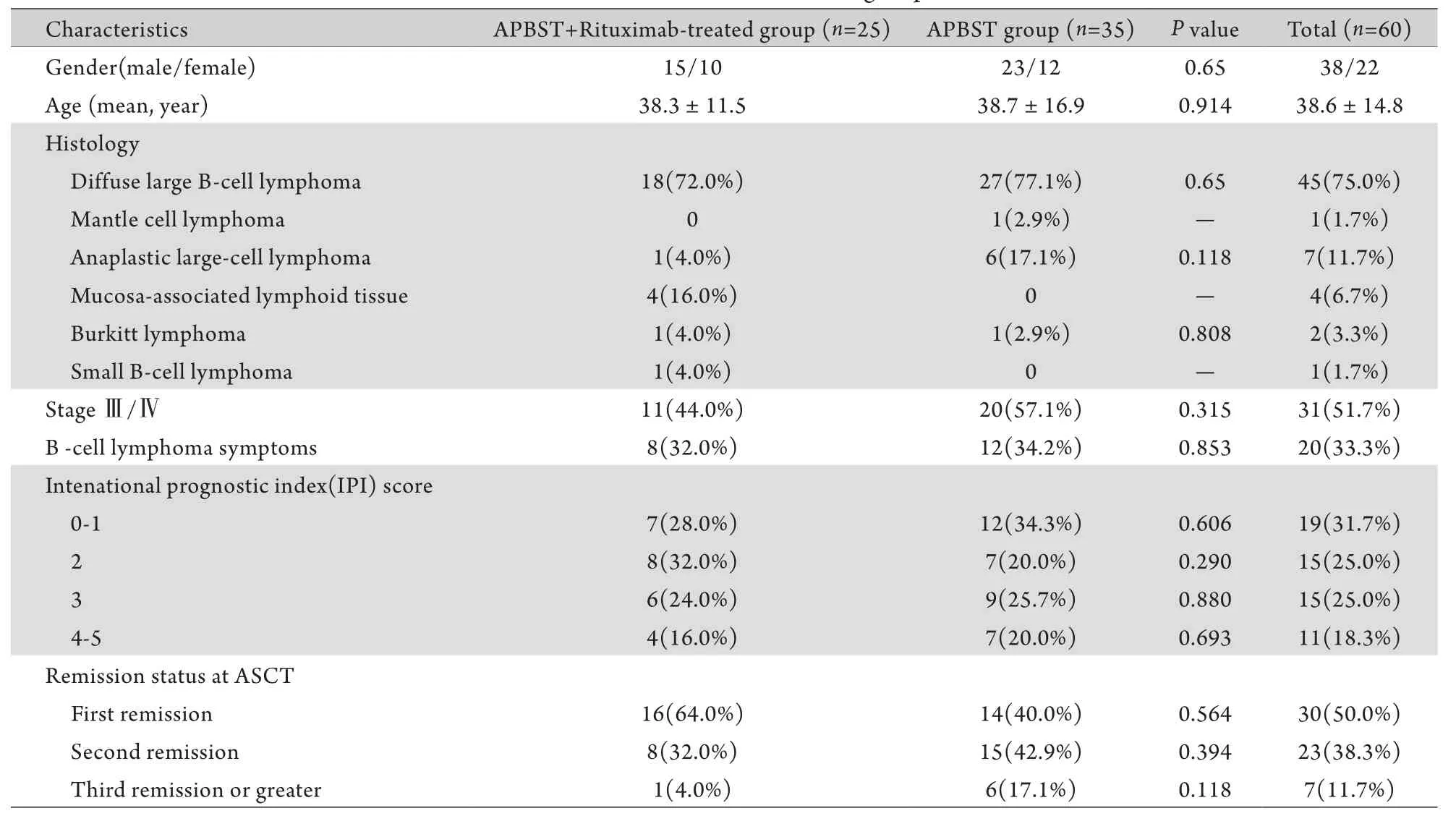
表1 两组临床资料特征比较Tab. 1 Clinical features of two groups
1.2移植前后的处理
1.2.1移植前化疗 治疗组于移植前给予3~4个疗程含利妥昔单抗(R)+CTOP/CMOP[利妥昔单抗(rituxim ab) 375m g/m2,d1+环磷酰胺(cyclophospham ide)600~800mg/m2,d1;吡柔比星(pirarubicin) 35mg/m2,d1~d2或米托蒽醌(mitoxantrone) 6mg/m2,d1~d3;长春新碱(vincristin) 1.4mg/m2,d1;泼尼松(prednisone) 1mg/kg,d1~d7]方案治疗,并在此基础上加用大剂量甲氨蝶呤(MTX,1.0~3.0g/m2)强化化疗1~2次;对照组则不含利妥昔单抗治疗,余用药方案与治疗组相同。
1.2.2外周血干细胞的动员与采集 治疗组和对照组的动员方案均为常规化疗(CTOP±MTX或MOEP方案)+G-CSF。联合化疗后,在WBC降至低谷并开始回升时予G-CSF (5~10μg/kg,1/d,皮下注射),WBC>5.0×109/L时开始采集。治疗组在采集干细胞的前一天加用利妥昔单抗(375mg/m2)进行体内净化。采用血细胞分离机(CS3000plus型,Baxter公司)进行体外自体外周血造血干细胞采集,循环血量为2~4倍体循环血量,经1~2次采集,获得足够数量干细胞。
1.2.3预处理方案 采用CEAC方案[洛莫司汀(lom u stin e) 0.2g/m2×1 d,依托泊苷(etoposide) 100mg/m2×4d),阿糖胞苷(cytosine arabinoside) 100m g/m2,q12h×4d,环磷酰胺(cyclophosphamide)1.5g/m2×4d]。
1.2.4移植后巩固和维持 治疗组移植后给予利妥昔单抗(375mg/m2)联合小剂量重组人白细胞介素-2(IL-2,100万U/次,缓慢滴注)维持治疗,每3~6个月1次;对照组单独采用小剂量重组人IL-2 (剂量、用法同治疗组)维持治疗,两组维持治疗疗程为移植后18个月。
1.3疗效评价标准与随访 完全缓解(com p lete rem ission,CR):所有病变的影像学和生物学异常消失,无新病灶;部分缓解(partial response,PR):病变减少>50%,且无新病灶;疾病进展(progressional disease,PD):出现新的病灶,或原病灶扩大>25%,或在治疗期间原最小病灶增加>50%。所有病例在治疗过程中每疗程结束后、治疗完成后每3~6个月返回医院进行相关检查,并评判疗效,包括浅表淋巴结,腹腔及腹膜后淋巴结超声,胸腹、盆腔CT或全身PET-CT扫描,骨髓穿刺联合活检等检查,以及血常规、肝肾功能、LDH和β-MG等检验结果。
1.4统计学处理 采用SPSS 13.0统计软件进行分析。总生存时间(overall survival,OS)定义为自体干细胞移植起至死亡的时间间隔,统计时仍生存的病例按移植起的实际生存时间计算。无事件生存(event-free-survival,EFS)定义为自移植起至疾病进展的时间。移植相关死亡(transplantation related mortality,TRM)为移植后100d内的死亡。OS和EFS采用Kaplan-Meier分析进行计算,假设检验采用logrank检验完成;率的比较采用χ2检验,参数检验采用t检验。双侧检验,P<0.05为差异有统计学意义。
2 结 果
2.1外周血干细胞采集数量 所有患者均在2次内采集成功。治疗组和对照组采集单个核细胞(mononuclear cell,MNC)分别为(8.2±2.9)×108/kg和(8.4±3.9)×108/kg(P=0.822),CD 34+细胞数分别为(12.3±12.7)×106/kg和(13.2±13.9)×106/kg (P=0.799)。
2.2造血重建 治疗组均成功实现造血重建,对照组3例造血重建失败。治疗组和对照组至中性粒细胞计数绝对值﹥0.5×109/L的时间分别为10.2±2.6d和9.5±2.1d(P=0.319),至血小板计数﹥20×109/L的时间分别为11.9±4.7d和10.9±2.6d(P=0.327)。
2.3移植后感染 治疗组和对照组分别有17例和26例发生感染,两组感染率差异无统计学意义(68.0%vs74.2%,P=0.594)。临床表现主要是反复发热(T>38.5℃)、血培养细菌阳性、肺部感染体征、口腔溃疡(包括真菌生长)、急性胆囊炎、病毒性感染等。治疗组2例确诊为带状疱疹感染,部分患者偶见口腔黏膜损害、牙龈炎、肛周感染,所有患者的血培养和痰培养均为阴性。对照组1例为腹腔结核杆菌感染,2例为败血症(分别为草绿色链球菌和人葡萄球菌),2例为带状疱疹。两组患者绝大多数感染出现在造血干细胞回输后1~2周的粒细胞缺乏期。感染控制均较顺利,未发生相关死亡。
2.4其他移植相关并发症及死亡 治疗组中,1例移植患者在3个月时死于暴发性肝衰竭,1例于移植后5个月发生肺部感染、心力衰竭等多器官功能衰竭死亡。对照组3例造血重建失败,其中2例于移植后3周死于肺部感染,另外1例于移植后23d死于脑出血,移植相关病死率(transplantation related mortality,TRM)为8.33%。
2.5随访和疗效评估 随访中位时间为22(2~81)个月,治疗组3年OS有高于对照组的趋势,但差异无统计学意义(91.6%vs69.5%,P=0.060,图1A)。治疗组与对照组3年EFS比较,差异无统计学意义(84.6%vs80.8%,P=0.41,图1B),其中治疗组复发2例,其余病例目前仍处于完全缓解状态,CR率92.0%;对照组复发6例,CR率82.8%。
3 讨 论
利妥昔单抗是一种人鼠嵌合型抗CD20单克隆抗体,与CD20有很高的亲和力,结合后通过抗体依赖细胞毒作用、补体依赖细胞毒作用及促进肿瘤细胞发生凋亡等免疫效应机制清除B细胞[10]。正常淋巴细胞自前体B淋巴细胞至活化B淋巴细胞阶段均表达抗原CD20,且不会从细胞表面脱落或与配体结合后被内化[11-12]。约90%的NHL来源于B淋巴细胞,90%以上的B细胞NHL表达CD20抗原。利妥昔单抗能够在清除来源于B淋巴系肿瘤细胞的同时又不损伤造血干细胞,因此成为NHL分子靶向治疗的重要单克隆抗体。利妥昔单抗还可增加肿瘤细胞对化疗药物的敏感性,与化疗具有协同作用[13],因此在治疗B-NHL方面具有重要的应用前景。目前含利妥昔单抗(Rituximab)的R+CHOP方案已成为B细胞NHL治疗的金标准。

图1 治疗组与对照组的OS(A)和EFS(B)曲线Fig. 1 OS(A) and EFS(B) curves of treatment and control group
大剂量化疗加自体干细胞移植(HDT-ASCT)是治疗复发难治的弥漫大B细胞淋巴瘤(DLBCL)和滤泡性淋巴瘤的标准治疗方案。但目前利妥昔单抗在体内净化干细胞及其在移植后维持治疗的作用仍有争议[14],且由于利妥昔单抗巩固治疗会延长免疫球蛋白的抑制时间,有增加患者感染的可能性,因此,在自体造血干细胞移植治疗侵袭性和难治复发性B细胞淋巴瘤时,联合应用利妥昔单抗是否可进一步提高疗效,及其安全性问题均有待进一步研究证实。
本研究对60例具有APBSCT适应证的CD20+B细胞NHL患者进行了临床观察,其中25例患者接受了利妥昔单抗与APBSCT的联合治疗。本研究在移植前给予3~4个疗程的利妥昔单抗,自体干细胞采集前给予利妥昔利单抗体内净化;移植后给予利妥昔单抗联合小剂量IL-2序贯维持,以期最大限度地清除残留病灶,减少复发。同时,我们选择进行自体造血干细胞移植,但未使用利妥昔单抗的患者和移植后单纯采用小剂量IL-2维持治疗的35例患者进行了对比研究。两组患者年龄、性别、疾病构成、临床分期、IPI、移植前疾病状况等临床资料基线无明显差异;除外利妥昔单抗以外的化疗方案、干细胞动员方案和预处理方案等均无统计学差异。
国外已有多个前瞻性研究报道,利妥昔单抗在自体干细胞动员前给予体内净化,近80%~90%的干细胞采集产物肿瘤细胞转阴,且对动员和采集无明显影响[15-16]。本研究结果也表明,无论是否使用利妥昔单抗,患者均能采集到足够数量的外周血造血干细胞,利妥昔单抗治疗组移植后均能获得造血重建,而对照组有3例造血重建失败,但并无统计学差异。两组患者中获得造血重建者的粒细胞、血小板恢复时间等无统计学差异,表明移植前使用利妥昔单抗对B细胞NHL干细胞的采集、造血重建并无影响,与文献报告的结果相符。
Kasam on等[17]报道了采用利妥昔单抗联合APBSCT治疗73例B细胞淋巴瘤的结果,证实患者免疫功能延迟恢复,主要表现为IgG水平持续低下,提示利妥昔单抗联合APBSCT治疗时需特别关注患者的感染状况。本研究比较了两组移植患者感染发生情况,加利妥昔单抗的治疗组与对照组的感染发生率分别为68.0%和74.2%(P>0.05)。感染绝大多数发生于移植后造血尚未重建的粒细胞缺乏期间,及时给予碳青酶烯类、替考拉宁及伏立康唑等积极抗感染治疗后,大多数患者感染很快得到控制,体温恢复正常。对照组1例移植后23d未实现造血重建,死于脑出血,另2例患者移植后约3周亦未实现造血重建,患者死于肺部感染,表明感染主要与粒细胞缺乏的时间较长有关,而与利妥昔单抗的应用似无明显相关性。对大量临床资料的Meta分析也显示,常规化疗基础上加用利妥昔单抗并不增加感染发生率[16]。
Khouri等[18]对67例复发的CD20+侵袭性B细胞淋巴瘤在化疗动员前后均使用利妥昔单抗进行体内净化,移植后短期内给予利妥昔单抗1~2次巩固治疗,2年生存率从53%提高到80%,无事件生存率从43%提高到67%,表明利妥昔单抗联合APBSCT有提高B细胞性NHL患者OS和EFS的趋势。但由于利妥昔单抗价格昂贵,国内的临床治疗中心完全参照NCCN指南,将利妥昔单抗应用于CD20+B细胞性NHL的治疗中还存在诸多困难。为此,对于病理、免疫组化等确诊为CD20+的侵袭性或难治复发性B细胞NHL患者,在获得患者及其家属的知情同意后,可尝试于移植前先用利妥昔单抗(R)+CTOP/CMOP方案化疗3~4个疗程,再于采集干细胞前加用利妥昔单抗体内净化干细胞治疗,移植后每3个月给予利妥昔单抗联合小剂量IL-2维持治疗。本研究中对照组患者大多数因家庭经济条件限制等因素并未使用利妥昔单抗治疗。
本研究结果显示,移植后中位随访22(2~81)个月,利妥昔单抗组3年生存率为91.6%,对照组则为69.5%(P=0.060)。两组间差异无统计学意义,考虑可能与病例数偏少、随访时间过短有关,有待对该组患者继续追踪随访,并进一步扩大病例数进行研究。从生存曲线可以看出,治疗组在移植后3年左右达平台期,对照组则持续下降,提示对于CD20+B-NHL患者的APBSCT治疗,在加用利妥昔单抗治疗后的主要获益是清除残留病灶、减少患者的远期复发。
综上,利妥昔单抗免疫化疗联合APBSCT治疗方案对于侵袭性和难治复发性CD20+B细胞NHL患者的治疗安全、可行和有效,不影响干细胞采集和造血重建,且不增加患者感染的发生率。长期随访的资料也表明,含利妥昔单抗的移植治疗方案可有效清除残留淋巴瘤细胞、减少患者的远期复发,具有提高患者总体生存率的趋势。
[1] Niitsu N. Current treatment strategy of diffuse large B-cell lymphomas[J]. Int J Hematol, 2010, 92(2): 231-237.
[2] Ma J. Evaluation of guideline for treatment of non-Hodgkin's lymphoma in NCCN 2009[J]. Chin J Pract Intern Med, 2009, 29(10): 901-902.[马军. NCCN 2009版非霍奇金淋巴瘤诊疗指南评价[J]. 中国实用内科杂志, 2009, 29(10): 901-902.]
[3] Lu XC, Yu L. Prognosis of treatment for refractory lymphoma[J]. Med J Chin PLA, 2008, 33(10): 1272-1274. [卢学春, 于力. 难治性淋巴瘤的药物治疗进展[J]. 解放军医学杂志, 2008, 33(10): 1272-1274.]
[4] M ilpied N, Deconinck E, Gaillard F,etal. Initial treatment of aggressive lymphoma with high-dose chemotherapy and autologous stem-cell support[J]. N Engl J Med, 2004, 350(13): 1287-1295.
[5] DiPersio JF, Ho AD, Hanrahan J,etal. Relevance and clinical imp lications of tumor cell mobilization in the autologous transplant setting[J]. Bio l Blood Marrow Transplant, 2011, 17(7): 943-955.
[6] Glass B, Ziepert M, Reiser M,etal. High-dose therapy followed by autologous stem-cell transp lantation with and w ithout rituximab for primary treatment of high-risk diffuse large B-cell lymphoma[J]. Ann Oncol, 2010, 21(11): 2255-2261.
[7] Haioun C, Mounier N, Emile JF,etal. Rituximab versus observation after high-dose consolidative first-line chemotherapy with autologous stem-cell transplantation in patients with poor-risk diffuse large B-cell lymphoma[J]. Ann Oncol, 2009, 20(12): 1985-1992.
[8] Cai Y, Wang C, Jiang JL,etal. Application of the anti- CD20 monoclonal antibody (Rituximab) in the treatment of non-Hodgkin's lymphoma[J]. J Leuke Lymph, 2010, 19(4): 203-206. [蔡宇, 王椿, 姜杰玲, 等. 抗CD20单克隆抗体联合自体外周血干细胞移植治疗非霍奇金淋巴瘤的临床研究[J]. 白血病·淋巴瘤, 2010, 19(4): 203-206.]
[9] Shi Yk,Yang S,Han XH,etal. A prospective multicenter study of rituximab com bined with high-dose chem otherapy and auto logous peripheral b lood stem cell transp lantation for aggressive B-cell lymphoma[J]. Chin J Oncol, 2009, 31(8): 592-596. [石远凯, 杨晟, 韩晓红, 等. 利妥昔单抗联合高剂量治疗和自体外周血干细胞移植治疗侵袭性B细胞淋巴瘤的多中心前瞻性研究[J]. 中华肿瘤杂志, 2009, 31(8): 592-596. ]
[10] Lu J, Huang XJ. Rituximab combined with CHOP treat AITL: case report and literature review[J]. Chin J Pract Intern Med, 2011, 31(12): 963-964. [路瑾, 黄晓军. 利妥昔单抗联合CHOP方案治疗血管免疫母T细胞淋巴瘤1例报告[J]. 中国实用内科杂志, 2011, 31(12): 963-964.]
[11] M cLaugh lin P, Grillo-Lopez AJ, Link BK,etal. Rituximab chimeric anti-CD20 monoclonal antibody therapy for relapsed indolent lymphoma: half of patients respond to a four-dose treatment program[J]. J Clin Oncol, 1998, 16(8): 2825-2833.
[12] Lv ZH, Wang XL, Dou JT,etal. Diagnosis of non-Hodgkin lym phom a with bilateral ad renal g land and p ituitary involvement(one case report)[J]. Med J Chin PLA, 2010, 35(1): 97-100. [吕朝晖, 王先令, 窦京涛, 等. 双侧肾上腺及垂体非霍奇金淋巴瘤的诊断(附1例报告)[J]. 解放军医学杂志, 2010, 35(1): 97-100.]
[13] Alas S, Bonavida B. Rituximab inactivates signal transducer and activation of transcription 3 (STAT3) activity in B-non-Hodgkin's lymphoma through inhibition of the interleukin 10 autocrine/paracrine loop and results in down-regulation of Bcl-2 and sensitization to cytotoxic drugs[J]. Cancer Res, 2001, 61(13): 5137-5144.
[14] Lanini S, Molloy AC, Fine PE,etal. Risk of infection in patients with lymphoma receiving rituximab: systematic review and meta-analysis[J]. BMC Med, 2011, 9: 36.
[15] Belhad j K, Delfau-Larue MH, Elgnaoui T,etal. Efficiency ofinvivopurging with rituximab prior to autologous peripheral blood progenitor cell transplantation in B-cell non-Hodgkin's lymphoma: a single institution study[J]. Ann Onco l, 2004, 15(3): 504-510.
[16] Fenske TS, Hari PN, Carreras J,etal. Impact of pre-transplantrituximab on survival after autologous hematopoietic stem cell transplantation for diffuse large B cell lymphoma[J]. Biol Blood Marrow Transplant, 2009, 15(11): 1455-1464.
[17] Kasamon YL, Jones RJ, Brodsky RA,etal. Immunologic recovery follow ing autologous stem-cell transplantation with pre- and posttransp lantation rituximab for low-grade or mantle cell
lymphoma[J]. Ann Oncol, 2010, 21(6): 1203-1210.
[18] Khouri IF, Saliba RM, Hosing C,etal. Concurrent adm inistration of high-dose rituximab before and after autologous stem-cell transplantation for relapsed aggressive B-cell non-Hodgkin's lymphomas[J]. J Clin Oncol, 2005, 23(10): 2240-2247.
A clinical study on the therapeutic effect of rituximab in combination with autologous peripheral blood stem cell transplantation in treatment of CD20+ B cellulous non-Hodgkin lymphoma
CHEN Yong-sheng1,2, KONG Pei-yan1*, ZENG Dong-feng1, LI Jie-ping1, CHEN Xing-hua1, ZHANG Xi1, LI Jia-li1, YIN Xiao-lin2, ZHANG Cheng1, WANG Qing-yu1, KONG Xiang-jing2, HE Yuan-yuan2
1Department of Hematology, Xinqiao Hospital, Third Military Medical University, Chongqing 400037, China
2Department of Hematology, 303 Hospital of PLA, Nanning 530021, China
*
, E-mail: peiyankong@yahoo.com.cn
ObjectiveTo investigate the therapeutic effect of autologous peripheral blood stem cell transplantation (APBSCT) in combination with rituximab in treatment of CD20+B cellulous non-Hodgkin's lymphoma (B-NHL).MethodsSixty patients with CD20+aggressive or refractory and recurrent B-NHL and treated with APBSCT in our department from Jan. 2005 to Jan. 2011 were adm itted. All the subjects were divided into 2 groups according to their own choice: 25 patients
rituximab treatment (treatment group) and 35 patients were treated w ithout rituximab treatment (control group). All patients underwent chemotherapy and APBSCT. For patients in treatment group, rituximab was used with CHOP before collecting the stem cells and after the transplantation. After transplantation, rituximab and IL-2 were used in treatment group every 3-6 months as maintenance treatment.ResultsNo side effect was observed during the use of rituximab either before or after transplantation. The mononuclear cell count in treatment and control group was (8.2±2.9)×108/kg and (8.4±3.9)×108/kg (P=0.822), respectively; CD34+cell count was (12.3±12.7)×106/kg and (13.2±13.9)×106/kg (P=0.799), respectively. Haemopoiesis reconstruction was successfully achieved in the patients of treatment group, while 3 patients in control group failed to have haemopoiesis reconstruction. No significant difference was found between two groups on the recovery time of neutrophilic granulocytes and platelets. All patients achieved complete remission. The average follow-up time was 22 months. The disease relapsed in two patients in treatment groupand six in control group. The 3-year overall survival rate in treatment group (91.6%) was a little higher than that in control group (69.5%,P=0.060).ConclusionTo patients of CD20+B lymphoma, the use of rituximab shows no side effect before or after collection of stem cell and hemopoiesis reconstruction, and the overall survival rate may be improved.
rituximab; hematopoietic stem cell transplantation; lymphoma, B-cell
R733.712
A
0577-7402(2013)07-0591-06
2013-05-08;
2013-06-03)
(责任编辑:沈宁)
国家自然科学基金(30200116)
陈永升,医学硕士,主治医师。主要从事恶性血液病及地中海贫血造血干细胞移植方面的研究
400037 重庆 第三军医大学新桥医院血液科[陈永升(现在解放军303医院血液科)、孔佩艳、曾东风、李杰平、陈幸华、张曦、李佳丽、张诚、王庆余];530021 南宁 解放军303医院血液科(尹晓林、孔祥敬、何圆圆)
孔佩艳,E-mail: peiyankong@yahoo.com.cn
