预处理对丝素促进293T细胞生长的影响
2013-08-06庞广昌王雪青
赵 培,庞广昌,王雪青,田 强,姚 远,王 菲
(天津商业大学a.生物技术与食品科学学院,b.天津市食品生物技术重点实验室,天津300134)
丝素是将蚕丝脱胶后得到的天然蛋白质,不溶于水.由于丝素蛋白具有良好的易加工性[1]和氧气及水的渗透性,被广泛应用于组织工程细胞生长支架、临床诊断、外科修复、治疗等方面[2-3].丝素蛋白所具有的2种不同结晶结构(silk I和silk II),成为细胞和组织沿轴向生长的物质基础[4].但纯丝素一般溶失率很高,不经溶化处理(甲醇浸泡或湿热)的丝素蛋白,强度较大,伸长很小,玻璃转化温度(Tg)超过200℃,又硬又脆,很难在生物体内使用,所以必需经预处理后才可以作为细胞黏附的基质[5-6].
本研究采用不同的脱胶方法、包埋方式、缠绕方式对丝素进行预处理,制得改性丝素,通过细胞培养实验研究其生物学特性,期望能够对丝素蛋白材料进行改良,而且有利于细胞的生长和分化.
1 材料和方法
1.1 材料
1.1.1 细胞与蚕丝
细胞为293T细胞(人胚肾细胞);蚕丝为正常茧纺丝,购自辽宁太源纺织有限公司.
1.1.2 试剂与仪器
RPMI-1640培养液:上海克隆生物化学试剂(北京)有限公司;小牛血清:北京华利森泰生物科技有限公司;质量分数0.25%的胰蛋白酶、MTT:中国医学科学院血液学研究所科技公司;其他试剂,包括DMSO、聚乙二醇、明胶、壳聚糖等,均采用国产分析纯.
Nikon Ti倒置显微镜;Thermo Labsystems酶联免疫检测仪;Thermo Scientific Heraeus HERAcellCO2培养箱;SW-CJ-1F单人双面净化工作台,苏州净化设备有限公司生产.
1.2 实验方法
1.2.1 293T细胞的培养
质量分数为90%的RPMI-1640培养液中加入质量分数为10%的胎牛血清和0.1%的双抗(青霉素和硫酸庆大霉素),37℃培养.
1.2.2 蚕丝预处理
先将蚕丝置于沸水中20 min,除杂.
2种脱胶方法:酶脱胶法和NaHCO3脱胶法.将蚕丝分别放入质量分数为0.25%的胰蛋白酶溶液和质量分数为0.6%的NaHCO3溶液中(浴比同为1∶40),37℃恒温下消化12 h.
2种腐蚀方法:将等量丝素分别放入1.0 mol/L HCl、1.0 mol/L NaOH中常温保存1 h.
2种包埋方法:明胶包埋,将等量的丝素放入质量分数为7%的明胶水溶液中,常温保存1 h;壳聚糖/聚乙二醇包埋,称取0.6 g壳聚糖,少量醋酸溶解,除去杂质,氨水调节pH值至5,透析除去醋酸、醋酸胺等小分子.称取0.24 g聚乙二醇,加入20 mL双蒸水,溶解,倒入壳聚糖溶液中,搅拌均匀,超声振荡,除去气泡,滴加到丝素上.按上述方法制得的样品用双蒸水漂洗3次,然后37℃烘干,制得干性丝素薄膜片.用紫外线照射消毒30min,待用.
3种缠绕方法:脱胶丝素分别拧成1股、2股、3股螺旋状.
1.2.3 丝素-293T复合培养
将制备好的丝素支架置于6孔板内.取处于对数期的293T细胞悬液,调整细胞密度为2×104/mL,取1 mL滴于支架上.37℃培养4 h,待细胞充分吸附在支架上后,加入4 mL培养基培养,每天换液,培养7 d,每个实验2个平行.
1.2.4 MTT法检测细胞活力
将丝素-293T复合培养体取出,以培养基反复轻轻吹打支架,直至显微观察蚕丝上无附着细胞,计数.96孔板,每孔加细胞100 μL,培养24 h,吸去培养基,加MTT使其终质量浓度为0.5 mg/mL,培养4 h.每孔加入150 μL的DMSO,酶标仪上振荡混匀,测定OD570值.每孔3个平行.
1.2.5 培养条件正交实验设计
按L9(34)设计4因素、3水平实验进行选择,正交实验因素水平见表1.

表1 蚕丝预处理方法考察因素及水平Tab.1 Factors and levels on the study of pretreated silk fibroin
2 结果与讨论
2.1 293T细胞的生长形态
293T细胞是半贴壁半悬浮生长的肿瘤细胞,但在培养时贴附在支持物表面的生长情况要好于悬浮状态.细胞贴壁生长后形态发生变化,在游离态时,细胞为透明的圆球形;贴壁生长时变为不规则圆形或椭圆形、梭形、多角形,同时形成许多伪足状突起,相邻细胞伸出数个长突起向外延伸,如图1.
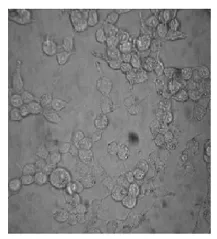
图1 293T细胞在培养瓶中的生长形态Fig.1 Growth state of 293T in cell culture flask
2.2 293T细胞在支架上的生长状态
图2 揭示出不同预处理方式对293T细胞与蚕丝的黏附有一定的影响,主要表现在是否脱胶与包埋方式上.已证明人们不期望的免疫反应是由丝胶蛋白引起的[7].由图2可以看出,在脱胶后裸露的丝素(4~9)上都有较多细胞黏附.采用HCl和NaOH腐蚀蚕丝的目的是用酸或碱腐蚀丝素表面,造成表面粗糙,表观看HCl和NaOH腐蚀与无腐蚀差别不大(2与3、5与6、8与9).就包埋方式而言,经明胶包埋的丝素上的293T细胞呈线、片平铺(4、9).图2也显示出壳聚糖/聚乙二醇处理的丝素上的293T细胞多数黏附在丝素纤维上,且聚集呈团簇状生长,并沿丝素纤维生长,生长旺盛(5).这是由于混合处理时聚乙二醇增加了丝素的亲水性,聚乙二醇分子中存在大量乙氧基,能够与水形成氢键,具有良好的亲水性,且亲水性的材料表面有利于细胞的黏附生长[8].聚乙二醇链在水中的高迁移率促进了293T细胞的黏附和生长,混合了壳聚糖后,纤维的韧性、弹性、细胞黏附性和增值能力均显著提高.何领好等[9]也证实壳聚糖/聚乙二醇共混膜随着聚乙二醇含量的增加,膜的玻璃化转变温度、结晶度和刚度降低.可见几种处理方法相比,以壳聚糖/聚乙二醇联合作用的细胞生长状态最佳.这与其他研究者关于壳聚糖/聚乙二醇对细胞的生物相容性结果相似[10-12].就缠绕方式而言,293T细胞黏附在1股丝素纤维表面上且生长的较密集,而在2股和3股丝素纤维上不仅生长在单根丝素上,而且还生长在2股或3股丝素纤维之间的夹缝中(4,6).
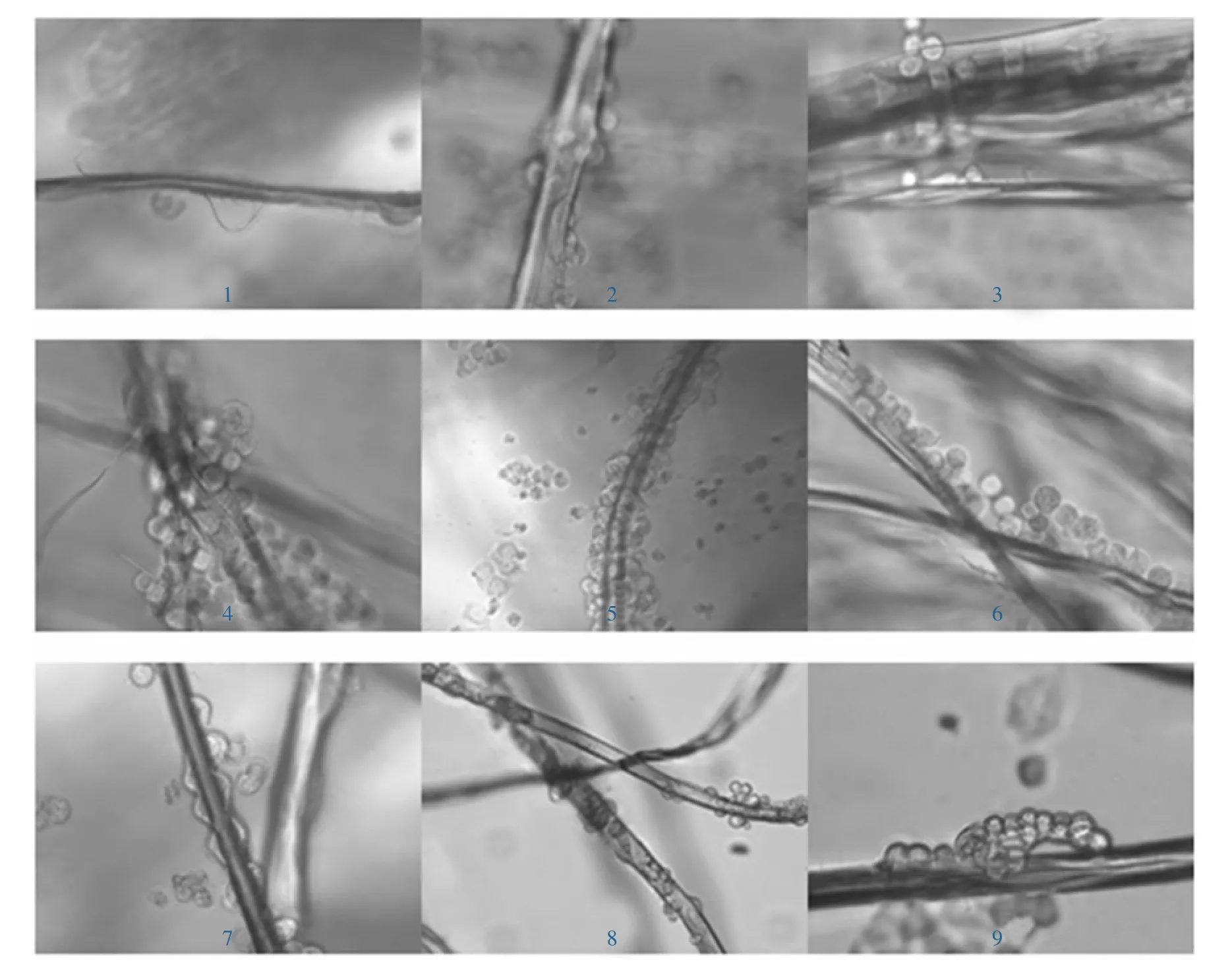
图2 9组实验的细胞在丝素上的生长状态Fig.2 Growth state of 9 groups′experiments cells on silk fibroin
上述结果为培养3 d,实验4~6发现,处理时间越长293T细胞与丝素结合得越紧密,不受外力干扰,操作时洗脱越难.培养7 d的细胞团紧密结合成不规则团块状,密布于丝素表面,但培养基澄清透明.而实验1~3培养7 d时若不及时换液,板底见大片泛白死细胞,轻摇就有细胞浮起.
以上实验结果说明:细胞与支架间黏附作用受材料表面性质、细胞与材料接触时间、材料的柔韧性等多种因素影响,材料本身的生物相容性也决定了细胞在材料表面的形态学特点及增殖、分化的能力.
2.3 丝素预处理方式对细胞数和活力的影响
以不同的脱胶方法、包埋方式、缠绕方式对蚕丝进行预处理的正交实验及数据结果如表2,直观分析和方差分析见表3和表4.
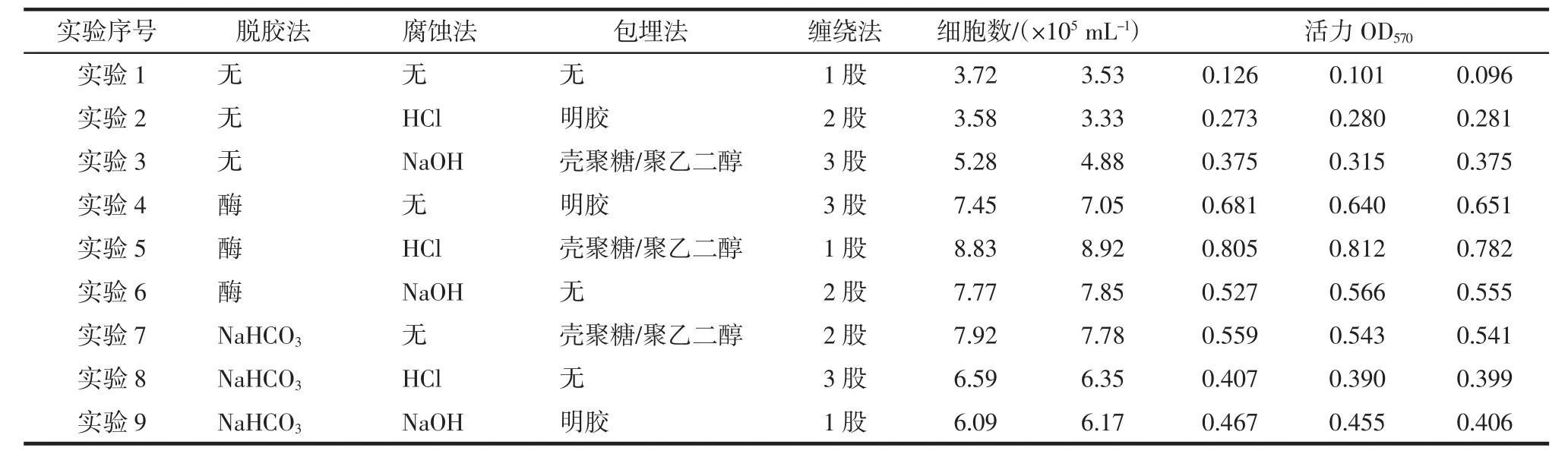
表2 预处理对丝素促进293T细胞生长的正交实验及结果Tab.2 Orthogonal design and results of pretreated silk fibroin to promote the growth of 293T
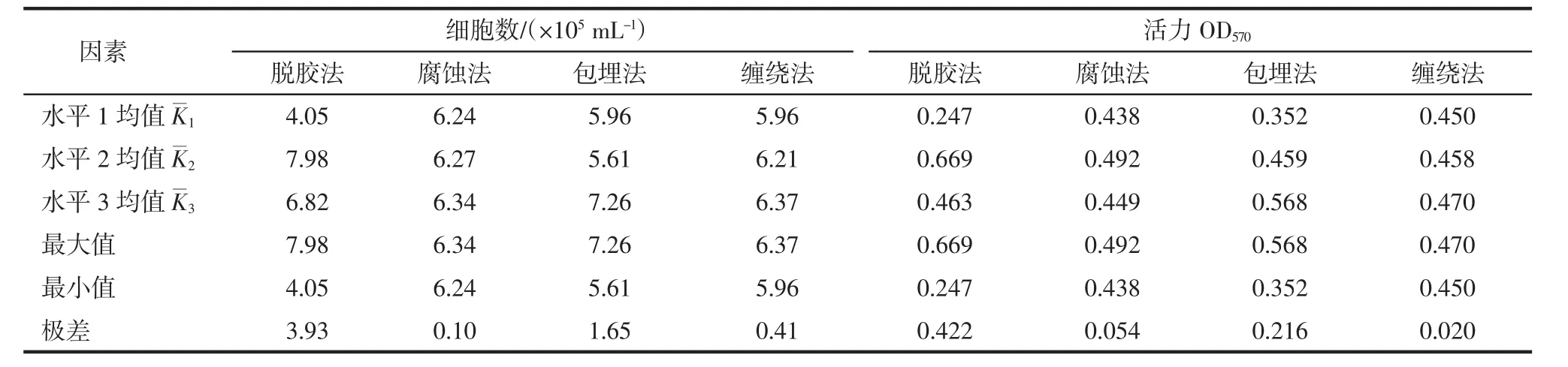
表3 正交实验结果的直接分析Tab.3 Direct analysis on the orthogonal design results
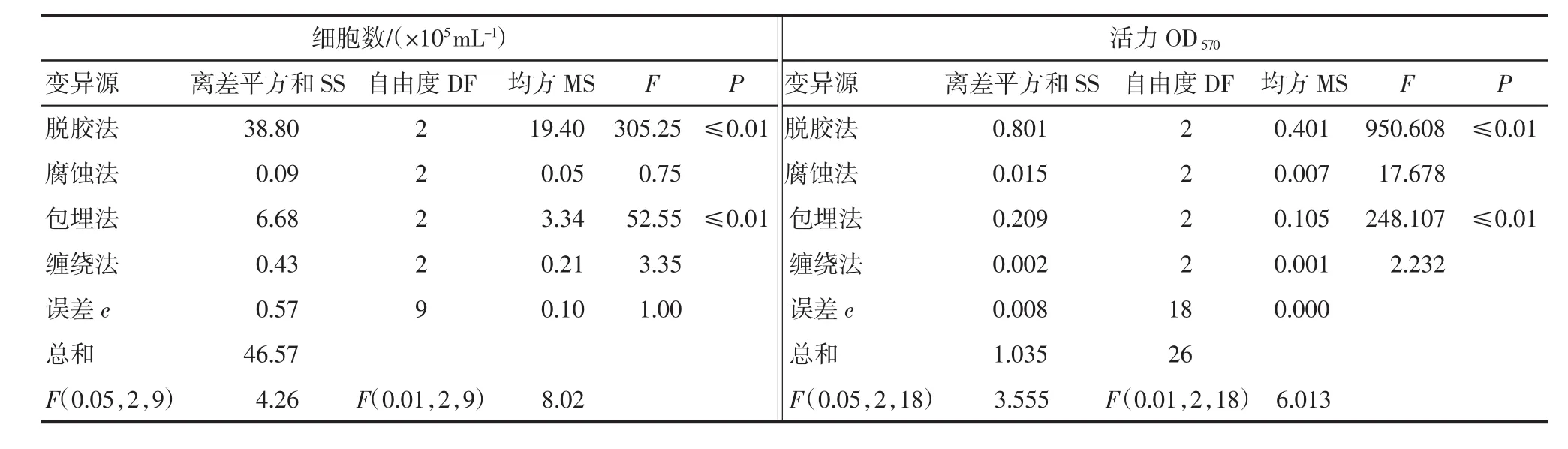
表4 正交实验结果的方差分析Tab.4 Analysis of variance of orthogonal test
根据表3对4因素的极差(R)进行比较,可见脱胶方法的极差最大,其次是包埋法,腐蚀法与缠绕法之间的差异并不大.极差越大,在该因素的水平变动时293T细胞的细胞数与活力变化就越大,也就是该因素对293T细胞生长状态的影响越大.因此,按照极差大小顺序排列,可知脱胶方法是影响293T细胞在丝素支架上生长的主要因素.K1、K2、K3之间的差异是因为同一因素取3个不同的水平所引起的,K值大表明某一因素在该水平下处理效果最好.根据水平之间K值大小比较得知,若要获得高的生物量其最佳组合为胰蛋白酶脱胶、NaOH腐蚀、壳聚糖/聚乙二醇包埋、2股缠绕;若要获得高的细胞活性其最佳组合为胰蛋白酶脱胶、HCl腐蚀、壳聚糖/聚乙二醇包埋、3股缠绕.根据表4可知,脱胶方法与包埋法对结果的影响最明显,具有统计学意义(P≤0.01).
不管哪种方式处理后的丝素支架对293T细胞的吸附效果均强于未脱胶蚕丝,且便于取放和易于保持构型.本研究中对蚕丝预处理后作为293T细胞生长的支架,获得了高生物量与高活性的293T细胞.丝素支架经培养后293T细胞生物量由2×104/mL最大增加到7×105/mL左右,增长量为35倍,明显高于陆旋等[13]以常规静电纺丝法得到的增长量;并高于叶荣等[14]的小鼠胚胎细胞ES在丝素蛋白膜或明胶上生长后的MTT活性测定结果.由表3的结果可知,腐蚀法与缠绕法之间的差异并不大,据此认为对丝素进行的腐蚀步骤可以省略.至于缠绕方式在组织工程中的应用,2股和3股丝素纤维的机械强度要好于1股丝素纤维,具有较高的抗拉伸力学性能.鉴于目前所制备的丝素支架都是丝素纤维排列紧密、网孔小的网状结构[15]或成膜结构[16-17],而丝素可以制成海绵状、膜状、纤维状和网状等,因此制备细胞培养支架时,根据具体的情况也可以选择使用多股丝素.
3 结论
3.1 293T细胞在丝素上的生长
293T细胞在处理过的丝素上经过3 d培养后,在材料表面普遍都能很好地生长,细胞突起明显,贴附良好,多数细胞突起减少,胞体变圆.经过7 d培养后,细胞呈球状体、锥形体,有的还会形成伪足突起向外延伸,大量附着在丝素纤维上呈集落性生长.在丝素纤维上生长的293T细胞与在培养瓶中培养的细胞相比表现出更加立体的形态.
3.2 不同预处理方式对293T细胞数、细胞活力的影响
正交实验分析表明:脱胶方法对293T细胞数和细胞活力的影响最大;其次是包埋法;腐蚀法与缠绕法之间的差异并不大.若要获得高的生物量,最佳组合为胰蛋白酶脱胶、NaOH腐蚀、壳聚糖/聚乙二醇包埋、2股缠绕;若要获得高的细胞活性,最佳组合为胰蛋白酶脱胶、HCl腐蚀、壳聚糖/聚乙二醇包埋、3股缠绕.脱胶方法与包埋法对结果的影响最显著,差异具有统计学意义(P≤0.01).
实验结果会因操作过程而产生一定的误差,是由于丝素支架接种细胞后,在换液和补加培养液时不可避免地会冲击细胞-丝素支架复合物,这时未牢固吸附于支架的细胞会脱落,并且细胞浓度降低也会造成细胞吸附的机会减少.但这种影响对研究细胞在蚕丝支架上生长情况的总体趋势并无太大影响.脱胶后丝素纤维与293T细胞具有良好的生物相容性,并且有利于293T细胞的存活,同时对其表型或功能没有任何大的毒害作用,说明丝素表面经处理后有利于细胞的黏附和增殖.
[1]ZHANG X,BAUGHMAN C B,KAPLAN D L.In vitro evaluation of electrospun silk fibroin scaffolds for vascular cell growth[J].Biomaterials,2008,29(14):2217—2227.
[2]孙芳,谢军军,熊杰,等.纳米/亚微米再生丝素蛋白纤维制备的影响因素[J].浙江理工大学学报,2009,26(1):1—6.
[3]EUN S G,DAVID J F,SAMUEL M H,et a1.Silk fibroin membranes from solvent-crystallized silk fibroin/gelatin blends:Effects of blend and solvent composition[J].Materials Science and Engineering:C,2007,27(3):426—431.
[4]LIN H B,SUN W,MOSHER D F,et a1.Synthesis,surface,and cell adhesion properties of polyurethanes containing covalently grafted RGD peptides[J].J Biomed Mater Research,1994,28(3):329—342.
[5]LYENGAR D R,PERUTZ S M,DAIC A,et a1.Surface segregation studies of fluorine-containing diblock copolymers[J].Macromolecules,1996,29(4):1229—1234.
[6]卢神州,李明忠,高鸭坤,等.应力对丝素膜结构与性能的影响[J].苏州大学学报:工科版,2004,24(1):1—4.
[7]YANG Y M,CHEN X M,DING F,et a1.Biocompatibility evaluation of silk fibroin with peripheral nerve tissues and cells in vitro[J].Biomaterials,2007(28):1643—1652.
[8]KUO S M,TSAI S W,HUANG L H,et al.Plasma-modified nylon meshes as supports for cell culturing[J].Artif Cells Blood Substit Immobile Biotechnology,1997,25(6):551—562.
[9]何领好,杨德彬,刘莹,等.壳聚糖/聚乙二醇共混膜性能研究[J].郑州轻工业学院学报:自然科学版,2007,22(4):35—37,40.
[10]张宇,周初松,蒋刚彪,等.壳聚糖/聚乙二醇琥珀酸酯薄膜的制备及其与肌成纤维细胞的相容性[J].中国组织工程研究与临床康复,2007,11(18):3527—3531.
[11]ZHANG M,LI X H,GONG Y D,et a1.Properties and biocompatibility of chitosarf films modified by blending with PEG[J].Biomaterials,2002,23(13):2641—2648
[12]ZENG M F,FANG Z P,XU C W.Effect of compatibility on the structure of the microporous membrane prepared by selective dissolution of chitosan/synthetic polymer blend membrane[J].J Membrane Sci,2004,230:175—181.
[13]陆旋,朱正华,周晓红.促细胞生长再生复合丝素蛋白电纺丝非织布的性能[J].蚕业科学,2010,36(1):97—101.
[14]叶荣,盛利琴,陈学进,等.小鼠胚胎干细胞与复合丝素膜的生物相容性研究[J].中国生物医学工程学报,2009,28(4):567—572.
[15]吴海涛,钟翠平,顾云娣.蚕丝在软骨细胞立体培养中的应用[J].中国修复重建外科杂志,2000,14(5):101—104.
[16]WANG Y,KIM H J,VUNJAK-NOVAKOVLC G,et a1.Stem cellbased tissue engineering with silk biomaterials[J].Biomaterials,2006,27(36):6064—6082.
[17]ALTMAN G H,DIAZ F,JAKUBA C,et a1.Silk-based biomaterials[J].Biomaterials,2003,24(3):401—416.
