抗白粉病小麦近等基因系DNA甲基化的MSAP分析
2013-08-06孙中洁王振英潘丽娜
孙中洁,王振英,潘丽娜
(天津师范大学a.生命科学学院,b.天津市动植物抗性重点实验室天津300387)
小麦白粉病是由禾布氏白粉菌(Blumeria graminis(DC).Speer f.sp.tritici)引起的一种世界性病害,它直接影响小麦的高产、稳产,是小麦的主要病害之一[1].目前防治小麦白粉病的工作主要集中在两方面,即新抗病基因的发掘和新型抗病品系的选育[2-4],而对白粉菌胁迫应答的生理机制研究较少,表观遗传修饰尤其是DNA甲基化在白粉病抗性应答中的作用研究更是缺乏.
表观遗传是指在DNA序列不变的情况下,可遗传的基因表达的改变[5-6].可逆的表观遗传修饰能有效避免不必要的基因重组,在调控基因表达的同时维持基因组的稳定性,对于植物的生长、发育、器官分化及其对环境胁迫的适应性具有关键作用[7-9].其中,DNA甲基化是一种最保守的表观遗传修饰,指在DNA甲基转移酶(Dnmt)的作用下,以S-腺苷甲硫氨酸(SAM)为甲基供体,将甲基基团转移到胞嘧啶和鸟嘌呤(CpG)二核苷酸中胞嘧啶的5位碳原子上[5,10].脊椎动物中约有3%~8%基因组DNA的胞嘧啶处于甲基化状态,而在高等植物中约有5%~30%的胞嘧啶是甲基化的[11].DNA甲基化可形成一种封闭的染色质结构,抑制基因转录.对拟南芥全基因组甲基化图谱的分析表明,DNA甲基化在转座子和基因编码区的分布不同,转座子及异染色质区域的基因处于高甲基化状态,约1/3基因的编码区是甲基化的,但它们的启动子区很少发生甲基化修饰[12-14].
本课题组以抗白粉病代换系6A/6V及其与京411的近等基因系(NILs)为实验材料,通过甲基化特异性片段长度的多态性(MSAP)分析其DNA甲基化模式的变化情况,为进一步阐明表观遗传尤其是DNA甲基化修饰在小麦白粉菌胁迫应答中的作用奠定基础.
1 材料与方法
1.1 实验材料与试剂
感病品系京411由中国农业大学杨作民教授惠赠;抗白粉病代换系6A/6V由南京农业大学提供;抗病近等基因系NILs是以京411为母本,与6A/6V杂交得F1代,在F1代中选取抗白粉病植株,再以京411为父本,回交7代,再自交1代后获得.
H/M-adapter I接头、H/M-adapter II接头、EcoRI-adapter I接头、EcoRI-adapter II接头、H/M+0引物、EcoRI+A引物、8个H/M+3引物及9个E+3引物均在上海生工生物工程有限公司合成;限制性内切酶HpaⅡ、MspⅠ及EcoR I购自NEB公司;DNA聚合酶、T4连接酶购自宝生物工程(大连)有限公司.
1.2 方法
1.2.1 基因组DNA的提取
取同一生长时期的0.1~0.2 g小麦叶片,采用CTAB法提取基因组DNA,利用Nanodrop微量紫外分光光度计(Nanodrop科技有限责任公司)和琼脂糖凝胶电泳检测DNA提取的浓度及质量.
1.2.2 甲基化敏感限制性内切酶酶切与连接
分别采用EcoR I/Hpa II和EcoR I/Msp I酶切基因组DNA,酶切体系如下:EcoR I 5 U,Hpa II(Msp I)5 U,10×Buffer 2.5 μL,基因组 DNA 500 ng,加水至25 μL.上述溶液混匀,37℃水浴酶切2 h后,80℃温浴20 min,使内切酶失活.
接头引物各3 μL,经95℃、5 min变性后,温度递降至室温.按如下体系进行连接:10×T4连接酶Buffer 2 μL,T4连接酶 0.1 μL,E 接头(5 μmol/L)1 μL,H(或 M)接头(50 μmol/L)1 μL,酶切产物5 μL,加水至20 μL.20℃水浴连接过夜,然后65℃温浴20 min,使连接酶失活.
1.2.3 预扩增
反应体系如下:Taq DNA聚合酶(5 U/μL)0.1 μL,dNTP(10 mmol/L)0.4 μL,10×Buffer 2 μL,连接产物 2 μL,E0 引物(50 ng/μL)0.6 μL,M0/H0引物(50 ng/μL)0.6 μL,加水至 20 μL.将上述溶液混匀,采用以下反应程序进行预扩增:94℃预变性2 min,94℃变性30 s,56℃退火1 min,72℃延伸1 min,30个循环后,72℃延伸10 min.利用质量分数为2%的琼脂糖凝胶电泳检测,选取200~1 000 bp呈弥散状分布的产物,根据电泳亮度稀释后进行选择性扩增.
1.2.4 选择性扩增
反应体系如下:Taq DNA聚合酶(5 U/μL)0.1 μL,10 × buffer 2.5 μL,dNTPs(10 mmol/L)0.5 μL,预扩增稀释样品 2 μL,上游引物 1 μL,下游引物1 μL,加水至25 μL.混合上述溶液,采用如下体系进行选择性扩增:94℃预变性2 min,94℃变性30 s,65℃每个循环递降0.7℃,退火30 s,72℃延伸1 min,13个循环,随后56℃退火30 s,72℃延伸1 min,23个循环后,72℃延伸10 min.扩增后,样品中加入7 μL loading buffer(质量分数为98%的去离子甲酰胺;10 mmol/L EDTA,pH8.0;质量分数为0.25%的溴酚蓝;质量分数为0.25%的二甲苯青).95℃变性5 min,立即置于冰水混合物中准备进行聚丙烯酰胺凝胶电泳.
1.2.5 聚丙烯酰胺电泳及银染显带
采用质量分数为6%的聚丙烯酰胺凝胶,以1×TBE为电泳缓冲液,恒功率65 W,预电泳约30 min,加选择性扩增样品7 μL,待电泳至第1条指示带到达胶板的另一前沿停止,电泳90~120 min分离选择性扩增产物.
电泳后将凝胶放入1 L质量分数为10%的冰乙酸溶液中,轻摇至指示剂无色,约25 min,再用1 L水洗胶板2次,每次5 min.水洗后把胶板放入银染液(1 g AgNO3,1.5 mL质量分数为37%的甲醛,1 L水),轻摇约30 min.用蒸馏水快速水洗胶板5 s后放入1 L预冷的显影液中(30 g无水碳酸钠,1.5 mL质量分数为37%的甲醛,200 μL 10 mg/mL的硫代硫酸钠)中迅速摇动,直至条带出现.最后,用1 L质量分数为10%的冰乙酸溶液终止反应,约5 min后水洗,室温下干燥.
2 结果与分析
2.1 抗病NILs及其亲本京411、抗病亲本6A/6V甲基化水平的变化
为研究DNA甲基化在小麦白粉病抗性应答中的作用,课题组采用MSAP法分析抗病NILs及其感病亲本京411、抗病亲本6A/6V甲基化水平的变化.MSAP方法是参照经典的分子标记——扩增长度多态性法(AFLP)演变而来,因此,其基本原理与AFLP大致相同.不同的是,AFLP法是将基因组DNA用2种限制性内切酶消化,而MSAP法是用一对对甲基化敏感的同裂酶HpaⅡ和MspⅠ代替AFLP法中的一个限制性内切酶对基因组DNA进行消化,之后产生各种长度不一的具有黏性末端的酶切片段,接上人工接头之后,作为PCR扩增模板,利用设计好的不同引物对其进行扩增,得到扩增产物之后进行聚丙烯酰胺凝胶电泳,从而产生扩增片段长度不同的电泳图谱.这对同裂酶HpaⅡ和MspⅠ识别相同的四核苷酸位点5′-CCGG-3′序列,但是对此位点不同甲基化模式的敏感程度不同.HpaⅡ可以切割DNA单链上此位点的外侧或内侧任意一种甲基化模式,却不可切割DNA双链上此位点的外侧或内侧甲基化模式;而MspⅠ可以切割此序列内侧胞嘧啶甲基化模式,无论此DNA是单链还是双链,且不管此序列外侧是否甲基化,只要存在内侧胞嘧啶甲基化,MspⅠ均可将其切割成大小不一的片段[15].
因此,基于这一原理,用MSAP方法分析某DNA序列,经这对同裂酶酶切之后可以产生4种情况(实验中如果出现条带记为“+”,如果没有出现条带记为“-”):①如果通过HpaⅡ/EcoRⅠ和MspⅠ/EcoRⅠ酶切之后均产生条带,即(++型),表明该序列的5′-CCGG-3′位点未发生甲基化;②如果通过HpaⅡ/EcoRⅠ和MspⅠ/EcoRⅠ酶切之后均未产生条带,即(--型),表明双链DNA的5′-CCGG-3′位点发生外部甲基化;③如果通过HpaⅡ/EcoRⅠ酶切产生条带,而MspⅠ/EcoRⅠ酶切后没有产生条带,即(+-型),表明该序列发生了单链外侧5′-CCGG-3′位点胞嘧啶的甲基化,即半甲基化;④如果通过HpaⅡ/EcoRⅠ酶切未产生条带,而MspⅠ/EcoRⅠ酶切后产生条带,即(-+型),表明该序列发生了双链内侧5′-CCGG-3′位点胞嘧啶的甲基化,即全甲基化.
如图1所示,本实验利用72对引物组合在NILs、京411与6A/6V基因组DNA HpaⅡ/EcoRⅠ和MspⅠ/EcoRⅠ酶切产物中进行选择性扩增共得到4 601条带,其中NILs、京411与6A/6V中扩增得到条带数分别为4 529条、4 482条和4 518条,3品系共有条带4 411条,NILs与京411共有条带63条,NILs与6A/6V共有条带40条.
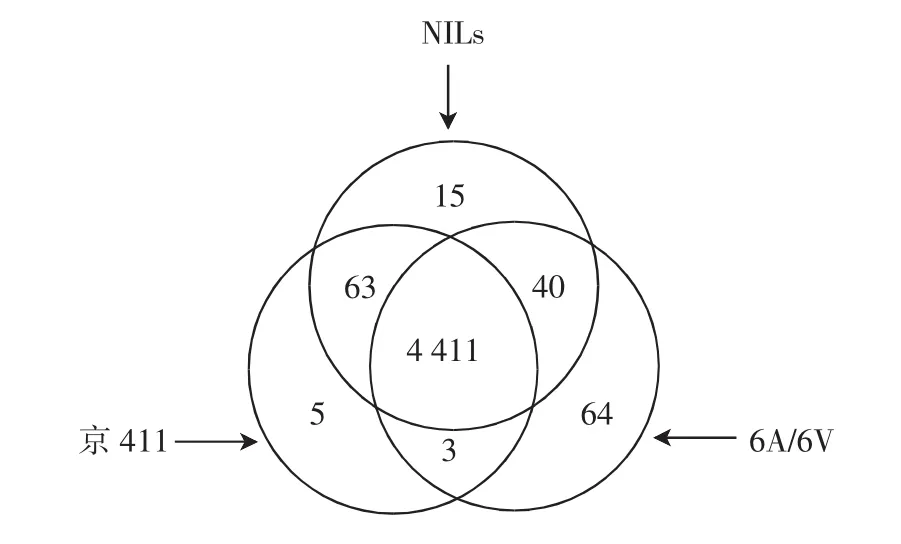
图1 近等基因系NILs和亲本京411、6A/6V中MSAP扩增条带数Fig.1 Amount of bands amplified by MSAP in NILs and its parents Jing 411,6A/6V
进一步分析其整体甲基化水平发现,抗病近等基因系NILs整体甲基化水平(22.9%)略低于其感病轮回亲本京411(23.4%),高于其父本6A/6V(21.2%),如表1所示,说明NILs的整体基因表达水平可能高于京411,低于其抗病亲本6A/6V.为排除基因重组对甲基化条带的影响,对3品系共有的4 411条带进行整体甲基化水平分析,发现NILs的甲基化水平(21.1%)仍略低于京411(22.6%),而高于6A/6V(19.8%),如表2所示,说明抗白粉病品系的整体DNA甲基化水平低于感病品系,即相对高水平的基因表达参与了白粉病的抗性应答.
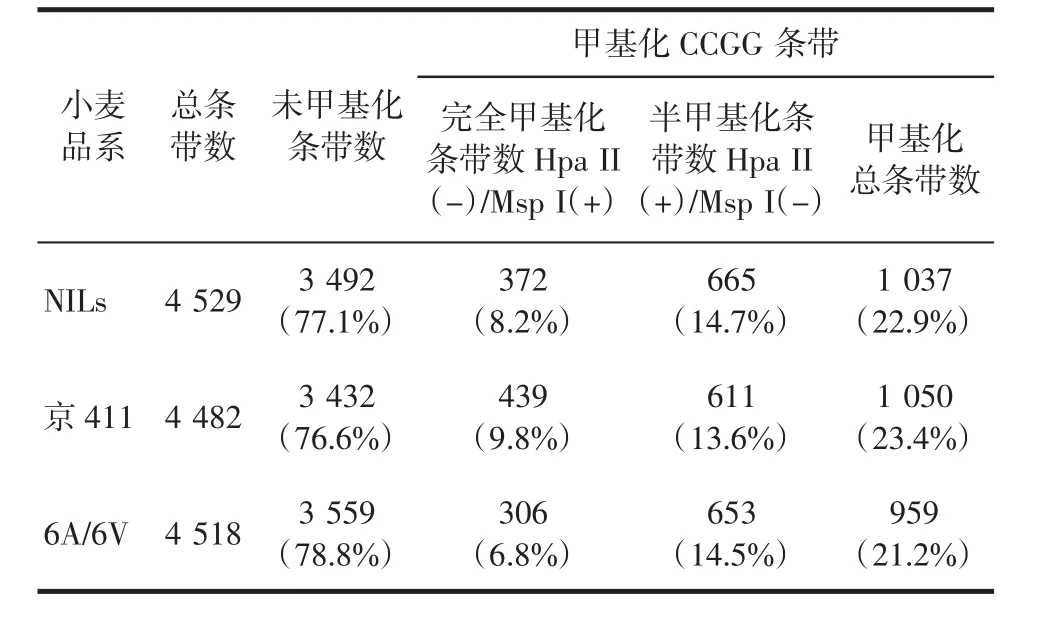
表1 近等基因系NILs和亲本京411,6A/6V中MSAP扩增的条带及甲基化率统计Tab.1 Amount of bands amplified by MSAP and the methylation rate among NILs and its parents Jing411,6A/6V
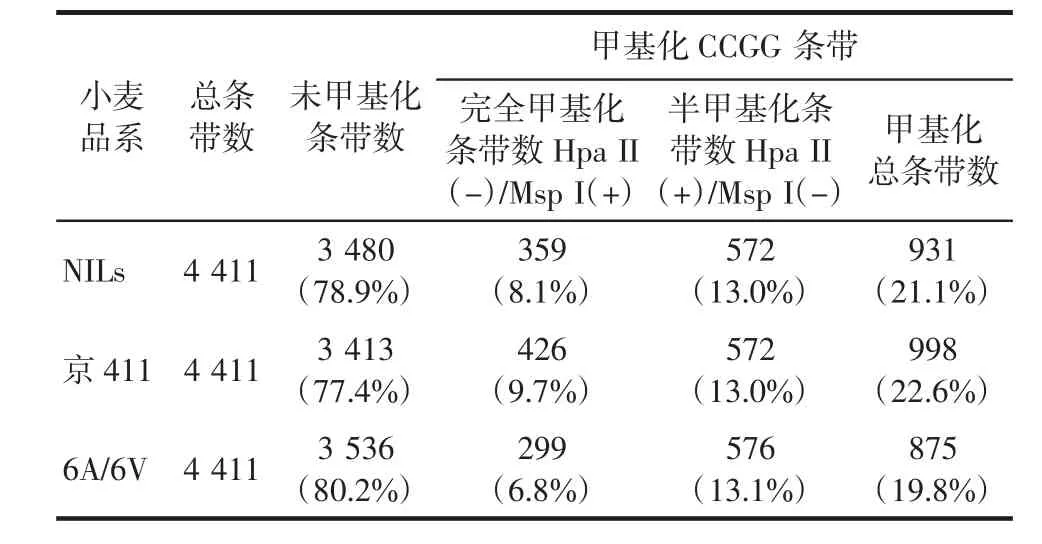
表2 近等基因系NILs和亲本京411,6A/6V中MSAP扩增的共有条带及甲基化率统计Tab.2 Shared amount of bands amplified by MSAP and the methylation rate among NILs and its parents Jing411,6A/6V
2.2 抗病NILs及其亲本京411甲基化模式的变化
MSAP分析既可在整体上估测全基因组的甲基化水平,也可用于特定位点不同品系基因组的甲基化模式.如图2所示,相对亲本京411,NILs大量位点的甲基化模式发生变异,超甲基化和去甲基化均有发生.根据HpaⅡ/EcoRⅠ和MspⅠ/EcoRⅠ酶切后扩增泳带的差异,可将MSAP扩增位点分为A、B、C、D 4大类、12个亚类,如表3和图2.其中A类NILs与京411的甲基化模式完全相同,即NILs相对京411无甲基化模式的变化.A类又可分3个亚类:A1代表HpaⅡ/EcoRⅠ和MspⅠ/EcoRⅠ酶切后均有条带;A2为HpaⅡ/EcoRⅠ酶切有条带,而MspⅠ/EcoRⅠ酶切后无条带扩增;A3亚类与A2相反,HpaⅡ/EcoRⅠ酶切无条带扩增,而MspⅠ/EcoRⅠ酶切后有条带扩增.B类NILs相对京411的甲基化水平降低,如B1、B2亚类,NILs基因组经HpaⅡ/EcoRⅠ酶切后有条带扩增,而京411无条带,说明该位点京411的DNA序列发生了外侧的完全甲基化修饰;B3亚类中,NILs基因组经MspⅠ/EcoRⅠ酶切后有条带扩增,而京411无条带,说明该位点京411的DNA序列发生了内侧的甲基化修饰;B4亚类中,NILs经2种酶切方式均有条带,而京411无条带,说明该位点发生了甲基化修饰,或者是基因重组位点.C类为NILs相对京411甲基化水平提高的位点,根据酶切扩增条带不同可细分为4个亚类:C1、C4为京411基因组经MspⅠ/EcoRⅠ酶切后有条带扩增,而NILs无条带;C2、C3亚类为京411基因组经HpaⅡ/EcoRⅠ酶切后有条带扩增,NILs无条带.D类为甲基化模式互换条带,NILs经HpaⅡ/EcoRⅠ酶切后有条带扩增,而京411基因组经MspⅠ/EcoRⅠ酶切后有条带扩增,无法判断其甲基化模式提高还是降低.如表3所示,A类条带占绝大多数(96.54%),说明NILs相对京411具有极其相似的遗传背景,基因表达差异不大;B类条带比例(2.89%)明显高于C类(0.55%),即NILs的甲基化水平明显低于京411,通常高甲基化抑制基因表达,说明NILs的整体基因表达水平高于京411.
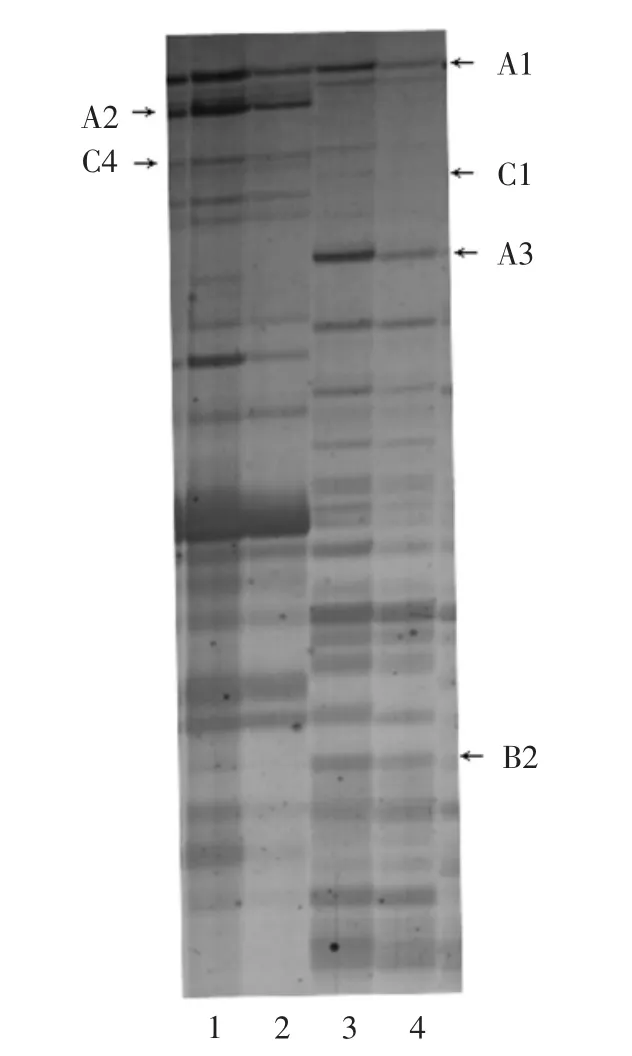
图2 部分MSAP扩增结果Fig.2 Part of MSAP result
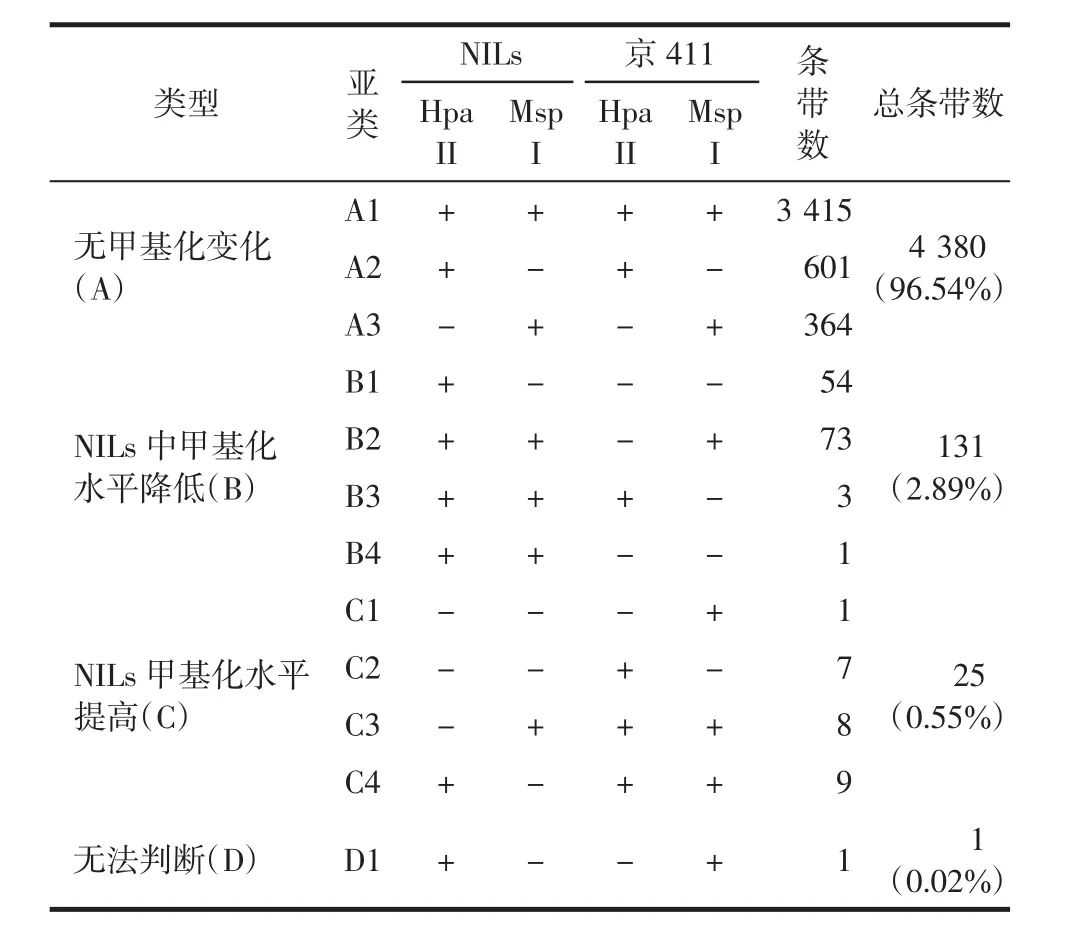
表3 近等基因系NILs与亲本京411的甲基化模式Tab.3 Model of methylation between NILs and its parent Jing411
2.3 抗病NILs及其亲本6A/6V的甲基化模式的变化
根据HpaⅡ/EcoRⅠ和MspⅠ/EcoRⅠ酶切后扩增泳带的差异,也可将NILs相对亲本6A/6V的MSAP扩增位点分为A、B、C、D 4大类、15个亚类,如表4所示.A类占92.52%,是NILs相对亲本6A/6V甲基化模式不变的条带;B类为NILs相对亲本6A/6V甲基化水平降低的条带;C类为NILs相对亲本6A/6V甲基化水平提高的条带;D类为NILs相对亲本6A/6V发生了甲基化模式互换的条带.如表4所示,C类(4.20%)条带明显高于B类(2.96%),说明NILs相对亲本6A/6V甲基化水平明显提高.
综上,抗病NILs相对感病亲本京411的甲基化水平有所降低,而相对抗病亲本6A/6V甲基化水平明显提高,说明NILs的整体基因表达水平高于京411,低于抗病亲本6A/6V,即DNA甲基化水平低.基因表达相对高的品系NILs和6A/6V对白粉病有较强抗性,而整体基因表达相对低的品系京411对白粉病敏感,由此推测,DNA甲基化可能参与小麦白粉病的抗性应答.
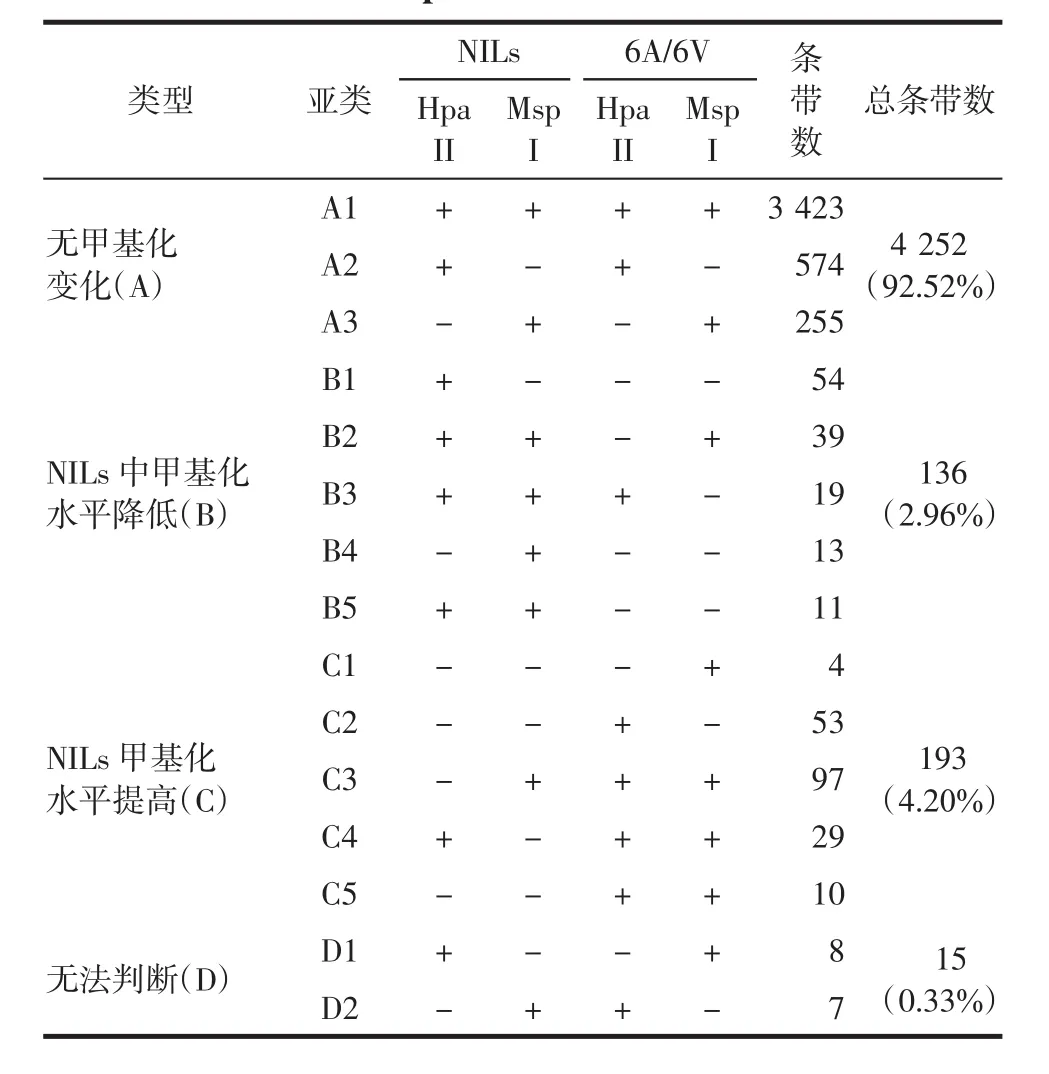
表4 近等基因系NILs与亲本6A/6V的甲基化模式Tab.4 Model of methylation between NILs and its parent 6A/6V
3 讨论
植物在生长发育过程中,受到环境因子的多种胁迫刺激,如不适的温度、压力、水肥条件等物理性刺激,以及病虫害等生物胁迫.为了生存与繁衍,生物体必须发展自身的耐受和适应性能,进而推动物种的进化[16-17].胁迫诱导下,植物体需要发生多种代谢反应变化以应对和适应胁迫,其中一种典型的反应就是基因组变异,但通常基因突变、重排是不可逆的,会导致物种的不稳定性.而表观遗传修饰的改变,可在基因序列不变的情况下,引起基因表达的变化[5,18],并随细胞分裂遗传给子代,如此既赋予生物体耐受胁迫的能力,又不会造成基因的突变、重组,维持了物种的稳定[3-5].小麦白粉病是一种真菌性病害,属于典型的生物胁迫,但目前对表观遗传如DNA甲基化修饰在小麦白粉病胁迫应答中的作用研究较少.
本实验应用MSAP法分析比较抗病近等基因系NILs与其抗病父本6A/6V、感病轮回亲本京411的甲基化差异.由于近等基因系在制备过程中经历了与感病亲本京411的多次回交,NILs的遗传背景与京411极其相似,而且抗病父本代换系6A/6V的V染色体(来自簇毛麦)是独立遗传[19-20],因此,可认为NILs的基因组DNA除了6V染色体与代换系6A/6V相同,其他染色体与京411相同.NILs与京411对白粉病的抗性不同可能源于6V染色体上的基因,也可能在6V染色体渗入过程中引起整体基因表达的改变.相对于京411,NILs发生DNA甲基化水平降低的条带明显高于甲基化水平提高的条带,且仅B4亚类是NILs独有的扩增条带,可能来自6V染色体,是抗病基因.B1~B3亚类在NILs与京411中均有条带扩增,只是相对来讲,NILs扩增的条带更多,说明外源染色体6V的渗入引起NILs整体基因组DNA甲基化水平降低,其原因可能是6V染色体上.外源抗病基因诱导下游白粉病胁迫应答通路相关基因的DNA甲基化水平降低,基因表达提高,从而对小麦白粉菌侵染产生抗性.
综上所述,NILs与其亲本京411对白粉病抗性不同很可能与它们DNA甲基化水平的差异有关,即表观遗传尤其是DNA甲基化参与了小麦白粉菌的胁迫应答.
[1]LIU J,TAO W,DUAN X,et al.Molecular marker assisted identification of Pm genes involved in the powdery mildew resistant wheat cultivars[J].Acta Phytopathol Sin,2000,30(2):133—139.
[2]LIU J,LIU D.Progress of the study on wheat powdery mildew resistant genes[J].Acta Phytopathol Sin,2000,30(4):289—295.
[3]YU L,NIU J,MA Z,et al.Cloning,characterization and chromosome localization of two powdery mildew resistance-related gene sequences from wheat[J].Acta Bot Sin,2002,44(12):1438—1444.
[4]YAHIAOZU N,SRICHUMPA P,DUDLER R,et al.Genome analysis at different ploidy level allows cloning of the powdery mildew resistance gene Pm3b from hexaploid wheat[J].Plant J,2004,37(4):528—538.
[5]BIRD A.Perceptions of epigenetics[J].Nature,2007,447(7143):396—398.
[6]FAZZARIMJ,GREALLYJM.Epigenomics:BeyondCpGislands[J].Nat Rev Genet,2004,5(6):446—455.
[7]BENDERJ.Plantepigenetics[J].CurrBiol,2002,12(12):412—414.
[8]PARISOD C,SALMON A,ZERJAL T,et al.Rapid structural and epigenetic reorganization near transposable elements in hybrid and allopolyploid genomes in Spartina[J].New Phytol,2009,184(4):1003—1015.
[9]RAPP R A,WENDEL J F.Epigenetics and plant evolution[J].New Phytol,2005,168(1):81—91.
[10]SANTIDV,GARRETTCE,BARRPJ.Onthemechanismofinhibition of DNA-cytosine methyltrans-ferases by cytosine analogs[J].Cell,1983,33(1):9—10.
[11]CHEN T,LI E.Structure and function of eukaryotic DNA methyltransferases[J].Curr Top Dev Biol,2004,60:85—89.
[12]ZILBERMAN D,GEHRING M,TRAN R K,et al.Genomewide analysis of Arabidopsis DNA methylation uncovers an interdependence between methylation and transcription[J].Nat Genet,2007,39(1):61—69.
[13]ZHANG X,YAZAKI J,SUNDARESAN A,et al.Genomewide high-resolution mapping and functional analysis of DNA methylation in Arabidopsis[J].Cell,2006,126(6):1189—1201.
[14]GEHRING M,HENIKOFF S.DNA methylation dynamics in plant genomes[J].Biochimicaet Biophysica Acta-Gene Structure and Expression,2007,1769(5/6):276—286.
[15]MCCLELLAND M,NELSON M,RASCHKE E.Effect of site-specific modification on restriction endonucleases and DNA modificationmethyltransferases[J].NucleicAcidsRes,1994,22(17):3640—3659.
[16]ARNHOLDT-SCHMITT B.Stress-induced cell reprogramming:A role for global genome regulation[J].Plant Physiol,2004,136(1):2579—2586.
[17]DOROSZUK A,WOJEWODZIC M,KAMMENGA J.Rapid adaptive divergence of life-history traits in response to abiotic stress within a natural population of a parthenogenetic nematode[J].Proc Biol Sci,2006,273(1601):2611—2618.
[18]CHINNUSAMY V,ZHU J.Epigenetic regulation of stress responses in plants[J].Curr Opin Plant Biol,2009,12(2):133—139.
[19]段爽,王炼,甘富,等.具簇毛麦6VS的小麦抗白粉病近等基因系的培育与蛋白质组检测[J].中国细胞生物学学报,2012,34(6):580—589.
[20]CHEN P,QI L,ZHOU B,et al.Development and molecular cytogenetic analysis of wheat-Haynaldia villosa 6VS/6AI.translocation lines specifying resistance to powdery mildew[J].Theor Appl Genet,1995,91(6/7):1125—1128.
