镉胁迫下萝卜根系蛋白质组的差异表达
2013-08-06章爱秀刘晓颖边立娜彭永康
章爱秀,刘晓颖,边立娜,彭永康
(天津师范大学a.生命科学学院,b.天津市动植物抗性重点实验室,天津300387)
土壤中的Cd2+可以抑制植物正常的光合作用,使卡尔文循环和光合作用电子传递系统受阻[1]、光系统Ⅱ(PSⅡ)中许多蛋白质被抑制表达或失去活性[2],引起植物产生亚致死损伤[3].不同于其他的重金属,Cd2+可以通过农产品进入人类的食物链,导致人体的骨骼疼痛、肾脏损害甚至诱发肿瘤[4].因此,研究Cd2+对农作物生长的影响及农作物的耐Cd2+机制,对减少农作物产量损失、防止Cd2+污染农产品、减少人类因食用含Cd2+农产品而导致的疾病具有重要意义.目前对于植物在高Cd2+浓度下忍耐和适应Cd2+危害机理的研究已取得了一些进展,如Hart等[5]研究了在不同浓度的Cd2+条件下,硬粒小麦结合、吸收和转运Cd2+的调控机制;Shah等[6]以水稻为材料,研究了水稻植株不同器官对Cd2+吸收和积累的情况;Rivera-Becerril等[7]研究了丛枝菌根在降低豌豆Cd2+危害上的作用;Ouzounidou等[8]研究了Cd2+损伤小麦叶细胞超显微结构的机理;另外,还有一些研究证实了Cd2+会干扰植物蛋白质的合成以及其他许多代谢过程[9-12].
转录组学(Transcriptomics)是从整体水平上研究细胞中基因转录的情况及调控规律的学科,近年来一些学者利用转录组技术研究Cd2+胁迫条件下植物如何调控基因的表达[13-17],探讨mRNA与其指导合成的蛋白质之间的关系,取得了大量研究成果[18].蛋白质组学是在整体水平上研究细胞内蛋白质组成及其活动规律的学科,利用蛋白质组技术研究多种植物的 Cd2+危害,如水稻(Oryza sativa)[19-20]、拟南芥(Arabidopsis thaliana)[21-22]、黄豆(Glycine max)[23]、杨树(Populus alba)[2]等,结果表明,Cd2+可以影响光合作用电子传递系统、GSH生物合成、ATP代谢等相关蛋白的差异表达.
萝卜作为广泛栽种的农作物之一,其耐Cd2+机理的研究相对较少,尤其是利用蛋白质组技术对此类问题进行的研究.本课题组利用该技术对萝卜的根系全蛋白质组和根系线粒体蛋白质组进行分析,试图了解萝卜在Cd2+胁迫下参与抗性反应的蛋白质及其变化,探讨萝卜的Cd2+害及耐Cd2+机理.同时,此研究也为农业上利用蛋白质组技术检测蔬菜的Cd2+害以及系统分析蔬菜的耐Cd2+机理提供一种技术手段,为蔬菜安全生产提供服务.
1 材料与方法
1.1 植物材料与培养
选取饱满、大小均一的小沙窝萝卜(Raphanus sativus L.)种子,经质量浓度为1.0 mg/mL的HgCl2表面消毒5 min,用自来水冲洗2次,置于铺有蒸馏水湿润的定性滤纸的培养皿中连续培养.22℃恒温光照条件下培养16 h后,18℃恒温黑暗条件下继续培养8 h.3 d后用浓度分别为10、50、100、150 μmol/L的CdCl2处理幼苗12 h(根施),切取胚根为蛋白质分析样品,对照组样品为未经处理的3 d幼苗胚根.
1.2 蛋白制备
1.2.1 根系全蛋白的制备
制备蛋白质样品参照Yan等[24]的方法.在液氮中将根尖组织快速冷冻研磨,用含质量浓度0.7 mg/mL二硫苏糖醇(DTT)的体积分数为10%的冷丙酮悬浮匀浆液,-20℃下温育1 h.在4℃下3 500×g离心5 min,用含质量浓度0.7 mg/mL DTT的丙酮重悬离心所得的碎片沉淀,-20℃下温育1 h,再在4℃下1 500×g离心30 min.上述步骤重复3次.样品冻干后溶解于样品缓冲液中[8mol/L尿素,35 mmol/L Tris,质量浓度 40 mg/mL 3-二乙胺-丙磺酸(CHAPS),体积分数为1%且pH为5~7的两性离子,体积分数为0.4%pH3~10的两性离子,质量浓度为10 mg/mL的DTT].样品蛋白质含量的测定参考Bradford[25]的方法,用牛血清白蛋白(BSA)作为标准.
1.2.2 根系线粒体分离与线粒体蛋白质制备
称取胚根30 g,剪成5~10 mm长度的碎片,加入100 mL预冷的研磨介质[0.3 mol/L甘露醇,50 mmol/L焦磷酸钠,质量浓度为5 mg/mL的BSA,5 mg/mL的聚乙烯吡咯烷酮-40(PVP40),2 mmol/L乙二醇-双-四乙酸(EGTA),20 mmol/L半胱氨酸(Cys),pH8.0],在细胞破碎仪上破碎均匀后,用4层无菌纱布过滤,收集滤液.滤液在4℃下1000×g离心5min,取上清液,4℃下18000×g离心15min,弃上清液.用研磨介质重悬得到的沉淀,重复一次上面2步离心过程.用甘露醇缓冲液[0.3 mol/L甘露醇,1 mg/mL BSA,10 mmol/L N-三甲基-2-氨基乙磺酸-氢氧化钠(TES-NaOH),pH7.5]重悬得到的细胞器沉淀.预备质量浓度分别为180、230、400 mg/mL的Percoll与甘露醇缓冲液的混合液,按照上述浓度混合液的体积比为2∶4∶1在离心管中自上向下排列.将重悬液铺在离心管中Percoll的不连续梯度混合液上,4℃下40 000×g离心45 min,吸出在230和400 mg/mL Percoll的分界处出现的不透明条带,该条带即为线粒体条带.4℃下15 000×g离心15 min,沉淀即为浓缩的线粒体.
用甘露醇缓冲液重悬之后,铺在自形成的Percoll梯度缓冲液上,即含280 mg/mL Percoll的蔗糖缓冲液[0.3 mol/L蔗糖,1 mg/mL BSA,10 mmol/L TES-NaOH,pH7.5]上,4℃下40000×g离心30min.在Percoll梯度的顶端形成线粒体条带,Percoll梯度底端形成的条带则为过氧化物酶物质.吸出线粒体条带,4℃下15 000×g离心15 min.
用甘露醇缓冲液重悬沉淀,4℃下15 000×g再次离心15 min.重复上一步,即可得到较纯的线粒体沉淀.将丙酮加入到线粒体样品中至最终体积分数为80%,抽提蛋白质,-20℃下放置4 h.4℃下20 000×g离心15 min后,用等电聚焦裂解液[6 mol/L尿素,2 mol/L硫脲,20 mg/mL CHAPS,体积分数2%两性电解质,2 mmol/L三丁膦,0.01 mg/mL溴酚蓝]重悬沉淀,置于冰上2 h.
1.3 双向凝胶电泳(2-DE)分析
蛋白质的双向凝胶电泳(2-DE)分析参阅Castro等[26]的方法进行.使用长度为13 cm的pH3~10的固相化pH梯度(IPG)胶条,操作步骤参照Bio-Rad产品说明书.取待测蛋白样品60 μg,用样品缓冲液稀释至300 μL,将干的IPG胶条放在含待测样品的缓冲液中,300 V下水化10 h,使待测样品吸入到胶条中.第一向等电聚焦参数设定如下:300 V下1 h,1 000 V下1 h,8 000 V下2 h.等电聚焦结束后将胶条放在胶条平衡液中[60 mmol/L Tris-HCl,pH6.8,10 mg/mL DDT,10 mg/mL甘氨酸,20 mg/mL十二烷基硫酸钠(SDS)]平衡20 min.第二向12.5%(质量分数)SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)参考Laemmli[27]的方法进行.将等电聚焦后的胶条放在第二向凝胶的上面,用含0.15 mol/L Bis-Tris、0.1 mol/L HCl和2 mg/mL SDS的10 mg/mL琼脂糖封胶,凝固后在80 V下电泳5 h,结果重复3次.采用银染法[28]染色显现结果.用GS-800考马斯亮蓝对MS分析胶染色,色谱扫描仪记录图像,用PDQuest软件检测、匹配和鉴别分析凝胶斑点,找出对照组材料和处理组材料之间有差异的蛋白质斑点,进行基质辅助激光解吸电离飞行时间质谱(MALDI-TOF-MS)分析.
1.4 凝胶消化和MALDI-TOF-MS分析
把经鉴别有差别的目标蛋白质斑点从制备胶上切下,超纯水洗3次,用50 mmol/L NH4HCO3脱色2次,经体积分数为100%的乙腈干燥后,在体积分数为50%的乙腈溶液中,用体积分数为0.1%三氟乙酸(TFA)37℃下孵育过夜,混匀、冻干制备物,用含有体积分数为1%的TFA和体积分数为50%的α-氰基-4-羟基肉桂酸溶液溶解制备物等待检测.利用ABI4700型(美国)正离子生物质谱仪进行MALDI-TOF MS分析,胰蛋白酶自动降解片段为内部标准校正.使用MASCOT软件在NCBInr绿色植物数据库(Viridiplantae)上进行查询,明确其归属.
2 结果与分析
利用2-DE技术,分析萝卜幼苗经10、50、100和150 μmol/L Cd2+处理12 h后胚根中全蛋白质组和线粒体蛋白质组的情况.结果表明,经10 μmol/L Cd2+诱导后胚根中的蛋白质组没有产生变化;在浓度为50 μmol/L Cd2+下,蛋白质斑点包括全蛋白质组和线粒体蛋白质组开始出现变化,主要表现在蛋白质的含量上,即部分蛋白质的表达产生上调、下调现象,几乎没有出现新诱导的蛋白质斑点或某些蛋白质斑点的抑制表达现象,如表1所示;但在100 μmol/L时,胚根中的全蛋白质组和线粒体蛋白质组均有明显变化,统计结果表明,共有44个蛋白质斑点产生变化,其中新诱导蛋白质斑点1个,抑制表达蛋白质斑点7个,上调6个,下调30个,与处理浓度50 μmol/L Cd2+相比,出现了个别蛋白质斑点的诱导形成和部分原有蛋白质斑点抑制合成的现象;Cd2+浓度150 μmol/L下处理萝卜幼苗,其全蛋白质组和线粒体蛋白质组的变化与Cd2+浓度100 μmol/L下的处理结果类似.
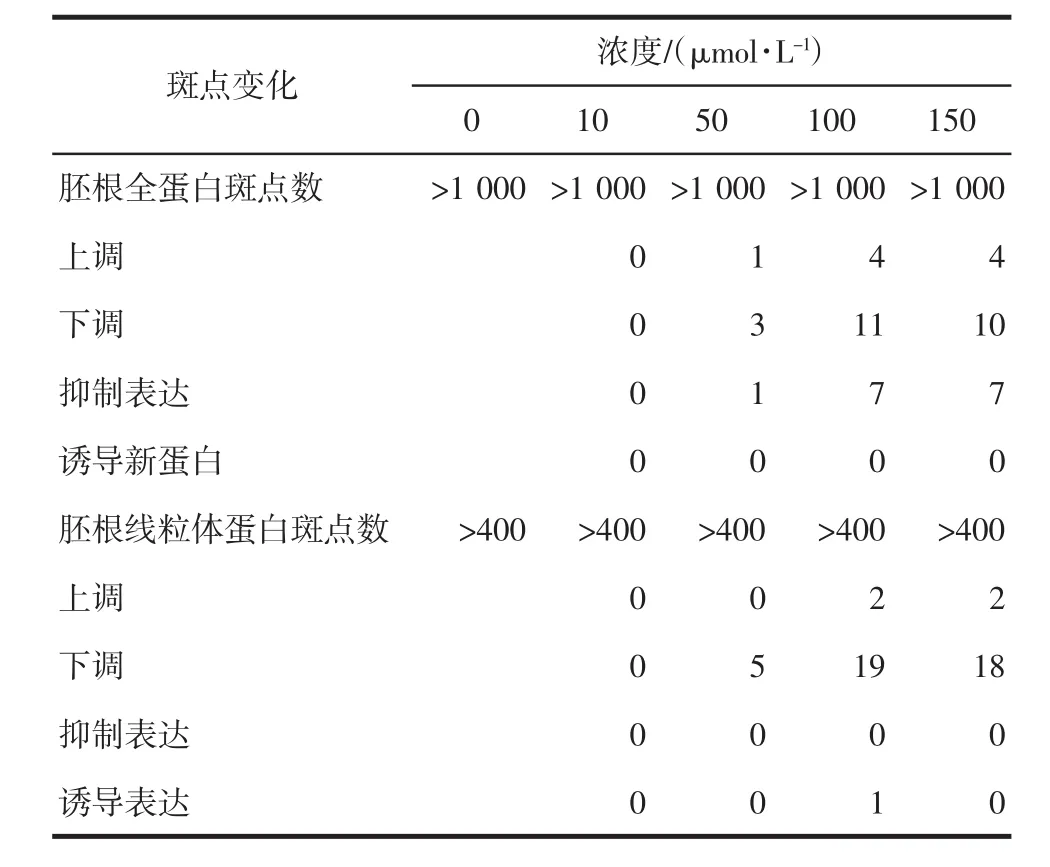
表1 不同浓度Cd2+处理12 h后萝卜幼苗胚根蛋白质组变化Tab.1 Changes in root proteomic of radish seedlings treated with different concentration of Cd2+for 12 h
2.1 胚根全蛋白质组
利用2-DE技术,新得到的胚根全蛋白质组谱型见图1,第一向水平轴表示的是等电聚焦,pH范围是4.5~8.6,第二向为表示相对分子质量的SDSPAGE垂直胶,相对分子质量范围为1.4×104~9.7×104(生物学表示为14~97 kDa).图中箭头指的是有含量变化或新诱导出和消失的蛋白质斑点.
在对照组(0 μmol/L)和处理组(100 μmol/L)中,多于1 000个左右的蛋白质斑点被检测到,其中有22个蛋白质斑点在与Cd2+反应中表现出差异表达现象,包括11个蛋白质斑点(斑点4、斑点9~18)下调,4个蛋白质斑点(斑点19~22)上调,7个蛋白质斑点(斑点 1~3、5~8)被抑制表达.对这 22个与Cd2+诱导相关的蛋白质进行MALDI-TOF-MS分析,结果见表2,质谱鉴别的Cd2+诱导后抑制表达的蛋白质斑点中7个蛋白质斑点的归属得到鉴别.表3为蛋白质含量上调和下调的蛋白质斑点,除斑点22没有鉴别外,其余蛋白质归属均得到鉴别.

图1 萝卜幼苗经100 μmol/L CdCl2处理12 h后根系内全蛋白质组的变化Fig.1 Changes in root proteomic of radish seedlings treated with 100 μmol/L CdCl2for12 h
2.2 胚根线粒体蛋白质组
萝卜幼苗经Cd2+诱导后,根系中超过400个线粒体蛋白质斑点被检测到,有22个线粒体蛋白质产生变化,其中19个蛋白质(斑点1~19)下调,2个斑点(斑点20~21)上调,1个新的线粒体蛋白质斑点(斑点22)被诱导合成(图2).
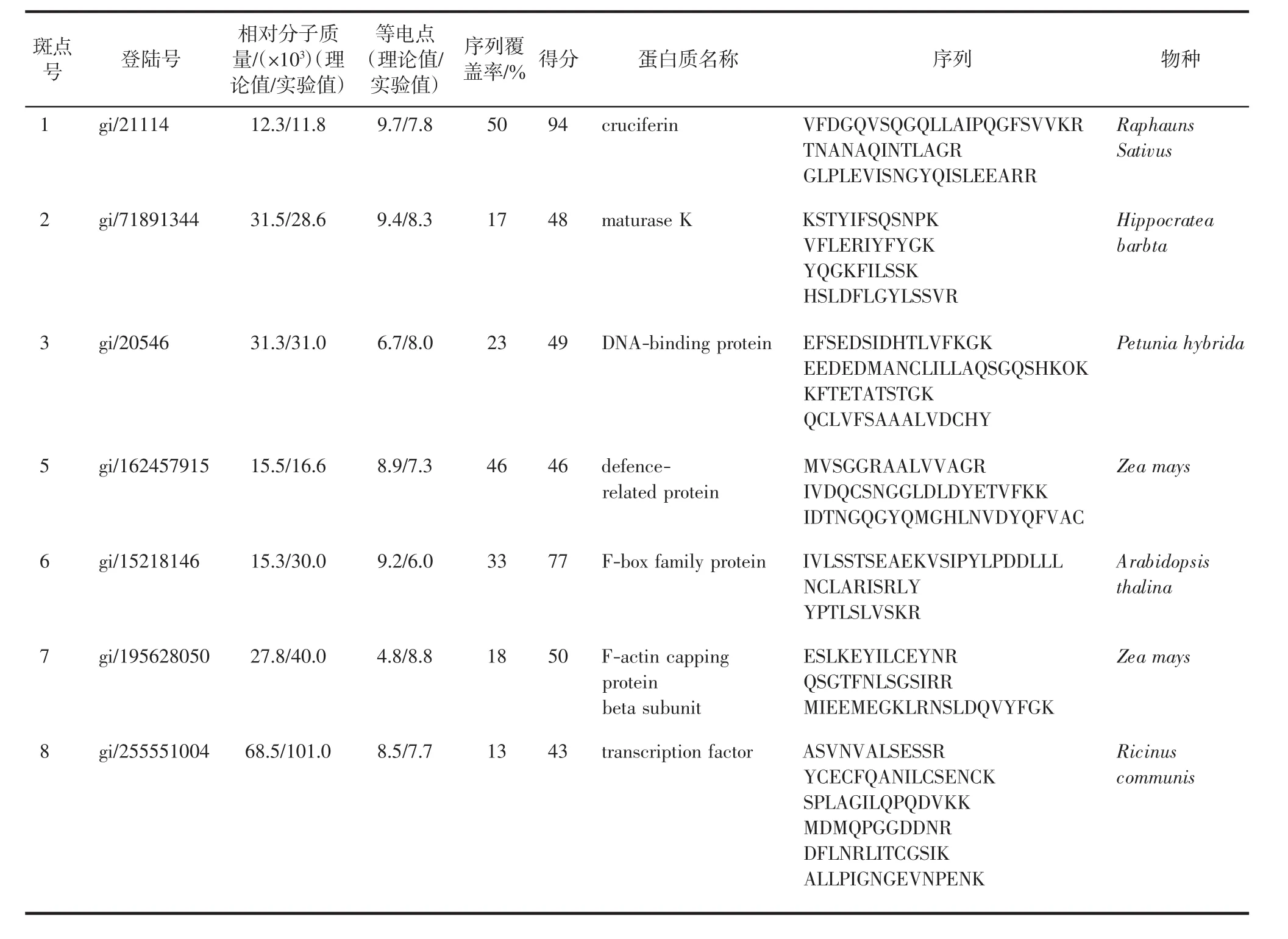
表2 根系全蛋白质组内被抑制表达的蛋白质斑点Tab.2 Inhibition expressed proteins identified by MALDI-TOF-MS in root proteomic
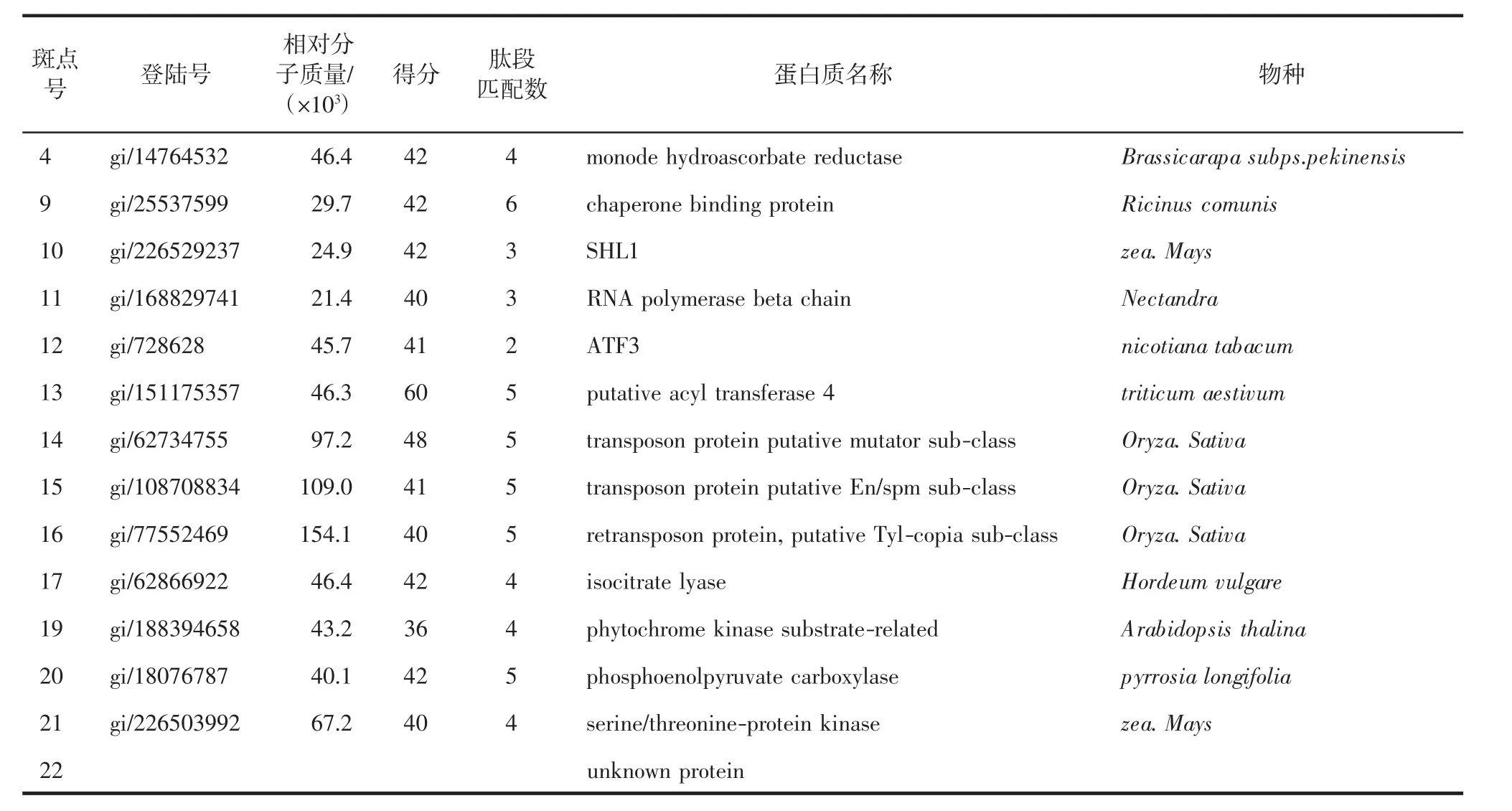
表3 根系全蛋白质组内上调和下调的蛋白质斑点Tab.3 Differential expressed proteins(down-or up-regulated)identified by MALDI-TOF-MS in root proteomic

图2 萝卜幼苗经100 μmol/L CdCl2处理12 h后根系线粒体差异表达蛋白质组的变化Fig.2 Changes in root mitochondrial proteomic of radish seedlings treated with 100 μmol/L CdCl2for 12 h
通过质谱分析,18个线粒体蛋白质的归属得到鉴别,结果见表4.22个斑点中有4个斑点因所鉴别的蛋白质斑点得分偏低或实验所得到的蛋白质相对分子质量小、pI与理论值偏差高而未能鉴别.
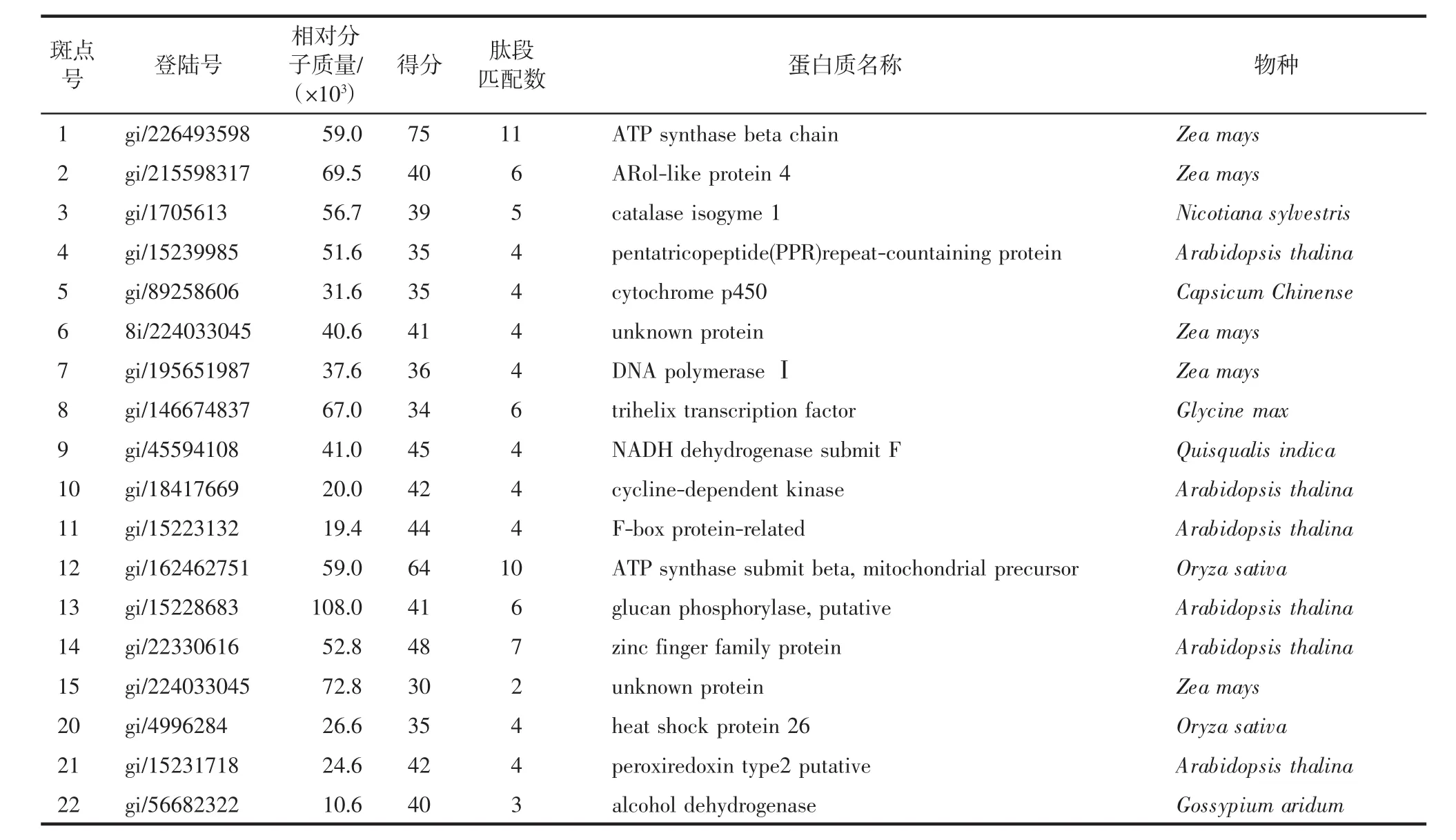
表4 上调和下调的线粒体蛋白质斑点Tab.4 Differential expressed mitochondrial proteins(down-or up-regulated)identified by MALDI-TOF-MS
3 讨论
利用蛋白质组技术研究作物的Cd2+害及耐Cd2+机理已有很多报道.在水稻中,Cd2+可以影响正常的光合作用,损坏与光合作用相关的蛋白,如RUBisco;100 μmol/L Cd2+可以诱导一些调控蛋白如ERI类受体蛋白激酶、细胞分裂素氧化酶以及一些与代谢相关的酶,如肉桂醇脱氢酶[24].在拟南芥中,发现Cd2+能激活碳、氮和硫代谢,促使合成一些螯合分子,如植物螯合肽(phytochelatin PC)或它的前体GSH[26].在杨树中发现Cd2+会严重影响卡尔文循环和光合作用电子传递系统[2],多种与此相关的蛋白质表达丰度减少.在绿藻中也得出与杨树相同的实验结果.这些研究为了解植物的Cd2+害及耐Cd2+机理提供了很多帮助,为生产上减少Cd2+害造成的损失也有一定意义.但此类研究针对叶片蛋白质组方面偏多,而直接接触Cd2+害的组织胚根蛋白质组则相对较少.
本研究以沙窝萝卜为材料,研究了不同Cd2+浓度(10、50、100、150 μmol/L)处理 12 h后,萝卜根系中蛋白质组的变化.结果表明,根系全蛋白质组中约有1000多个蛋白质斑点、根系线粒体蛋白质组中约有400多个蛋白质斑点被检测到.Cd2+浓度小于50 μmol/L时,不足以引起上述2种蛋白质组的变化;在Cd2+浓度为50 μmol/L时,均发现根系全蛋白和线粒体蛋白质组有部分蛋白表达丰度上的变化;变化最明显的是Cd2+浓度达到100 μmol/L时,根系的蛋白质组中有7种蛋白质被抑制表达,从新鉴别的蛋白质功能归属上,有负责种子发芽、幼苗生长贮藏营养的cruciferin(斑点1)、行使基因中内含子剪接的maturase K(斑点2)、负责DNA合成(斑点3)、不良环境抗御(斑点5)、基因转录(斑点8)、信号转导(斑点6)以及细胞结构维持(斑点7)等相关蛋白.根系中除了抑制表达的8种蛋白之外,至少还有14种蛋白质的表达量产生明显变化,从所鉴别的功能看,这些产生上调或下调的蛋白质,其基本功能涉及基因转座、RNA合成、蛋白质剪切与折叠、能量代谢等.根系线粒体蛋白质组检测结果表明,有15种位于线粒体中的蛋白质的表达丰度发生变化,这些变化的线粒体蛋白质除有2种蛋白质的归属未被鉴别外,其余13种线粒体蛋白质中,有 6种蛋白质(斑点 1、3、5、9、12、13)与能量代谢相关.
本研究通过蛋白质组技术,分析萝卜幼苗根系对Cd2+胁迫的反应,得到的初步实验结果有2个方面:(1)50 μmol/L Cd2+开始引起萝卜根系蛋白质组的变化,Cd2+浓度为100 μmol/L时有多种蛋白质丢失和表达丰度上产生变化,从蛋白质组角度可以认为,50~100 μmol/L是萝卜对Cd2+反应的临界剂量;(2)蛋白质组技术不仅可以了解萝卜在Cd2+诱导下体内转译水平上蛋白质组的变化,也可以解释转译后修饰的蛋白质组变化的信息,藉此可以全面了解植物Cd2+害及耐Cd2+机理.
[1]HAJDUCH M,RAKWAL R,AGRAWAL G K,et al.High-resolution two-dimensional electrophoresis separation of proteins from metal-stressed rice(Oryza sativa L.) leaves:Drastic reductions/frag-mentation of ribulose-1,5-bisphosphate carboxylase/oxygenase and induction of stress-related proteins[J].Electrophoresis,2001,22(13):2824—2831.
[2]KIEFFER P,DOMMES J,HOFFMANN L,et al.Quantitative changes in protein expression of cadmium-exposed poplar plants[J].Proteomics,2008,8(12):2514—2530.
[3]GASIC K,KORBAN S S.Transgenic Indian mustard(Brassica juncea)plants expressing an Arabidopsis phytochelatin synthase(AtPCS1)exhibit enhanced As and Cd tolerance[J].Plant Mol Biol,2007,64(4):361—369.
[4]JARUP L,ALFVEN T.Low level cadmium exposure,renal and boneeffects-theOSCARstudy[J].Biometals,2004,17(5):505—509.
[5]HART J J,WELCH R M,NORVELL W A,et al.Characterization of cadmium binding,uptake,and translocation in intact seedlings of bread and durum wheat cultivars[J].Plant Physiol,1998,116(4):1413—1420.
[6]SHAH K,DUBEY R S.A 18 kDa cadmium inducible protein complex:Its isolation and characterization from rice(Oryza sativa L.)seedlings[J].J Plant Physl,1998,152(4/5):448—454.
[7]RIVERA-BECERRIL F,CALANTZIS C,TURNAU K,et al.Cadmium accumulation and buffering of cadmium-induced stress by arbuscular mycorrhiza in three Pisum sativum L genotypes[J].J Exp Bot,2002,53(371):1177—1185.
[8]OUZOUNIDOU G,MOUSTAKAS M,ELEFTHERIOU E P.Physiological and ultrastructural effects of cadmium on wheat(Triticum aestivumL.)leaves[J].ArchEnvironContamToxicol,1997,32(2):154—160.
[9]SIESKO M M,FLEMING W J,GROSSFELD R M.Stress protein synthesis and peroxidase activity in a submersed aquatic macrophyte exposed to cadmium[J].Environ Toxicol Chem,1997,16(8):1755—1760.
[10]SHUKLA U C,SINGH J,JOSHI P C,et al.Effect of bioaccumulation of cadmium on biomass productivity,essential trace elements,chlorophyll biosynthesis,and macromolecules of wheat seedlings[J].Biol Trace Elem Res,2003,92(3):257—274.
[11]ROMERO-PUERTAS M C,PALMA J M,GOMEZ M,et al.Cadmium causes the oxidative modification of protein in pea plants[J].Plant Cell Environ,2002,25(5):677—686.
[12]UEKI S,CITOVSKY V.The systemic movement of a tobamovirus is inhibited by a cadmium-ion-induced glycine-rich protein[J].Nat Cell Biol,2002,4(7):478—486.
[13]WEBER M,TRAMPCZYNSKA A,CLEMENS S.Comparative transcriptome analysis of toxic metal responses in Arabidopsis thaliana and the Cd2+-hypertolerant facultative metallophyte Arabidopsis halleri[J].Plant Cell Environ,2006,29(5):950—963.
[14]SUDO E,ITOUGA M,YOSHIDA-HATANAKA K,et al.Gene expression and sensitivity in response to copper stress in rice leaves[J].J Exp Bot,2008,59(12):3465—3474.
[15]ABERCROMBIE J M,HALFHILL M D,RANJAN P,et al.Transcriptional responses of Arabidopsis thaliana plants to As(V)stress[J].BMC Plant Biology,2008,8:87.
[16]NORTON G J,LOU-HING D E,MEHARG A A,et al.Rice-arsenate interactions in hydroponics:whole genome transcriptional analysis[J].J Exp Bot,2008,59(8):2267—2276.
[17]VAN DE MORTEL J E,SCHAT H,MOERLAND P D,et al.Expression differences for genes involved in lignin,glutathione and sulphate metabolism in response to cadmium in Arabidopsis thaliana and the related Zn/Cd-hyperaccumulator Thlaspi caerulescens[J].Plant Cell Environ,2008,31(3):301—324.
[18]GYGI S P,ROCHON Y,FRANZA B.R,et al.Correlation between protein and mRNA abundance in yeast[J].Mol Cell Biol,1999,19(3):1720—1730.
[19]AHSAN N,LEE S H,LEE D G,et al.Physiological and protein profiles alternation of germinating rice seedlings exposed to acute cadmium toxicity[J].C R Biologies,2007,330(10):735—746.
[20]AINA R,LABRA M,FUMAGALLI P,et al.Thiol-peptide level and proteomic changes in response to cadmium toxicity in Oryza sativa L.roots[J].Environ Exp Bot,2007,59(3):381—392.
[21]ROTH U,ROEPENACK-LAHAYE E V,CLEMENS S.Proteome changes in Arabidopsis thaliana roots upon exposure to Cd2+[J].J Exp Bot,2006,57(15):4003—4013.
[22]SARRY J E,KUHN L,DUCRUIX C,et al.The early responses of Arabidopsis thaliana cells to cadmium exposure explored by protein and metabolite profiling analyses[J].Proteomics,2006,6(7):2180—2198.
[23]SOBKOWIAK R,DECKERT J.Proteins induced by cadmium in soybean cells[J].J Plant Physiol,2006,163(11):1203—1206.
[24]YAN S P,TANG Z C,SU W,SUN W A,et al.Proteomic analysis of salt stress-responsive proteins in rice root[J].Proteomics,2005,5(1):235—244.
[25]BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of proteindye binding[J].Anal Biochem,1976,72(1/2):248—254.
[26]CASTRO A J,CARAPITO C,ZORN N,et al.Proteomic analysis of grapevine(Vitis vinifera L.)tissues subjected to herbicide stress[J].J Exp Bot,2005,56(421):2783—2795.
[27]LAEMMLI U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227(5259):680—685.
[28]WRAY W,BOULIKAS T,WRAY V P,et al.Sliver staining of proteins in polyacrylamide gels[J].Anal Biochem,1981,118(1):197—203.
