RNAi沉默Notch1基因对人骨肉瘤细胞MG63的促凋亡作用
2013-08-05吴德明杨志强
吴德明,杨志强,刘 翔,江 川,戴 闽
(南昌大学第一附属医院,南昌330006)
骨肉瘤是是儿童和青少年最常见的骨原发性恶性肿瘤,致残率及病死率均高。尽管近年来骨肉瘤的诊断、治疗水平有了很大的提高,但骨肉瘤保肢治疗效果远未达到令人满意的程度。Notch信号通路是介导细胞与细胞之间直接接触的主要信号通路之一,调控多细胞机体的细胞增殖、分化和凋亡[1~3]。人类许多肿瘤中均可检测到Notch信号通路活性的改变,由于肿瘤来源及其微环境的不同,Notch信号通路具有促进或抑制肿瘤发生、发展的双重作用[4,5]。近年来,特异性阻断 Notch信号通路从而起到抗肿瘤作用,已作为肿瘤治疗的新途径受到了广泛关注[6,7]。Notch1 基因是 Notch 信号通路中的重要组成部分,沉默其表达将明显抑制Notch信号通路的功能[8,9]。2011年3月 ~2012年 5月,本实验通过观察沉默Notch1基因对人骨肉瘤细胞MG63增殖和凋亡的影响,探讨其可能的作用机制,为今后通过抑制Notch信号通路治疗骨肉瘤提供实验和理论依据。
1 材料与方法
1.1 材料
1.1.1 细胞系 人骨肉瘤细胞系MG63由武汉大学中国典型生物保藏中心提供,培养于含10%小牛血清的RPMI 1640培养液中,37℃、5%CO2培养箱内常规传代培养。
1.1.2 试剂 mNotch-1短发夹状 RNA(mNotch-1 shRNA)片段的设计及合成:根据人Notch1基因的cDNA 序列(Genbank:NM_017617.3),利用 Ambion公司在线设计软件,设计出人Notch1基因RNA干扰(RNAi)片段(大连宝生物有限公司)。AnnexinVFITC试剂购自晶美生物工程有限公司,小牛血清、RPMI 1640培养基、噻唑蓝(MTT)购自美国Hyclone公司。兔抗人Notch1抗体购自美国ABcom公司,兔抗人Bcl-2和Bax抗体以及辣根过氧化物酶标记羊抗兔IgG购自Santa Cruz公司,PVDF膜为Millipore公司提供。
1.2 方法
1.2.1 细胞增殖抑制实验(MTT比色法) 将MG63细胞以1×104/mL接种于96孔培养板,加无血清培养基常规培养24 h,然后利用mNotch-1 shRNA处理细胞,利用MTT技术分析mNotch-1 shRNA转染前及转染24、48、72 h时MG63细胞的增殖情况。加入新配制的MTT,置37℃、5%CO2培养箱内培养4 h,弃培养液,加入二甲基亚砜(DMSO),10 min后,利用酶标仪检测490 nm吸光度(A)值。根据公式:细胞抑制率=(1-实验组A值/对照组A值)×100%。以上实验均重复3次。
1.2.2 流式细胞仪检测 调整细胞密度为5×105个/mL,经 mNotch-1 shRNA 处理细胞 24、48、72 h,分别制成单细胞悬液,加AnnexinV-FITC室温避光10 min,冲洗、离心、重悬细胞,加入 20 μg/mL PI,4℃避光30 min后上机检测。对照组为mNotch-1 shRNA处理后即刻上机检测(0 h)。每组设3个样本。分析软件计算细胞凋亡率。
1.2.3 Western blot检测相关目的蛋白表达 取经mNotch-1 shRNA 处理24、48、72 h后的细胞,调整密度为1×106/mL,用胰蛋白酶消化液消化后,1 000 r/min离心5 min收集细胞,弃上清,加入0.5 mL预冷蛋白裂解液,剧烈振荡使细胞重悬。按比例加入1 mL蛋白抽提试剂,振荡均匀,4℃静置10 min。随后12 000 r/min、4℃离心10 min,取中间相,最后用无水乙醇洗涤并沉淀蛋白。采用BCA试剂盒测定蛋白含量。取 100 μg总蛋白上样于 10%SDSPAGE,电泳后转PVDF膜,5%脱脂奶粉封闭,加兔抗人 Notch1抗体(1∶500)、兔抗人 Bcl-2抗体(1∶800)和兔抗人Bax抗体(1∶800)4℃孵育过夜,加入辣根过氧化物酶标记羊抗兔IgG(浓度1∶4 000)室温孵育1 h,ECL发光剂发光,定影、显影,胶片曝光。用同样方法以β-actin作上样对照。利用Quantity One软件分析测定条带相对A值,并计算 ABcl-2/Aβ-actin和 ABax/Aβ-actin值。
2.4 统计学方法数据以¯x±s表示,用SPSS12.0软件进行单因素方差分析和Pearson相关分析,以P≤0.05为差异有统计学意义。
2 结果
2.1 RNAi沉默Notch1基因对骨肉瘤细胞MG63增殖的影响 mNotch-1 shRNA处理细胞后,细胞生长受到不同程度抑制,抑制率与作用时间呈现明显的依赖效应,相关分析显示两者呈正相关(r=0.994,P <0.01)。MTT 检测发现,mNotch-1 shRNA处理细胞24 h后,MG63细胞的抑制率为20%,48 h达到半数有效抑制率,在处理72 h后细胞抑制率达到最高值85%,不同时间处理组与空白对照组比较差异均有统计学意义(P<0.05)。
2.2 流式细胞仪检测结果 转染mNotch-1 shRNA组MG63细胞的凋亡率随着时间的延长而逐渐增加,在作用 24、48、72 h后,细胞凋亡率分别为19.4%、37.6%、51.6%,对照组细胞凋亡率为9.9%。实验组细胞凋亡率较对照组均有明显升高(P <0.05),见图1。
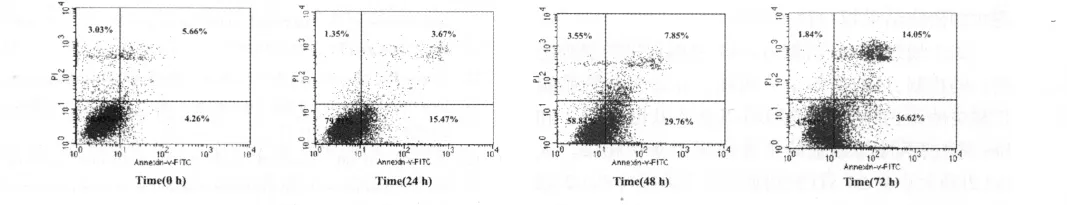
图1 Annexin V-FITC染色检测结果
2.3 Western blot检测结果 mNotch-1 shRNA处理后,随着时间的延长,MG63细胞中Notch1基因表达明显减少(P<0.01)。另外阻断Notch信号通路可以显著抑制Bcl-2基因的表达并上调Bax基因的表达(P <0.05),见图2。
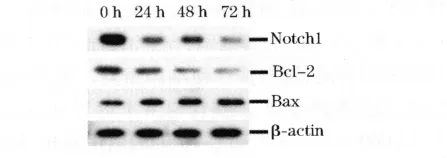
图2 Western blot检测 Notch1、Bcl-2和Bax基因的蛋白表达水平
3 讨论
Notch信号通路与肿瘤发生发展关系密切,最早发现Notch信号通路与肿瘤有关是在1991年发现Notch1在急性T淋巴细胞白血病中起作用,目前人们在许多肿瘤中发现有 Notch信号的异常[10]。尽管Notch信号在少数肿瘤中表现出肿瘤抑制作用,但是其信号传导的活化与多种肿瘤的发生发展有关。治疗与Notch相关的肿瘤,可以把Notch信号传导通路作为选择性杀死肿瘤细胞的活性靶点,通过阻断Notch信号达到治疗肿瘤的效果。本实验利用mNotch-1 shRNA处理体外培养的MG63细胞后,MTT结果显示处理组细胞增殖均受到不同程度的抑制,表明了在人骨肉瘤中阻断Notch信号通路可以抑制骨肉瘤细胞增殖。
Kerr等于1972年首先提出细胞凋亡的概念。近年来随着对凋亡分子机理的逐步认识,人们发现肿瘤发生是细胞增殖过度与凋亡减少导致过量蓄积的结果。Rieger等发现诱导肿瘤细胞凋亡是一条有效的肿瘤治疗途径。许多具有细胞毒性的抗肿瘤药物都可以诱导凋亡,而且肿瘤发生过程中出现抑制凋亡的相关基因变异,会减弱肿瘤对药物的敏感性。本研究结果显示,mNotch-1 shRNA处理MG63细胞后,细胞凋亡增加,且随着mNotch-1 shRNA处理的时间增加,细胞凋亡率随之增加,与对照组比较,不同时间段均有统计学差异。结合MTT结果,进一步说明RNAi沉默Notch1基因能有效诱导人MG63细胞凋亡。这与 Fan 等[11]、Cuevas等[12]利用 γ-分泌酶抑制剂抑制Notch信号通路可诱导其他肿瘤细胞凋亡的研究结果相一致。
关于通过RNAi沉默Notch1基因促进肿瘤细胞凋亡的机制,目前尚不十分明确。在诸多与细胞凋亡相关的蛋白中,已证实Bcl-2家族基因(Bcl-2和Bax等)的活性与细胞的生存和凋亡密切相关。人Bcl-2是大小为26 kD的跨膜蛋白,通过与Bcl-2家族成员之间的相互作用调控细胞的生存与凋亡[13]。本实验结果显示,RNAi沉默Notch1基因可以有效降低MG63细胞Bcl-2蛋白的表达水平,并上调Bax蛋白的表达。而最近一项研究结果显示,激活Notch信号通路可以抑制Bax诱导的细胞凋亡。这些结果说明RNAi沉默Notch1基因诱导MG63细胞凋亡的机制可能与调控Bcl-2家族基因的表达有关。
但由于Notch信号通路有时起抑癌作用,有时起原癌基因的作用,必须分清Notch信号通路在特定肿瘤中的作用机制。虽然有关Notch信号通路在肿瘤发病机制和肿瘤治疗中的作用尚有许多问题需要回答,但随着研究的深入,Notch信号通路作为新一类抗肿瘤治疗靶点将具有广阔的应用前景。
[1] Ilagan MX,Kopan R.SnapShot:notch signaling pathway[J].Cell,2007,128(6):1246.
[2]Ehebauer M,Hayward P,Arias AM.Notch,a universal arbiter of cell fate decisions[J].Science,2006,314(5804):1414-1415.
[3]Hellström M,Phng LK,Hofmann JJ,et al.Dll4 signalling through Notch1 regulates formation of tip cells during angiogenesis[J].Nature,2007,445(7129):776-780.
[4]Cook M,Yu XM,Chen H.Notch in the development of thyroid C-cells and the treatment of medullary thyroid cancer[J].Am J Transl Res,2010,2(1):119-125.
[5]Chen Y,Li D,Liu H,et al.Notch-1 signaling facilitates survivin expression in human non-small cell lungcancer cells[J].Cancer Biol Ther,2011,11(1):14-21.
[6]Bao B,Wang Z,Ali S,et al.Notch-1 induces epithelial-mesenchymal transition consistent with cancer stem cell phenotype in pancreatic cancer cells[J].Cancer Lett,2011,307(1):26-36.
[7]Park JT,Chen X,Tropè CG,et al.Notch3 overexpression is related to the recurrence of ovarian cancer and confers resistance to carboplatin [J].Am J Pathol,2010,177(3):1087-1094.
[8]Bin Hafeez B,Adhami VM,Asim M,et al.Targeted knockdown of Notch1 inhibits invasion of human prostate cancer cells concomitant with inhibition of matrix metalloproteinase-9 and urokinase plasminogen activator[J].Clin Cancer Res,2009,15(2):452-459.
[9]Sjölund J,Johansson M,Manna S,et al.Suppression of renal cell carcinoma growth by inhibition of Notch signaling in vitro and in vivo[J].J Clin Invest,2008,118(1):217-228.
[10]Nickoloff BJ,Osborne BA,Miele L.Notch signaling as a therapeutic target in cancer:a new approach to the development of cell fate modifying agents[J].Oncogene,2003,22(42):6598-6608.
[11]Fan X,Mikolaenko I,Elhassan I,et al.Notch1 and notch2 have opposite effects on embryonal brain tumor growth[J].Cancer Res,2004,64(21):7787-7793.
[12]Cuevas IC,Slocum AL,Jun P,et al.Meningioma transcript profiles reveal deregulated Notch signaling pathway[J].Cancer Res,2005,65(12):5070-5075.
[13]Perumalsamy LR,Nagala M,Sarin A.Notch-activated signaling cascade interacts with mitochondrial remodeling proteins to regulate cell survival[J].Proc Natl Acad Sci USA,2010,107(15):6882-6887.
