双调控双功效溶瘤腺病毒的构建及意义
2013-08-05孙立臣潘旭波周先亭宋占文苏长青
孙立臣,潘旭波,周先亭,宋占文,苏长青
(1青岛大学医学院附属烟台毓璜顶医院,山东烟台264000;2第二军医大学东方肝胆外科医院)
随着肿瘤生物学及遗传学的研究进展,基因治疗已成为肝癌综合治疗中的重要部分。我们前期构建了针对肿瘤细胞高表达端粒酶逆转录酶(hTERT)和缺氧诱导因子-1(HIF-1)的肿瘤特异性增殖型腺病毒CNHK500,该腺病毒由hTERT启动子调控腺病毒早期增殖基因E1a表达,HIF-1调控序列区缺氧反应元件(HRE)调控早期增殖基因E1b表达,使其在双启动子的调控下实现了对癌细胞的特异性杀伤和溶解作用,又称溶瘤腺病毒[1,2]。2009年1月~2011年12月,我们在前期研究的基础上联合Survivin基因小发卡RNA(shRNA)构建了双调控双功效肿瘤特异性溶瘤腺病毒(CNHK500-shSRV-mE,以下简称双调控腺病毒),旨在为肝癌的基因治疗奠定基础。
1 材料与方法
1.1 材料 实验用质粒载体由本实验室构建并保存,正常成纤维细胞系MRC-5、BJ购自美国ATCC公司,人肝癌细胞株SMMC-7721、BEL-7402来源于中科院上海细胞所,人胚胎肾293细胞株购自加拿大Microbix Biosystems公司。DMEM培养基、胎牛血清购自GIBCO BRL公司。E1a扩增引物(上游:5'-GTG TAT TTA TAC CCG GTG AG-3',下游:5'-TGG AAG ATT ATC AGC CAG TAC-3')由上海基康生物公司完成。
1.2 双调控腺病毒构建及鉴定
1.2.1 构建 前期构建的表达质粒 pSG500,其E1a基因上游插入了人端粒酶逆转录酶启动子(hTERT),E1b上游插入了缺氧调控元件序列(HRE),于E1a表达盒上游预留了BglⅡ酶切位点。根据GenBank NM001168的Survivin基因序列设计特异shRNA。Survivin-shRNA(shSRV)序列为5'-gaa agt gcg ccg tgc cat c-3',位于全长Survivin编码序列的第387~405 bp。同时设计阴性对照序列5'-gac ttc ata agg cgc atg c-3'。编码shRNA的DNA(由武汉晶赛生物工程技术有限公司合成)结构为:BamHⅠ+U6启动子+Sense DNA+Loop(ttc aag acg)+Antisense DNA+TTTTTT+BglⅡ,克隆入 pGenesil-1.1。从pGenesil-1.1中BamHⅠ+BglⅡ酶切释放shRNA片段,插入pSG500载体的BglⅡ位点,构成pSG500-shSRV;再从pCA13-mE中BglⅡ酶切释放mE表达盒,包括 CMV启动子、mE cDNA、PolyA,插入到pSG500的BglⅡ位点,构建成功pSG500-shSRV-mE(同时携带 shSRV和 mE)。pSG500-shSRV-mE、pSG500-shSRV、pSG500-mE、pCA13-mE 分别与腺病毒包装质粒一起转染293细胞,重组出双调控腺病毒及其一系列对照腺病毒CNHK500-shSRV(仅携带shSRV)、CNHK500-mE(仅携带 mE)、Ad-mE(非增殖型腺病毒,携带mE)。
1.2.2 鉴定 各腺病毒经PCR扩增鉴定E1a序列后,于293细胞中反复扩增,氯化铯密度梯度离心纯化,TCID50法检测病毒滴度:挑取病毒克隆噬斑,提取腺病毒DNA,PCR鉴定腺病毒E1a和hTERT序列。结果显示,CNHK500-shSRV-mE、CNHK500-shSRV、CNHK500-mE病毒克隆E1a阳性,而Ad-mE为阴性(图 1);CNHK500-shSRV-mE、CNHK500-shSRV、CNHK500-mE、Ad-mE 病毒滴度分别达到2.1×1010、1.1 ×1011、7.1 ×1010、4.2 ×109pfu/mL。
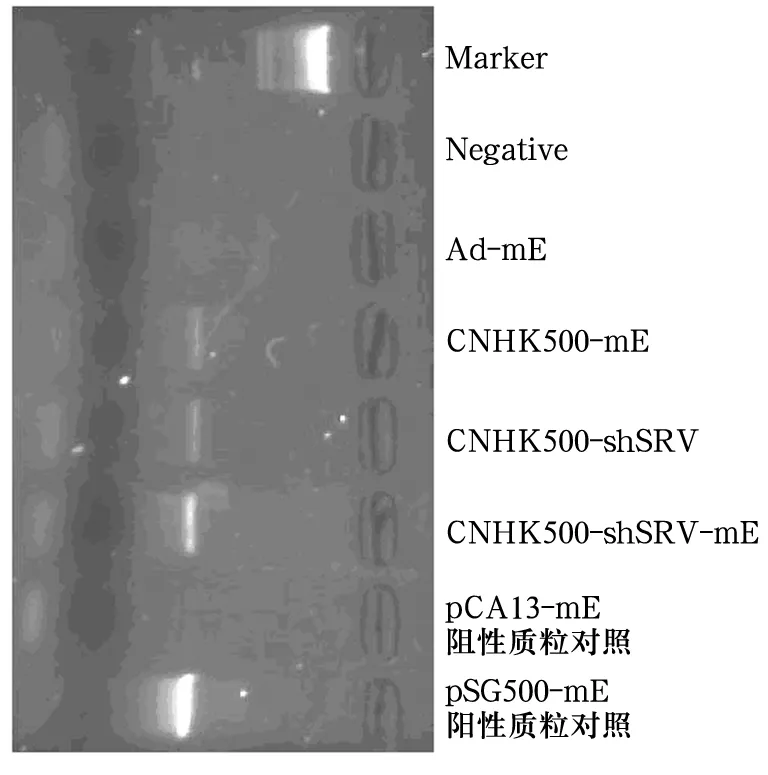
图1 各腺病毒鉴定结果
1.2.3 肝癌细胞中双调控腺病毒特异性增殖观察收集75 cm27721细胞1瓶,传至6孔板中,4×105细胞/孔,培养至对数生长期。按MOI=1分别加 入 CNHK500-shSRV-mE、 CNHK500-shSRV、CNHK500-mE、Ad-mE,继续培养,于感染后48 h回收,TCID50法检测病毒滴度。结果显示,CNHK500-shSRV-mE、CNHK500-shSRV、CNHK500-mE 均属于肿瘤特异性增殖型腺病毒,受hTERT和HRE双启动子调控,与之前的研究结果一致,即在肝癌细胞中具有高增殖活性,而在正常细胞中增殖活性较弱(P<0.01)。与 CNHK500-mE 相比,Survivin-shRNA 序列的插入没有影响病毒的增殖能力(图2)。Ad-mE为非增殖型腺病毒,在正常细胞和癌细胞中均无增殖活性。
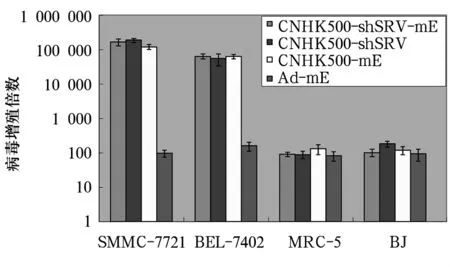
图2 各腺病毒在各细胞系中增殖倍数比较
3 讨论
失去手术机会的晚期肝癌不仅复发率高,且传统的放疗、化疗效果均不明显。近年来,基因治疗在肝癌的综合治疗中越来越受到重视[3,4],但我国已批准上市的两个腺病毒基因治疗产品rAd-p53和H101的疗效均不理想[5,6]。前者为非增殖型腺病毒,因感染癌细胞的能力有限,故介导基因表达的效率不高;后者为不带治疗基因的增殖型腺病毒,能在P53缺陷的癌细胞中增殖,但其仅依靠增殖发挥溶瘤作用,疗效不稳定。因此,开发特异性更高、安全性更好的增殖型腺病毒载体并筛选疗效明确的治疗基因,成为肿瘤治疗领域关注的热点。
针对大多肿瘤细胞高表达端粒酶逆转录酶(hTERT)、肿瘤微环境中氧分压低的两大特点,我们前期构建了hTERT启动子调控腺病毒E1a表达、缺氧反应元件(HRE)调控腺病毒E1b表达的溶瘤腺病毒CNHK500,使其在双启动子的调控下实现了对癌细胞的特异性杀伤和溶解作用,疗效和安全性均得到明显提高[1,2],成为肿瘤基因治疗良好的载体。
为使CNHK500发挥更好的抗肿瘤疗效,本研究克隆了小鼠Endostatin全长cDNA序列插入CNHK500病毒基因组,使其在溶瘤腺病毒增殖时高表达抗肿瘤血管生成因子,抑制肿瘤间质血管生成[7];同时插入凋亡抑制基因 Survivin的小发卡RNA(shRNA)沉默癌细胞Survivin表达,以抑制癌细胞增殖、诱导癌细胞凋亡,达到提高肿瘤基因治疗疗效的目的[8];实现了针对恶性肿瘤端粒酶阳性和缺氧环境的双调控作用。经鉴定,本研究构建的双调控腺病毒能够在肝癌细胞中特异性高拷贝增殖,而在正常细胞系中几乎不增殖,实现了针对恶性肿瘤端粒酶阳性和缺氧环境的双调控作用。双调控腺病毒的构建成功为肝癌的基因治疗研究奠定了基础。
[1]孙立臣.双靶向溶瘤腺病毒携带内皮抑素基因对肝癌的抑制作用[J].中华实验外科杂志,2012,29(8):1529-1531.
[2]孙立臣,张柏和,张琪,等.新型增殖型腺病毒CNHK500-hγ对肝癌细胞的杀伤作用[J].中国肿瘤生物治疗杂志,2011,18(6):635-640.
[3]Chen Z,Liu N,Zhu G ,et al.Targeting of the anti-apoptotic gene survivin in human thyroid carcinoma[J].Int J Mol Med,2012,30(3):465-472.
[4]Morandell S,Yaffe MB.Exploiting Synthetic Lethal Interactions Between DNA Damage Signaling,Checkpoint Control,and p53 for Targeted Cancer Therapy[J].Prog Mol Biol Transl Sci,2012,110(10):289-314.
[5]Guan YS,Liu Y,He Q,et al.p53 gene therapy in combination with transcatheter arterial chemoembolization for HCC:one-year follow-up[J].World J Gastroenterol,2011,17(16):2143-2149.
[6]Song X,Zhou Y,Jia R,et al.Inhibition of retinoblastoma in vitro and in vivo with conditionally replicating oncolytic adenovirus H101[J].Invest Ophthalmol Vis Sci,2010 ,51(5):2626-2635.
[7]Chan SF,Wang HT,Huang KW,et al.Anti-angiogenic therapy renders large tumors vulnerable to immunotherapy via reducing immunosuppression in the tumor microenvironment[J].Cancer Lett,2012 ,320(1):23-30.
[8]Hu Q,Li W,Hu X,et al.Synergistic treatment of ovarian cancer by co-delivery of survivin shRNA and paclitaxel via supramolecular micellar assembly[J].Biomaterials,2012 33(27):6580-6591.
